日本血吸虫重组半胱氨酸蛋白酶抑制剂对小鼠心肌梗死预后的影响及其免疫调节机制
李燕楠,杨小迪,陈思宇,颉丽英,刘思麒,高尔和,左琳
1. 山西医科大学细胞生理学教育部重点实验室基础医学院生理学系,山西 太原 030001;2. 蚌埠医学院安徽省感染与免疫重点实验室微生物学与寄生虫学系,安徽 蚌埠 233030;3. 天普大学医学院转化医学中心,美国 费城 19140
心肌梗死(myocardial infarction,MI)是一类以冠状动脉血供减少或中断为基础,伴随心肌细胞坏死、溶解,渐由肉芽组织取代的不可逆的心血管疾病[1-2]。有数据显示,目前我国心血管病患病人数约2. 9 亿,该病死亡率占所有疾病的40%,位居第一,其中,MI是风险最高的危险因素[3],其死亡率在我国呈逐年上升趋势,严重威胁人们的生命健康[4-5]。
目前,临床上采用药物溶栓、心肌再灌注、心脏再同步化及左室辅助装置等方法治疗MI,可在一定程度上改善心肌缺血,降低心肌耗氧量,缓解患者急性期的临床症状[6],但并不能从根本上减少心肌细胞的丢失及后期心室的不良重塑[7]。有研究认为,在一定程度上控制炎症反应可减少心肌细胞丢失,对MI 后不良的心肌重塑有一定保护作用[8-10]。因此,对MI 早期炎症反应进行适当干预是治疗MI 的一条有效途径。MI 后心脏的炎症反应期是MI 修复的始动期[11],死亡的心肌细胞会激活机体的先天免疫系统,一方面,白细胞趋化至损伤部位,造成邻近心肌细胞的急性坏死;另一方面,炎性细胞清除坏死细胞及基质碎片,为组织修复奠定基础[12]。MI 后长期过度的炎症反应使组织严重损伤、心室不良重塑及心功能恶化,最终将导致心室壁瘤、心脏破裂、心力衰竭,甚至猝死等恶性不良事件[13-15]。目前,临床上对无菌性炎症反应的调控尚无抗炎特效药,研究表明,给予适量地塞米松(dexamethasone,Dex)预处理,可减少心梗面积、心脏肌钙蛋白I 的释放及心肌细胞的凋亡,对心脏有一定的保护效应,其机制可能与其促进白介素-10(interleukin-10,IL-10)分泌有关[16-18],但糖皮质激素不可长期使用[19-20]。因此,寻找针对无菌性炎症的抗炎药物对治疗MI 显得尤为重要。
蠕虫体内的半胱氨酸蛋白酶抑制剂(cystatin)是半胱氨酸蛋白酶的高效抑制剂,其在蠕虫体内分布广泛,具有抑制蛋白酶活性、阻碍抗原提呈、调控抗炎因子和诱导抑炎特性的M2 型巨噬细胞生成等作用,利于发挥抗炎效应,对炎症性疾病具有较好的治疗效果[21-23]。有报道表明,日本血吸虫(Schistosoma japonicum)重组 cystatin(rSjcystatin)对结肠炎、脓毒症、关节炎和Ⅰ型糖尿病的治疗效果显著,但对MI产生炎症的疗效尚未明确[23-26],且rSjcystatin 对不同程度的炎症疾病,使用剂量也有差异。因此本研究通过建立MI 小鼠模型,监测小鼠生存率、心脏黏连率、炎性细胞浸润及心脏结构和功能的变化,评价rSjcystatin 对MI 疗效的影响,并检测小鼠血清中炎性因子的水平,初步探讨rSjcystatin 治疗MI 的可能机制,以期为其临床应用提供实验依据。
1 材料与方法
1. 1 主要试剂及仪器 PBS 购自美国HyClone 公司;HE 染色试剂盒及Masson 三色染色液试剂盒均购自北京索莱宝科技有限公司;兔抗CD45 单克隆抗体(#70257)购自美国 Cell Signaling Technology 公司;PV-9001 兔二步法检测试剂盒购自北京中杉金桥生物技术有限公司;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、IL-6 和 IL-10 ELISA 试剂盒购自上海达科为生物技术有限公司;转化生长因子-β1(transforming growth factor-β1,TGF-β1)ELISA 试剂盒购自中国ABclonal 公司;rSjcystatin 蛋白由安徽省蚌埠医学院杨小迪教授惠赠;小动物高分辨率成像超声仪器购自中国S-Sharp 公司。
1. 2 实验动物 清洁级C57BL / 6J 小鼠,雄性,约8周龄,体重20 ~ 22 g,购自山西医科大学动物中心,动物许可证号为:SCXK(晋)2015-0001。动物实验操作过程符合山西医科大学动物伦理学相关法规及各项规定,且获得伦理委员会认可。
1. 3 小鼠MI 模型的建立 用异氟烷气体麻醉小鼠,仰卧位固定,于左胸剪一斜型切口,止血钳钝性分离肌肉组织,于第4 肋间隙将心脏暴露于胸外,用外科手术线阻断冠状动脉左前降支,心尖部成为白色即造模成功。
1. 4 动物分组及给药 将C57BL / 6J 小鼠随机分为4 组:Sham 组(心脏左冠状动脉前降支不结扎)、PBS 组(建模后 1、3、5、7、14、28 d 分别经腹腔注射 PBS,0. 1 mL / 只)及 10、25 μg rSjcystatin 治疗组(建模后1、3、5、7、14、28 d 分别经小鼠腹腔注射含 10 及 25 μg rSjcystatin 蛋白的 PBS 混合液,0. 1 mL / 只)。Sham组8 只小鼠,其他每组均25 只。上述各组小鼠用于存活率的计算。相同方法另建PBS 组及10、25 μg rSjcystatin 治疗组,用于小鼠心功能、心脏黏连、心室结构重塑情况、心脏损伤、心脏炎性细胞浸润程度及血清中炎症因子水平的检测。
1. 5 小鼠存活率的计算 MI 术后28 d,统计小鼠存活数量,并按下式计算各组小鼠的存活率。
小鼠存活率(%)=每组小鼠存活只数/每组小鼠总数×100%
1. 6 小鼠心功能的检测 MI 术后 1、3、7、14、28 d,将 PBS 组及 10、25 μg rSjcystatin 治疗组小鼠经异氟烷麻醉,仰卧固定于超声台,调节超声探头角度置左心室,在M Mode 状态下从左室乳头肌水平二维左室短轴切面分别记录左室射血分数(left ventricular ejection fraction,LVEF)、左室短轴缩短率(left ventricular fractional shortening,LVFS)、左室舒张末期内径(left ventricular end diastolic diameter,LVID,d)及心率(heart rate,HR)。
1. 7 小鼠心脏黏连情况的检测 MI 术后28 d 心功能检测后,开胸,用注射器逆行插入主动脉将PBS 推注心脏血管,至心腔血液冲洗干净,再用中性福尔马林推注,结扎血管丛,取心脏,置中性福尔马林溶液,固定24 ~ 48 h,观察黏连情况,并按下式计算心脏前壁与胸壁的黏连率。
心脏黏连率(%)= 每组心脏黏连小鼠只数 / 每组小鼠只数 × 100%
1. 8 小鼠心室结构重塑情况的检测 采用Masson染色法。将1. 7 项摘取的小鼠(各组取5 只)心脏组织冠状切开,保留梗死部分,进行脱水、透明、浸蜡、包埋,切成厚度为 3 ~ 4 μm 的切片,60 ℃烤片,室温干燥。石蜡切片置65 ℃干燥箱干燥约50 min,采用Masson 三色染色液试剂盒进行脱蜡水化及Weigert 铁苏木素、丽春红品红、苯胺蓝染色,封片。应用Image Pro Plus 6. 0 软件测量各组小鼠MI 术后28 d 心脏梗死面积百分比及左心室游离壁厚度。
1. 9 小鼠心脏损伤情况的检测 采用HE 染色法。于 MI 术后 1、3、7 d,PBS 组及 10、25 μg rSjcystatin治疗组各取5 只小鼠,按1. 8 项方法制备心脏组织石蜡切片,采用HE 染色试剂盒进行苏木素、伊红染色后封片,置荧光倒置显微镜下拍照,观察心脏组织结构的变化及炎症细胞浸润的情况。
1. 10 小鼠心脏炎性细胞浸润程度的检测 采用免疫组化染色法。将1. 9 项制备的石蜡切片置65 ℃干燥箱干燥约30 min;常规脱蜡,PBS 洗涤2 次,EDTA抗原修复20 min;室温冷却,PBS 洗涤3 次;滴加内源性过氧化物酶阻断剂(PV-9001 兔二步法检测试剂盒自带),避光封闭 20 min;PBS 洗涤 3 次,加入兔抗 CD45 单克隆抗体(1 ∶200 稀释),于 4 ℃湿盒孵育过夜;室温放置30 min,PBS 洗涤3 次,加入二抗反应增强液,避光孵育30 min;PBS 洗涤3 次,加入羊抗兔IgG(PV-9001 兔二步法检测试剂盒自带),避光孵育 1 h;PBS 洗涤 3 次,DAB 显色,苏木素染色 35 s,三蒸水洗涤,滴加分化液,变浅蓝即刻放入PBS 中,脱水透明,封片。应用Image J 软件测量棕黄色炎性细胞颗粒的平均光密度值。
1. 11 小鼠血清中炎症因子水平的检测 采用ELISA法。于 MI 术后 7 d,PBS 组及 25 μg rSjcystatin 治疗组各取5 只小鼠,经眼球采血,分离血清,采用相应ELISA 试剂盒检测小鼠血清中 TNF-α、IL-6、IL-10、TGF-β1 的含量。
1. 12 统计学分析 应用GraphPad Prism 6. 01 统计软件进行统计学分析,所有数据均采用均值± 标准误(mean ± SEM)表示,两组间生存率的比较采用Log-rank(Mantel-Cox)检验,其他结果多组间差异的比较采用单因素方差分析(one-way ANOVA),两组间差异的比较采用t 检验,以P<0.05 为差异有统计学意义。
2 结 果
2.1 小鼠的存活率 MI 术后 28 d,Sham 组小鼠 8 只全部存活,PBS 组、10 及 25 μg rSjcystatin 治疗组分别死亡7、3 和2 只小鼠,存活率分别为72%、88%和92%。与 PBS 组比较,10 和 25 μg rSjcystatin 治疗组小鼠存活率均呈上升趋势,但差异均无统计学意义(t 分别为 2. 082 和 3. 149,P > 0. 05),见图 1。小鼠死亡主要发生在MI 术后7 d 内,其原因主要为左心室壁梗死变薄,在左室应力作用下破裂出血,导致胸腔积血。
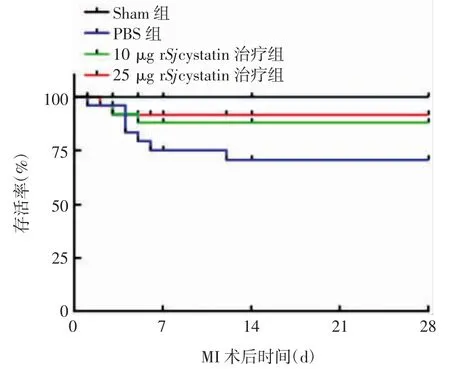
图1 MI 术后各组小鼠的存活率Fig. 1 Survival rates of mice in various groups after MI
2. 2 小鼠的心功能 MI 术后28 d,PBS 组超声图前后室壁活动范围小,尤其是前壁的运动,室腔明显变大;与 PBS 组比较,10 及 25 μg rSjcystatin 治疗组室壁的运动功能明显改善,且后者的左室前壁活动幅度明显大于前者,见图2。3 组小鼠术后各时间点的HR 总体维持在约430 次 / min,组间差异无统计学意义(t = 0. 104 ~ 3. 132,P > 0. 05)。MI 术后 28 d,25 μg rSjcystatin 治疗组的 LVFS 及 LVEF 显著高于PBS 组和 10 μg rSjcystatin 治疗组(t=2.809~4.212,P < 0. 05);10 和 25 μg rSjcystatin 治疗组的 LVID,d均显著低于 PBS 组(t 分别为 2.778 和 3.650,P<0.05),但两者间差异无统计学意义(t = 0.535,P﹥0. 05)。见图3。表明rSjcystatin 可有效改善MI 后心室壁运动及左心室血流动力学变化,利于心脏功能活动,25 μg 治疗剂量的效果优于 10 μg。

图2 MI 术后28 d 各组小鼠的心脏超声图Fig. 2 Echocardiography of hearts of mice in various groups 28 d after MI
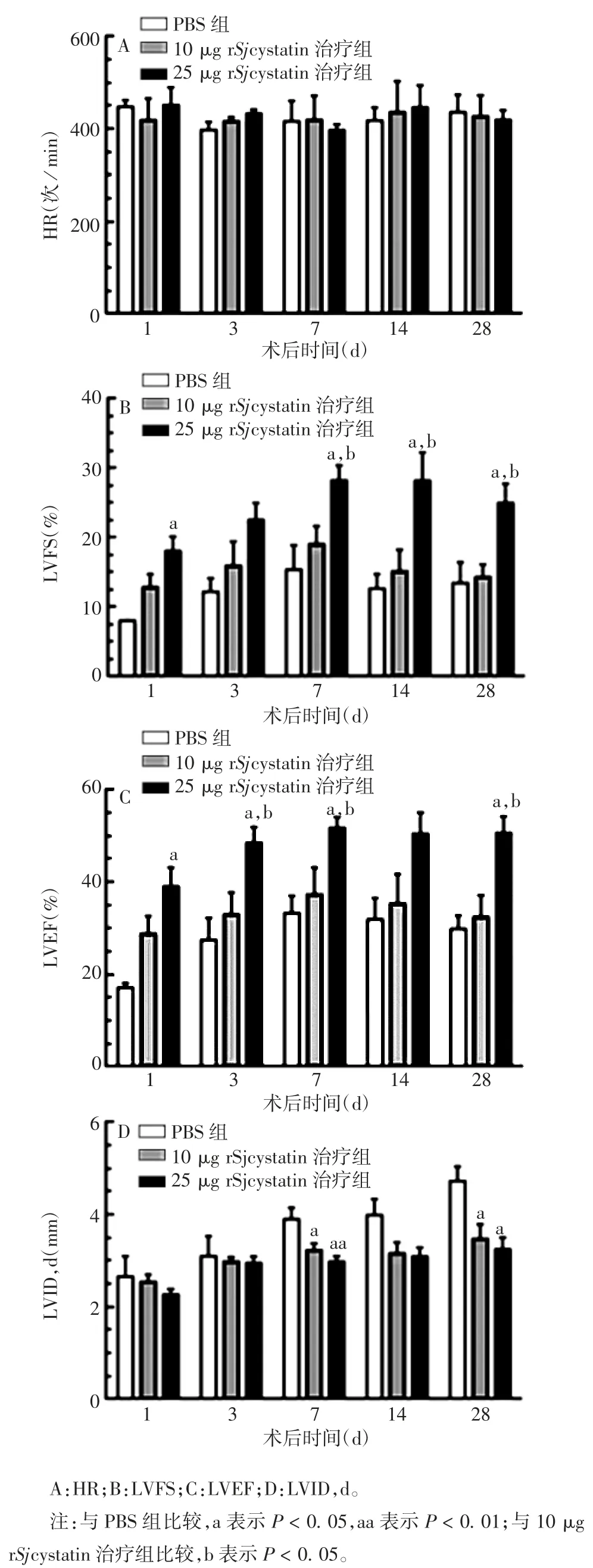
图3 各组小鼠的心功能情况Fig. 3 Cardiac function of mice in various groups
2. 3 小鼠的心脏黏连率 PBS组、10和25μgrSjcystatin治疗组小鼠的心脏黏连率分别为44. 44%(8 / 18)、40.91%(9 /22)和 17.39%(4 /23),表明 rSjcystatin 治疗可降低MI 后小鼠心脏的黏连率,25 μg 治疗剂量的效果优于10 μg。
2. 4 小鼠心室结构的重塑 两个剂量rSjcystatin治疗组蓝色胶原纤维区域明显少于PBS 组,见图4。PBS 组、10 和 25μg rSjcystatin 治疗组的左室梗死面积百分比分别为(21. 00 ± 2. 40)%、(15. 80 ± 1. 96)%和(10. 13 ± 0. 66)%,25 μg rSjcystatin 治疗组显著低于 PBS 组和 10 μg rSjcystatin 治疗组(t 分别为 3. 483和 2. 744,P 分别 < 0. 01 和 0. 05)。PBS 组、10 和25 μg rSjcystatin 治疗组的左室游离壁厚度分别为(109.6 ± 2.97)、(156.3 ± 7.28)和(200.1 ± 4.72)mm,与 PBS 组比较,10 和 25 μg rSjcystatin 治疗组明显升高(t 分别为 7. 087 和 15. 830,P < 0. 001),后者显著高于前者(t = 5. 055,P < 0. 001)。表明rSjcystatin 可显著改善MI 后小鼠心脏的纤维化程度、梗死范围与室壁厚度,25 μg 治疗剂量的效果优于 10 μg。

图4 各组小鼠心脏切片的Masson 染色图(标尺为:1 000 μm)Fig. 4 Masson staining of heart section of mice in various groups(bar = 1 000 μm)
2. 5 小鼠心脏损伤情况 MI 术后 1、3、7 d,与 PBS组比较,10 及 25 μg rSjcystatin 治疗组心肌组织损伤减轻、心肌纤维疏松断裂程度和蓝色炎性细胞的浸润减少,见图5。表明MI 术后7 d,rSjcystatin 腹腔治疗可适度减弱MI 后的心脏损伤。
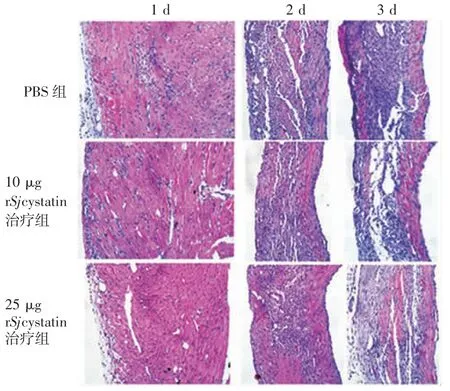
图5 各组小鼠心脏切片的HE 染色图(标尺为:200 μm)Fig. 5 HE staining of heart section of mice in various groups(bar = 200 μm)
2. 6 小鼠心脏炎性细胞浸润程度 MI 术后1、3 d,25 μg rSjcystatin 治疗组棕黄色炎性细胞颗粒平均光密度值明显低于 PBS 组(t 分别为 5.501 和 4.825,P<0. 05),10 μg 与 25 μg rSjcystatin 治疗组间差异无统计学意义(t 分别为 2.177 和 1.747,P<0.05);MI 术后 7d,25 μg rSjcystatin 治疗组显著低于 PBS 组和 10 μg rSjcystatin 治疗组(t 分别为 3.806 和 12.710,P 分别 <0. 05 和 < 0. 001),见图6 和图7。表明建模后7 d,rSjcystatin 腹腔治疗可适度减弱MI 后损伤部位的炎性细胞聚集浸润程度,防止炎症过度对心脏的损害,25 μg 治疗剂量的效果优于 10 μg。
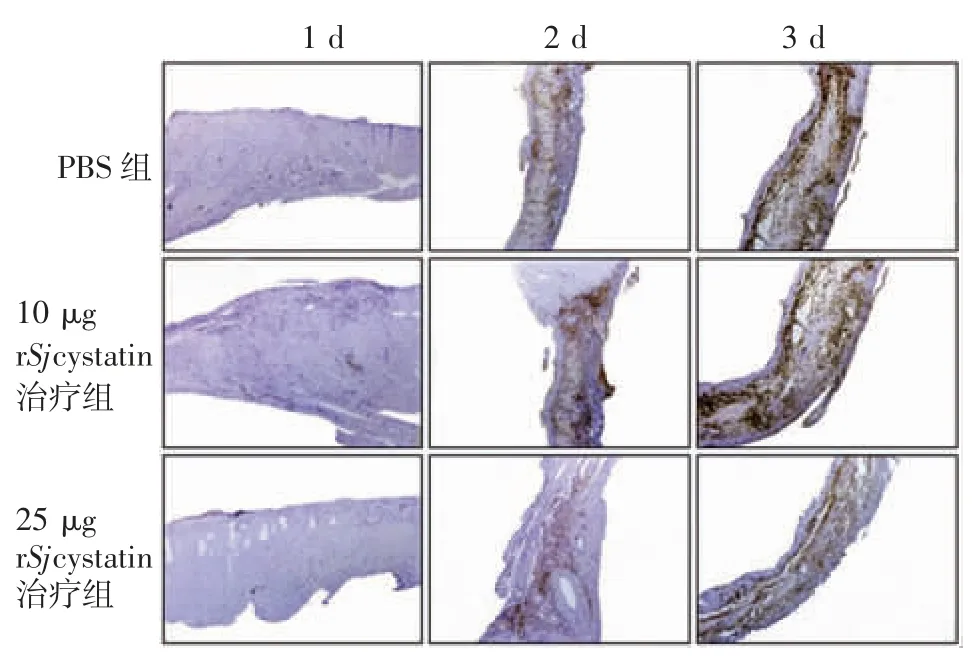
图6 各组小鼠心脏切片免疫组化染色图(标尺为:500 μm)Fig. 6 Immunohistochemical staining of heart sections of mice in various groups(bar = 500 μm)
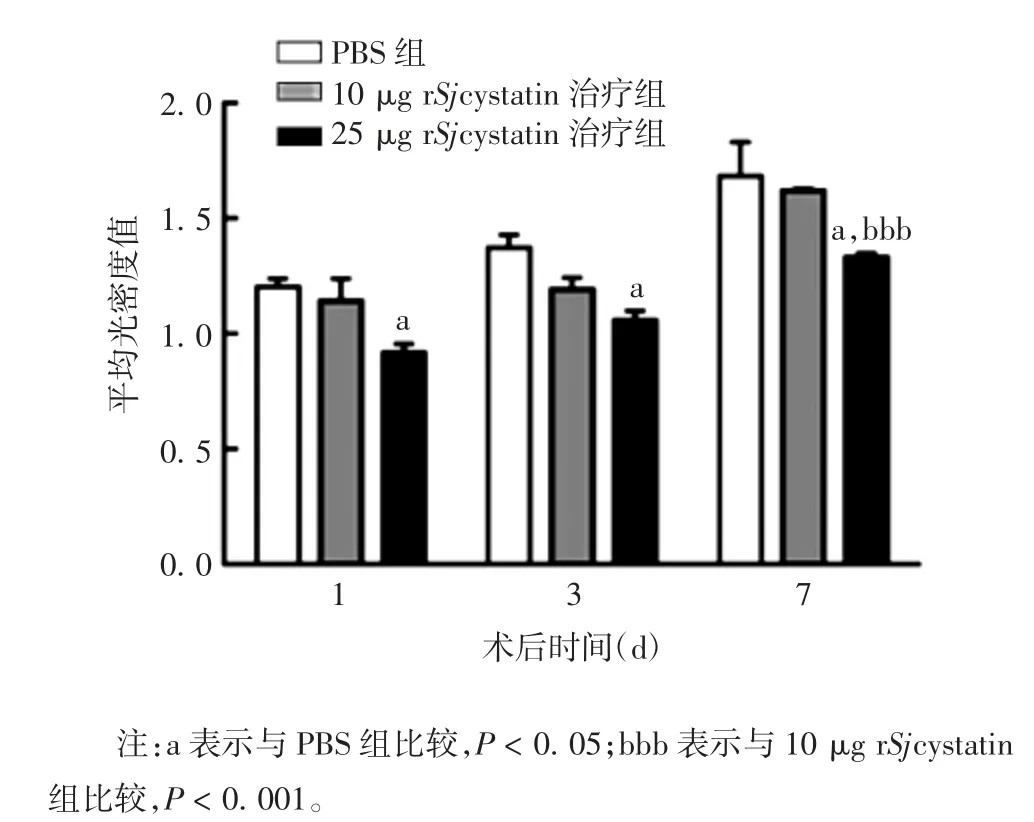
图7 各组小鼠心脏棕黄色阳性颗粒的平均光密度值Fig. 7 Mean optical density of brown yellow positive granules in heart of mice in various groups
2. 7 血清中炎症因子水平 MI 术后7 d,与PBS 组比较,25 μg rSjcystatin 治疗组小鼠血清 TNF-α 和IL-6 含量显著降低(t 分别为 2. 527 和 27. 460,P 分别为 < 0. 05 和 < 0. 01),TGF-β1 含量显著升高(t =9. 069,P < 0. 001),IL-10 含量呈升高趋势,但差异无统计学意义(t = 0. 556,P > 0. 05),见表 1。表明建模后7 d,25 μg rSjcystatin 可调控小鼠血清中的炎症因子水平,适度减少促炎因子分泌,且增加抗炎因子分泌,利于减轻MI 时炎症对组织的损伤,加强心肌修复。
表1 小鼠血清中炎症因子的表达水平(pg / mL,,n = 5)Tab.1 Expression levels of cytokines in sera of mice(pg /mL,,n = 5)

表1 小鼠血清中炎症因子的表达水平(pg / mL,,n = 5)Tab.1 Expression levels of cytokines in sera of mice(pg /mL,,n = 5)
注:与 PBS 组比较,a 表示 P<0.05,aa 表示 P<0.01,aaa 表示 P<0. 001。
组别 TNF-α IL-6 TGF-β1 IL-10 25 μg rSjcystatin 治疗组 26. 95 ± 3. 93a 2. 38 ± 0. 03aa 42 739 ± 1 705aaa 61. 41 ± 19. 35 PBS 组 47. 75 ± 0. 01 3. 91 ± 0. 05 24 133 ± 1 142 49. 58 ± 8. 86
3 讨 论
cystatin 是一类分布广泛的半胱氨酸内肽酶抑制剂,可保护细胞免受蛋白酶的降解,参与机体的免疫、感染及细胞凋亡等生理病理过程,cystatin 依据氨基酸序列被分为 Stefins、Cystatins 和 Kininogens 3 大家族[27]。通过基因工程技术可制备大量活性较好的蠕虫cystatin 蛋白,使用时剂量易控制,且安全性较好,无明显毒副作用[28-29]。cystatin 蛋白可通过上调抗炎细胞因子,下调促炎细胞因子,调节T 细胞反应及促进巨噬细胞的极化来调控机体的免疫反应,在结肠炎、脓毒症、关节炎和Ⅰ型糖尿病等炎症性疾病的治疗过程中疗效显著[23-24,30]。本研究结果表明,MI 模型小鼠经rSjcystatin 多次腹腔注射治疗后,可显著减轻心脏与胸壁的黏连程度,减少心肌损伤(P <0. 05),改善MI 小鼠的心功能,同时缓解MI 后的心肌重构(P<0.05),具有一定的心肌保护效应,25 μg rSjcystatin 的治疗及保护效果优于10 μg。
rSjcystatin 可通过影响组织炎性细胞的水平来发挥其抗炎作用[31]。研究表明,rSjcystatin 可减少脓毒症小鼠的单核细胞活化[23];丝虫来源的cystatin治疗哮喘后可显著减少炎症细胞,尤其是嗜酸性粒细胞向肺组织的募集,从而减轻局部组织损伤[20];华支睾吸虫和马来丝虫的cystatin 能够使结肠炎小鼠的炎症明显减轻,其机制与激活肠道内M2 型巨噬细胞,参与组织修复有关[32]。已知CD45 分子在白细胞上均有表达,是反映炎性细胞浸润情况的重要标记物,因此本实验用其反映炎性细胞浸润情况。本研究结果显示,rSjcystatin 治疗MI 小鼠后,可在一定程度上减轻MI 局部炎症细胞的浸润,尤其是炎症早期的中性粒细胞浸润,降低炎症活性物质释放所产生的级联反应,从而防止缺血心肌的慢性病理损害,可在一定程度上延缓心室壁变薄的进程,对心衰的发生有一定延缓作用。cystatin 的抗炎作用可通过影响血清炎症因子水平实现[33-35]。有研究发现,用rSjcystatin 治疗小鼠结肠炎,可促炎细胞因子TNF-α 及IL-6 明显下调(P < 0. 05),抗炎细胞因子 IL-10 及TGF-β 呈上调的趋势[25]。另外,rSjcystatin 能通过增加调节性T 细胞的数量,抑制IFNγ 的分泌,同时增加 IL-10、TGF-β 的表达,改善Ⅰ型糖尿病的预后[22]。还有学者证实,rSjcystatin 对类风湿关节炎的缓解作用与 IL-4、IL-10 升高及 IFNγ、IL-6、IL-17、TNF-α 等促炎因子的显著降低均密切相关[24]。本研究结果提示,25 μg rSjcystatin 治疗 MI 可明显下调促炎因子TNF-α 和 IL-6(P<0.05),明显上调抗炎因子 TGF-β1(P < 0. 001),可上调IL-10 水平,但差异无统计学意义(P > 0. 05),从而减轻心脏过度的炎症损害,为后期的修复组织奠定了环境基础。
本实验结果表明,经rSjcystatin 治疗小鼠MI 后,可适度减弱炎细胞浸润、降低促炎因子TNF-α 和IL-6的分泌、增加抗炎因子IL-10 和TGF-β1 的分泌,从而抑制MI 后的炎症反应,在一定程度上延缓小鼠MI 后心肌结构及功能重构的发生,具有一定的心肌保护作用,本实验为rSjcystatin 应用于临床治疗提供了实验依据。

