氧气控制释放型生物材料研究进展
刘群峰
(佛山职业技术学院,广东 佛山528137)
目前,由于面临人口老龄化及器官受损和衰竭的问题越来越多,组织工程为人工器官提供了新思路,尽管其在组织工程领域中取得了显著进展,但仍存在诸多挑战,如移植的组织工程结构在形成血管化之前,难以获得充分的氧气和营养以满足移植组织中细胞的需求,这使得组织工程支架中尤其是深处的细胞通常处于缺氧条件中[1].而细胞对缺氧环境非常敏感,氧缺失最终会导致细胞死亡和组织坏死,这限制了组织工程化产品的实际应用[2].为了防止植入的组织缺氧损伤,有必要为其提供足够的氧气供应.
研究表明[3],利用释氧材料将氧输送到植入的组织中以避免缺氧,是最为有效的方式之一.通常氧气可以通过直接供应的方式或通过载体材料进行输送,不含有载体材料的气态氧就可以作为治疗疾病的一种方式而得到应用,如医学上采用高压气态氧治疗多种疾病[4-5],但是这种氧气方法难以实现对体内植入组织持续可控的氧气支持.供氧一个重要的要求是避免氧气的突然释放,大量氧气突释会对细胞产生毒性[6],因而提供最佳和持续的氧气释放是氧气输送系统的关键要素.
释氧材料即是通过载体材料负载氧源化合物而实现氧气控释的体系.近年来,出现了较多的关于控制氧气释放材料的研究,其已发展成为一类重要的新型生物材料.释氧材料在生物医学领域发挥越来越多的作用,除了用于组织工程结构中提供氧气支持外,还可以用于心血管相关疾病、伤口愈合、细胞移植、器官保护、肿瘤治疗等[7].对释氧材料的最新进展进行了总结,系统讨论其制造方法、材料传递氧气的方式、释氧性能及其在生物医学方面的应用,还指出了释氧材料研究存在的问题与挑战,并对今后相关研究的发展进行了展望.
1 产氧型生物材料
1.1 载体材料和氧源物质
释氧材料通常由载体材料和氧源化合物两部分组成,其要适合生物医学应用及满足一些严格的要求,如良好的生物安全性、可控释放性和易制造加工性等.一般选择具有良好生物相容性和可降解性的聚合物作为载体材料,如聚(乳酸-羟基乙酸共聚物)(PLGA)[8]、聚己内 酯(PCL)[9]、聚 乳酸[10]、聚乙 烯醇[9]、明胶甲基丙烯酰基(GelMA)[11]、壳聚糖[12]等.当氧源物质被封装时,载体聚合物在水环境中发生降解,氧源物质发生分解导致氧气的产生.由于陶瓷等无机材料的生物降解性较低,一般较少用作为释氧载体.
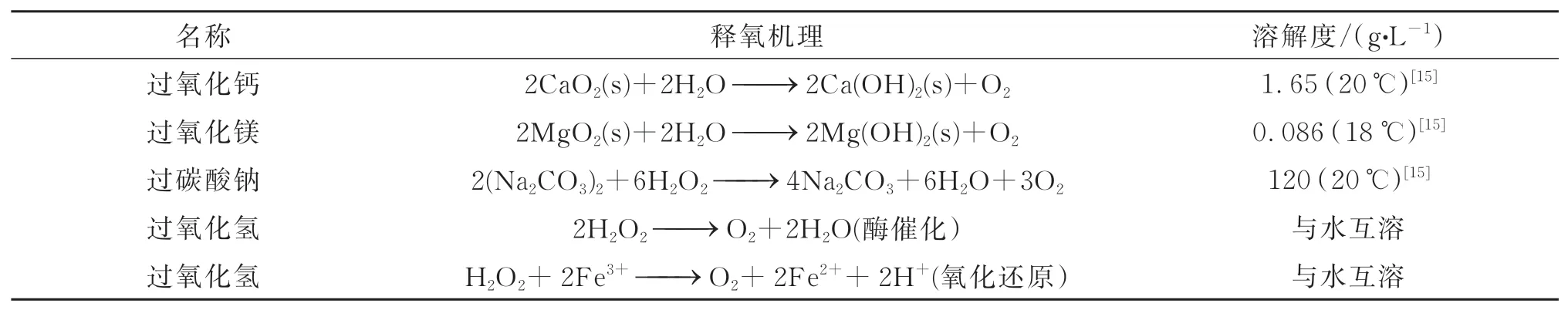
表1 基于过氧化物的氧源物质及其释氧机理Table 1 Peroxide-based oxygen source material and its oxygen release mechanism
由表1可知,利用过氧化物释氧涉及到中间产物过氧化氢(H2O2)和一些副产物(如Ca(OH)2)等.过氧化氢不仅产生氧气,还产生羟基自由基,这会导致细胞损伤.因此,研究人员采用过氧化物与过氧化氢酶结合,以提高释氧系统的安全性.过氧化氢酶是一种存在于哺乳动物血液和肝脏中的酶,可以高效地将过氧化氢分解为氧气和水.在释放氧气体系中使用过氧化氢酶等酶催化剂,有助于帮助过氧化氢安全转化为氧气[16].
1.2 产氧型释氧材料
产氧型释氧材料主要通过化学反应等方式产生氧气,其主要特点是具有内源性释氧的特征,不需要外来氧气和能源驱动,释氧可以持续较长时间.其不足之处是过氧化物不易形成均一相,遇水就反应,包埋难度较大,反应时会产生羟基自由基等副产物.产氧材料体系需要解决的主要问题,如何设计和选择合适的载体材料和制备方法,确保氧气持续生成和可控释放,同时避免氧气爆释和副产物带来的毒性.氧气控制释放时间是选择载体材料和制备方法最重要的标准之一,理想的释氧材料的氧气控制释放时间应不低于10天,这个时间对应移植体中血管形成时间(1~2周)[17],较长的释氧时间有利于新血管形成之前的细胞供氧.针对这些问题,已开发了不同的制造技术(或制备方法)来制备产氧材料,包括溶剂铸造、冻冻干燥、电纺丝或喷涂、乳液和水凝胶包裹等方法,采用这些技术将载体材料制备成微球、凝胶、膜层、支架等,实现对氧源化合物的封装,通过调控释氧材料的微观结构如孔结构、比表面积等,可有效地控制释氧过程.下面讨论采用各种制备方法来制造产氧材料的体系.
1.2.1 水凝胶包裹法
水凝胶是一类新型生物材料,其中含水量可高达90%以上,具有良好的生物相容性.水凝胶固化成型方法较多,如自由基聚合交联、光固化、物理交联等.在成型过程中,可以将氧源分子或化合物封装在固化的凝胶中.水凝胶隔离了氧气源、反应副产物等,避免了这些物质与人体组织直接接触,降低了对细胞产生的毒性,有效地提高了释氧体系的安全性.为了避免固化成型过程中单体、引发剂和交联剂等小分子物质的引入,水凝胶包裹法通常采用光固化的方法.例如,GelMA是一种典型性的光固化材料,在紫外光照下可以迅速形成凝胶,适用于释氧材料的快速成型.Alemda等人[18]报道了一种负载CPO的GelMA释氧光交联水凝胶,CPO在水凝胶中均匀分布,在含氧量为1%的低氧环境下释氧时间可长达5天,制备过程见图1.Sujin Parkde等人[19]报道了一种含氧化钙的硫代明胶氧化交联反应原位形成的水凝胶,这种水凝胶能迅速产生高氧水平的分子氧,并在体内维持高氧水平长达4天.
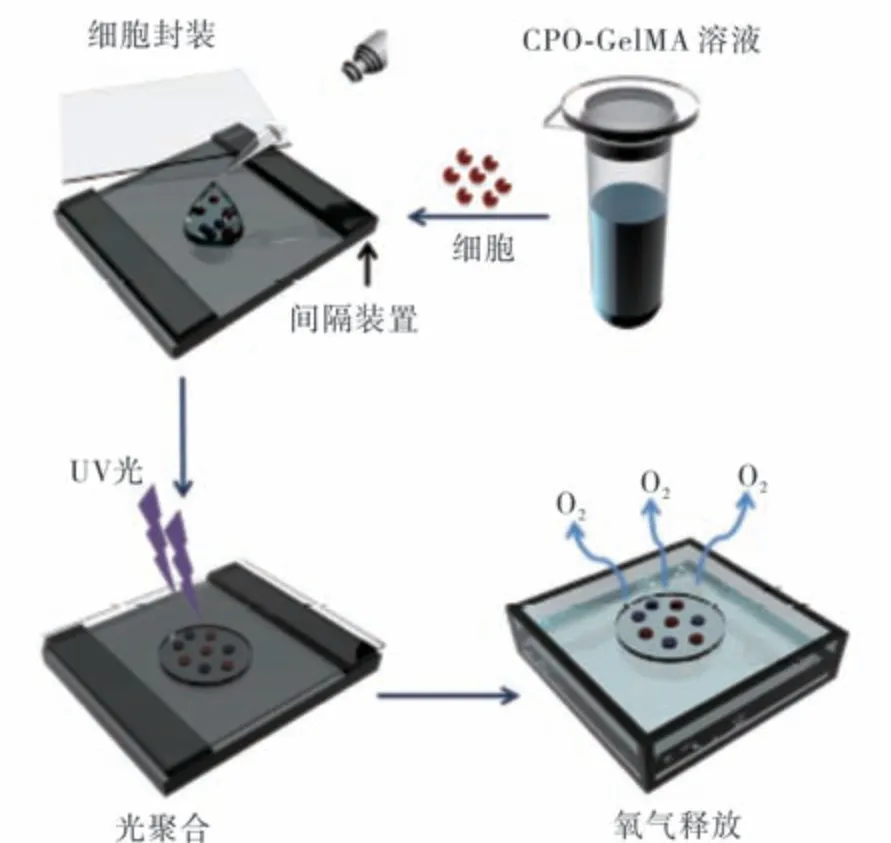
图1 负载CPO和细胞的GelMA水凝胶制备过程示意图Fig.1 Schematic diagram of the preparation process for the GelMA hydrogel loaded with CPOs and cells
水凝胶中包裹的CPO氧气释放时间,取决于CPO的浓度和水凝胶基材的性能.由于水凝胶是一种高含水的材料,包裹的过氧化物容易发生水解而造成氧气的释放速率快于疏水载体材料,这是一个限制因素.为了提高水凝胶包裹法的释放时间,研究人员采用疏水性材料封装氧源后再将其与水凝胶 结 合.Jianjun Guan等 人[20]采 用PLGA包 裹PVP-H2O2复合物形成的过氧化氢缓释微球,采用缓释微球、过氧化氢酶和以N-异丙基烯酰胺共聚物构筑了可注射水凝胶体系,H2O2释放后被过氧化氢酶催化分解产生氧气,该释氧系统能够持续释放氧气达2周.
水凝胶包裹法适用于酶催化体系,酶催化反应体系是较为安全的释氧方式,但氧气释放量和释放持续时间不如固体过氧化物体系,且酶催化体系的储存稳定性有限,采用水凝胶包裹法可以提高酶的稳定性.刘群峰等人[21]通过水凝胶负载过氧化氢酶,催化过氧化氢释放出氧气,氧气的时间可达8 h以上.Kang等人[22]通过CPO产生的钙离子与海藻酸钠相互作用而制造释氧水凝胶,该体系使用过氧化氢酶作为催化剂,释氧时间达48 h.一些新的生化作用释氧体系被开发出来,胡一桥等人[23]设计了一种微藻凝胶贴片,可以直接覆盖伤口并将溶解的氧气输送到伤口床中.贴片以亲水性聚四氟乙烯膜用作内衬,贴片中填充了直径为1 mm的含有活微藻的水凝胶珠,吸收预先添加的碳酸盐,通过呼吸和光合作用产生溶解氧气,这种溶解氧是气态氧渗透皮肤效率的100倍以上.
1.2.2 溶剂浇注法
溶剂浇注法是一种简单有效的薄膜制作方法,将含有聚合物悬浮液的氧源粒子沉积在基底上,然后进行溶剂蒸发,从而形成释氧薄膜.它采用的是有机溶剂,在材料的加工过程中不会导致过氧化物水解而提前释放氧气.溶剂浇注法通常采用生物相容性好的疏水性聚合物封装氧源,以提高释氧时间,借助疏水聚合物的疏水性可以避免无机过氧化物与细胞直接接触.这些薄膜被证明可以有效延长氧气的释放,但由于聚合物薄膜的厚度有限,负载氧源物质的量有限,释氧薄膜难以提供更为长效的氧气释放.溶剂浇注法中溶解蒸发的过程需要时间,颗粒容易在膜的底部沉淀,因此固体过氧化物颗粒在载体膜的物质中难以均匀分布.Harrison等人[24]以二氯甲烷中为溶剂,采用溶剂浇注法将SPO封装在PLGA聚合物中,该膜释氧时间为70 h.为了提高溶剂浇注法制备的薄膜释氧时间,需要与其他制备方法结合,Lv等人[25]采用溶剂浇注法开发了由丝/角蛋白/(质量比60∶40)制成的薄膜支架,该结构中CPO被封装在明胶中形成核壳结构,其氧气的释放周期长达2周.
往年过年回家去看他,姥爷总会想方设法给我做一些好吃的,打小他就对我疼爱有加,加之后来母亲去世,他的舐犊之情便愈加深沉。
1.2.3 乳液溶剂蒸发法
乳液溶剂挥发法是先将聚合物载体基质用有机溶剂溶解,然后与氧源化合物和表面活性剂混合而形成分散体系或溶液,再将分散体系或溶液在水相中乳化形成小液滴,在溶剂蒸发后去除表面活性剂,最终获得释氧颗粒.乳液溶剂蒸发法制备的微粒大小和形态受到表面活性剂类型、溶剂类型及溶剂蒸发速率等多种参数影响.Ng等人[26]采用双乳液溶剂蒸发法将过氧化氢封装在PLGA微颗粒中(粒径25~250 μm),冷冻干燥除去溶剂获得释氧微球,其释氧时间仅为5 h,该体系释氧时间较短与水包油体系、多孔结构、氧源易分解等因素有关.设计致密的微球结构可以延长释氧时间.Mallepally等人[27]通过乳液蒸发法将过氧化氢封装在聚甲基丙烯酸甲酯中,形成的微胶囊(粒径5~30 μm)释氧时间达到24 h.在水包油系统中,过氧化物可与水接触,导致氧源物质的水解,为了避免这种结果,可使用油包油乳液体系.Steg等人[28]采用油包油乳液法制备由聚(碳酸三乙烯)基体和难分解氧源CPO组成的复合微粒,获得的微粒(粒径约为200 μm)产氧时间长达20天.
1.2.4 电仿和电喷法
电纺和电喷法是基于将电场应用于溶液液滴的原理,溶液液滴由喷射器喷射出来而形成球体或亚微米纤维,该方法已被用于开发各种载药微纳米材料[29].在电纺/电喷过程中,固体过氧化物往往先制备成纳米微球形式,确保其顺利通过注射器并避免在喷嘴上的沉积.电纺的一个特点是制备的纳米纤维具有微观纳米和多孔结构,这种释氧材料具有大的比表面积和高的孔隙率,能加速氧气释放.T.Abudula等人[30]设计了以聚癸二酸甘油酯和聚己内酯为基质的电纺丝复合支架,通过进行球磨将大量的CPO纳米颗粒嵌入纳米纤维复合支架中,其可持续释氧1周.
电喷技术主要用于制备释氧微球,微球表面形貌对释氧行为有极大影响,其制备过程示意图如图2所示[31].A.I.Morais等人[32]通过电喷法制备了由PCL,Pluronic F-127和CPO组成的表面多孔微粒,释放氧气达1周.S.Khorshidi等人[33]采用水解-沉淀法合成了CPO纳米粒子,然后通过电喷法将其负载到聚丙交酯-共乙交酯(PLGA)基体中,形成平均直径为5.3 μm的圆盘状PLGA/CaO2颗粒,其表面结构较为致密,释氧时间可达14天.
图2 采用电喷法制备PLGA包裹PVP-H2O2释氧微球过程示意图Fig.2 Schematic diagram of PLGA coated PVPH2O2 oxygen-releasing microspheres prepared by electrospray method
1.2.5 冷冻干燥法法
冷冻干燥法一般过程:将氧源物质与载体材料溶液一起均匀分散,将得到的溶液或分散体系浇铸到模具中,通过冷冻干燥脱除水分和溶剂后获得释氧支架.冷冻干燥法具有诸多优势,其可用于制造具有均匀分布的固体过氧化物颗粒的多孔支架,低温下冷水不会造成过氧化物的分解,干燥后无水分和溶剂有利释氧材料的储存.P.A.Shiekh等人[34]采用低温冷冻干燥法开发了释氧聚氨酯支架(PUAO),通过将PUAO溶解在二甲基亚砜(DMSO)中,将筛选的CPO粒子均匀分布其中,灌注在玻璃器皿中冷冻,然后在冰冻的水/乙醇中解冻除DMSO,冷水洗涤冻干储存,PUAO-CPO支架可持续释氧达10天,其制备过程如图3所示.

图3 冷冻干燥法制备PUAO-CPO冷冻凝胶释氧支架的过程示意图Fig.3 Schematic diagram of the process of preparing of oxygen-releasing PUAO-CPO cryogel scaffolds by freeze-drying method
2 携氧型释氧材料
携氧型生物材料本身不产生氧气,携氧型生物材料有较强的氧气吸附和携带能力.氧气在水溶液中饱和溶解度极小,通过携氧材料可以实现水体中氧气的超饱和状态.血液中的红细胞及在医学上使用的人造血液都属于携氧材料[35].与产氧材料不同,携氧材料主要依靠物理作用与氧气结合.携氧型的氧气释放量和释放持续时间均低于产氧型,产氧材料能提供长达数周的氧气供应[36],而携氧材料通常只能够提供数十分钟到数天的氧气.携氧材料具有产氧材料不具备的优势:携氧材料释放的氧是溶解状态的液态氧,液态氧比气态氧具有更强的扩散穿透能力[37];携氧材料的微观结构为均相,故氧气释放更为均匀,而产氧材料含有固体过氧化物,其微观结构不均匀;携氧材料与产氧材料相比,其更适用于注射增氧的应用场景.有效增溶是携氧材料开发的关键,下面主要讨论全氟化碳、血红蛋白类物质、微纳气泡等主要氧气增溶体系.
2.1 血红蛋白类携氧材料
血红蛋白类携氧材料主要采用血红蛋白(Hb)或肌红蛋白来可逆地结合氧,Hb是一种天然氧载体,具有较强的氧气结合能力,其氧结合能力为1.34 mL/g,它由四个亚基(两个α和两个β)组成,每个亚基包含一个血红素群,血红素基团内部含有铁原子,血铁基团负责氧结合.Hb需要进行化学修饰或者与其他物质结合,以避免其在体内使用过程中的损失,并且减少其免疫毒性[38].虽然血红蛋白类材料在人工血液方面取得了初步的成功[35],但还存在免疫副作用及持续时间短等问题.为了提高Hb和肌红蛋白的释氧性能,通常将其封装在生物相容性聚合物载体中,以增强其稳定性和持续释氧性能.A.Paciello等人[39]将人血红蛋白偶联到明胶微球表面制备明胶血红蛋白释氧体系,该体系维持有氧状态可达24 h且可循环吸附氧和释氧.为了达到与血液相似的载氧能力,载体内的Hb的负载量也是一个重要的参数,Liu等人[40]使用电喷法制备由纯Hb组成的纳米颗粒(Hb-NPs),将Hb-NPs用聚(多巴胺)包裹提高其稳定性,进一步用聚乙二醇修饰多巴胺壳体,减少蛋白质在Hb-NPs表面的吸附,这种方法有效提高了Hb负载量和Hb-NPs的稳定性.
2.2 全氟化碳(PFC)
全氟化碳(PFC)能大幅提升氧气的溶解度,且化学性质十分稳定,具有良好的携氧能力,比其他氧气输送材料更具临床应用潜力,PFC在医学上已成功应用于人造血液[41].全氟化碳具有疏水疏油性,在使用时须先进行乳化或悬浮分散处理.M.H.Gold等人[42]介绍了一种由全氟萘烷PFC乳液,这种制剂的溶氧量比水高7倍,这类乳剂用于短期使用,每天使用2~4次,可降低皮肤再生手术后的并发症的发生率.S.Wang等人[43]采用人血清白蛋白乳化全氟-15-冠-5-醚,用超声波均质器制备出载氧纳米PFC,纳米PFC中氧浓度可达1.50 mg/mL,释氧在40 min内保持稳定.G.Jalani等人[44]设计了一种全氟萘烷和石墨烯氧化物(GO)相结合的新型PFC氧气输送系统,石墨烯氧化物兼具乳化剂和稳定剂,PFC@GO乳液释氧时间不超过90 min.由于PFC携氧材料释氧时间较短,要延长氧气释放时间,需要对PFC乳剂进一步改进,如采用多重载体进行负载.M.Prato等人[45]开发了以2H,3H十氟戊烷为核、葡聚糖为壳的PFC纳米液滴,将其与羟乙基纤维素混合形成凝胶,其释氧能力达6 h.Khattak等人[46]将乳化的PFC再封装于海藻酸盐水凝胶中,其释氧持续时间超过7天.
2.3 微/纳米气泡
微/纳米气泡(MNBs)是由壳和核心组成的球形囊泡,已在医学领域作为超声造影剂使用[47],L.R.Sayadi等人[48]按微型气泡的大小归类,其中微泡的直径为100~1 μm,纳米泡的直径小于1 μm.由于微/纳米气泡的内部压力远高于外部环境,MNBs能促进氧气等在液体中的溶解性,产生氧的过饱和流体,这提供了一种新的氧气输送模式[48].微/纳米气泡主要通过使用超声波、机械搅拌、微流控装置或均质器等,将氧气封装于表面活性剂中的制备方式[50].Matsuki等人[51]将生理盐水、糊精、白蛋白和脂质形成溶液,溶液通过微/纳米气泡曝气器(氧气为1.5 L/min)循环15 min,再将其暴露于超声波中,最终得到含MNBs的无色透明液体,该液体适用于以静脉输液的方式供氧1 h.MNBs携氧材料存在释放氧的时间较短,以及壳材料的生物相容性、微泡稳定性等问题有待解决.为了提高MNBs的稳定性,Yifeng Peng等 人[52]将 改 性 的 糊 精 溶 解 于DMSO/H2O混合物中而生成胶束溶液,该胶束溶液在空气中均质,可产生瞬间稳定的泡沫,在泡沫中加入过量的水作为非溶剂,通过界面纳米沉淀制造了一种稳定的氧气微泡载体,但其供氧时间只维持1 h.I.Moen等人[53]制备了一种溶解氧含量高的凝胶释氧敷料,首先反渗透水和氧进入氧合装置的混合室中,再通过含有文氏管(一种喷射管)的管道系统,制备出100 mg/L含氧水,含氧水与Poloxamer407形成原位凝胶,这种凝胶能保持含氧浓度在22 mg/L以上,其供氧时间30 h.图4所示为微/纳米气泡的制备过程[54],其原理是通过剪切形成氧气微泡,其迅速被脂质体包裹,从而形成核壳结构.

图4 制备脂质体包裹的氧气微泡的过程示意图Fig.4 Schematic diagram of the preparation of liposomeencapsulated oxygen microbubbles
3 释氧材料的应用
释氧材料在生物医学上应用越来越广泛,表2列出了释氧材料的一些典型应用.下面主要讨论释氧材料的治疗慢性伤口、用于组织工程供氧及肿瘤治疗三个重要的应用场景.

表2 部分释氧生物材料的性能及其应用Table 2 Properties and applications of some oxygen-releasing biomaterials
3.1 慢性创面治疗
局部氧疗是一种针对慢性难愈合创面的有效治疗方式,局部氧疗能够向患者伤口组织部位持续提供氧气,在伤口周围形成高浓度氧气氛围,提高创伤缺氧组织的局部氧分压,促进创面组织修复和创伤愈合[61].由于皮肤的屏障作用,通常情况下气态氧只能扩散到伤口表面,能够通过皮肤和伤口渗出液进入到人体的含量微乎其微,对伤口治愈的促进作用并不明显.局部氧疗要想取得较好的疗效,需要向伤口持续的释放纯氧或者高浓度氧,能在创面形成一定的高氧气分压,氧气才能有效突破皮肤的屏障.因而释氧材料的供氧方式对局部氧疗的疗效有重要影响.目前局部氧疗材料已有获得FDA批准的产品,Granulox是一种FDA批准上市的用于治疗慢性伤口的血红蛋白冷冻干燥颗粒喷剂,其能确保连续氧气补充长达72 h,临床证据表明Granulox能有效加速糖尿病足等慢性伤口的愈合[62].Oxyzyme是一种利用葡萄糖、葡糖氧化酶及过氧化氢酶催化反应释氧的水凝胶片敷料,Oxyzyme敷料已进入用于治疗慢性创面的临床研究[63].CPO是研究最多的氧源,基于CPO制备的局部氧疗材料具有较长的释氧持续时间,Chandra等人设计了一种原位释放氧气的皮肤贴片,贴片由四层结构组成,包括凝胶层、封装了CPO的PCL层、硅胶层和聚氯乙烯膜层,释放时间超过48 h,这种敷料可用于治疗急性和慢性伤口[64].但现阶段以固体过氧化物为氧源的局部氧疗产品尚未有临床应用,该类研究目前还处于动物研究阶段.
3.2 组织工程供氧
科学和技术的最新进展使组织工程成为可能,与组织移植相关的关键问题之一是充足的氧气供应,充足的氧可以增加细胞外基质的合成、血管生成、细胞分化、增殖和迁移,而缺氧可导致细胞凋亡、组织坏死、延迟愈合和细菌感染.释氧生物材料的一个重要的应用就是植入的组织工程结构提供氧气,避免植入后细胞在新血管形成之前因缺氧而死亡,导致组织植入失败.因为血管形成需要一定的时间,故用于组织工程的释氧材料要求长效释氧,释放周期一般要求不低于10天.释氧材料已用于支持各种组织工程构造,包括骨骼、肌肉等.释氧材料可用于缺氧的大型骨组织植入物,提高骨细胞生存和骨组织血管化能力.Touri等人[65]打印出60%的HA和40%的β-TCP组成的双相磷酸钙多孔支架,然后将包裹3%的CPO的PCL微胶囊涂覆到该支架上,氧气释放时间可达10天,通过家兔节段性桡骨缺损模型进行评价,使用该释氧支架术后6个月后,促骨再生得到显著改善,并且有效促新骨形成.Laurencin等 人[66]采 用 乳 液 溶 剂 蒸 发 法 制 备 了PLGA/CPO微球,并将微球烧结成三维多孔支架,通过小鼠临界尺寸颅骨缺损模型评估其在促血管化骨再生方面的能力,8周后宿主细胞更多地迁移到基质内部,供体细胞的存活率和持久性更高,释氧支架的协同作用使得血管化骨再生能力增强.
组织工程是改善泌尿外科重建的一种很有前途的策略,Lv等人[25]开发了一种基于丝纤维蛋白/角蛋白/明胶/CPO的释氧膜,该膜释氧时间可持续两周,使用尿道缺陷动物模型来验证氧生成支架修复尿路功能,与不含CPO膜相比,含CPO膜显著改善了兔平滑肌细胞的生长和活力,CPO膜促进了动物上皮细胞层和肌肉束的形成.
3.3 肿瘤缺氧治疗
固体恶性肿瘤通常会改变它们的微环境导致缺氧,进而促进肿瘤的恶性生长.由于肿瘤细胞的快速生长消耗了大量的氧气,导致细胞微缺环境氧.缺氧细胞比正常细胞对放疗和化疗更具耐受性,这会触发缺氧驱动的免疫抑制,使肿瘤细胞的耐药性提高,从而降低了化疗药物的有效性[67].因此,可通过氧量的控制来提高肿瘤治疗的有效性.在目前的癌症治疗策略中,光动力治疗(PDT)是一种新的非侵入式治疗方法,当氧分压低于40 mmHg时,PDT效率会显著降低,但大多数肿瘤中氧分压通常低 于15 mmHg[68],通 过 释 氧 体 系 可 以提高PDT的疗效.Hu等人[69]合成了与二氢卟酚(一种光敏剂)共轭的透明质酸(HA),通过自组装的方法将全氟己烷(PFH)包裹于HA内,开发了一种靶向肿瘤、氧化还原激活和氧自供给的诊疗纳米颗粒(PFH@HA),PFH@HA纳米颗粒在肿瘤中靶向积累,通过氧化还原反应激发光活性,PFH@HSC能通过血液循环过程在肺内实现氧负载,并在肿瘤内缓慢释放氧气并使之扩散至整个肿瘤,可以显著缓解肿瘤乏氧,从而提高PDT疗效.将PFH@HA静脉注射入小鼠肿瘤模型体内,肿瘤体积从给药前的104 mm3显著降低到试验期结束时(14天)的62 mm3.
4 结语
近几年来,对释氧生物材料的研究热度显著增加,许多释氧材料被开发出来,释氧材料在生物医学领域的应用范围越来越广泛.释氧生物材料开发的关键是安全、持续、稳定的释氧,其研究重点应从新材料的开发到提高其安全性、提高其控制和实现其可用性.但大部分材料都对氧的控制释放性能不佳,前期存在爆释现象,后期氧气并随着时间的推移而减少.采用疏水性材料(PCL或PLGA)封装氧源,可以有效延长氧释放的持续时间,但真正氧浓度可控且稳定释氧在很大程度上仍然无法实现.此外,释氧体系的安全性仍可显著提高,这对临床使用至关重要.用抗氧化剂(抗坏血酸)、酶(过氧化氢酶)或活性氧(ROS)清除材料(二氧化锰[70])等,有望大幅降低过氧化氢产生的羟基自由基带来的细胞毒性.
当前,释氧生物材料已进入应用阶段,从发展趋势来看其未来的研究方向:发展结构简单、安全性高及稳定性高的释氧材料体系,该体系包括氧源物质、释氧载体和释放控制方法等;进一步开发更多体内评价模型,以帮助更好地理解氧治疗系统;需要进一步开展更多临床研究,验证真正适合临床医学应用的释氧体系.

