巨细胞病毒血症对慢性肾脏病继发耶氏肺孢子菌肺炎预后的影响
李 喆 王 杨 罗 松 许书添 周玉超 袁冬梅 李世军
随着各类免疫抑制剂在慢性肾脏病(CKD)治疗领域的广泛应用,CKD患者总体预后逐步改善,但继发免疫缺陷导致的各类感染亦有增加[1]。巨细胞病毒(CMV)和耶氏肺孢子菌(PJ)是免疫缺陷患者最常见的两种机会性感染病原体。长期应用免疫抑制剂和持续低淋巴细胞血症都是CMV再激活和PJ感染的高危因素[2]。目前对PJ和CMV双重感染的研究主要关注于人免疫缺陷病毒(HIV)感染[3]、恶性肿瘤[4]、干细胞或器官移植人群[5],在CKD患者中仅见少量个案报道[6]。对CMV感染是否影响耶氏肺孢子菌肺炎(PJP)患者的临床表现和预后,是否需要抗病毒治疗,目前尚未达成共识。本研究回顾性分析CKD合并PJP患者,使用外周血宏基因组二代测序技术(mNGS),分析CMV血症是否影响患者预后,以期为CKD合并PJP伴CMV血症患者的诊断、治疗和判断预后提供参考。
对象和方法
研究对象在国家肾脏疾病临床医学研究中心重症监护病房(ICU)电子病历系统中,通过国际疾病分类ICD-10诊断编码检索出2018年10月至2021年1月诊断的CKD合并PJP患者。所有患者均符合改善全球肾脏疾病预后组织(KDIGO)-CKD诊断标准。PJP临床诊断标准:(1)感染起病时主诉发热、咳嗽、咳痰、胸闷等症状;(2)高分辨率CT呈双肺弥漫性间质改变;(3)血清1,3-β-D葡聚糖试验(真菌G试验)阳性(>60 pg/ml)伴乳酸脱氢酶升高(>618 U/L);(4)血液mNGS可检测出PJ碱基序列[7]。CMV病毒血症定义为血液mNGS可检测出CMV碱基序列[8]。mNGS检测流程和方法见本中心已发表研究[9]。排除标准:(1)入院5d内放弃治疗;(2)呼吸科医师重新评估,PJP诊断证据不充分;(3)临床及影像学资料不完整。本研究最终纳入符合上述标准的患者52例。
临床资料及实验室指标记录患者的性别、年龄等流行病学资料及肾脏病理情况,本次感染的病原微生物学证据,实验室检查、影像学结果,既往肾脏病和本次感染的治疗方案。随访起点定为入院第1天,随访终点定为入院后第30天。
统计学方法采用《SPSS 20.0》软件进行数据分析,正态分布计量资料以均数±标准差表示,偏态分布计量资料以中位数(四分位间距)表示。根据数据是否符合正态分布,组间比较用t检验或Mann-Whiteny 非参数检验。计数资料以百分比表示,组间比较用χ2检验或者Fisher精确检验。生存率采用Kaplan-Meier法分析、Log-rank检验。采用单因素COX回归模型计算各个因素的风险比值(HR),并将单因素P<0.1的变量纳入多因素COX回归模型,以进一步明确独立预后因素。P<0.05为差异有统计学意义,所有检验均为双侧检验。
结 果
一般资料52例患者中男性27例,PJP起病时平均年龄46.06±15.82岁。出现PJP症状至加用复方磺胺甲噁唑(SMZ)针对性抗感染治疗中位时间8.0(4.0, 13.5)d。38例非肾移植患者CKD病程中位时间4(3, 7)月。肾移植术后患者14例,肾移植术后病程11.50(5.75, 22.25)月。
基础疾病所有患者均经肾活检明确肾脏疾病诊断,其中移植肾慢性排斥反应14例,膜性肾病、IgA肾病各8例,狼疮性肾炎5例,足细胞病4例,局灶节段性肾小球硬化症3例,过敏性紫癜性肾炎、冷球蛋白血症肾损害各2例,抗中性粒细胞胞质抗体(ANCA)相关性肾炎、IgM肾病、具有肾脏意义的单克隆球蛋白病、膜增生性肾小球肾炎、糖尿病肾病、抗肾小球基膜病各1例。所有患者感染PJP前均接受免疫抑制剂治疗,曾使用泼尼松51例、其中单用泼尼松7例,他克莫司和吗替麦考酚酯各20例,雷公藤多苷12例,环孢素A 11例,利妥昔单抗5例,来氟米特4例,硼替佐米2例。累计使用免疫抑制剂数目1种9例、2种19例、3种15例、4种5例、5种4例。
临床表现及实验室检查根据患者入院第1天送检的外周血mNGS结果是否检测出CMV碱基序列,将本研究患者分为PJP组22例和PJP+CMV组30例,PJP+CMV组的CMV碱基序列数为35.5(4.0,106.25)条,CMV IgG抗体检测均为阳性,IgM抗体检测均为阴性。两组患者在年龄、性别、CKD病程、免疫抑制剂种类、泼尼松剂量、入院时感染症状、PJ碱基序列数、PJP症状出现至SMZ治疗时间、合并高血压和糖尿病比例、ICU住院天数等均无明显差异(P>0.05)(表1)。入院第1天的实验室检查结果除尿素氮(BUN)水平PJP+CMV组高于PJP组外(P=0.031),其他均无明显差异。在院期间监测CD4+T细胞最低值PJP+CMV组低于PJP组(P=0.022)。而血清真菌G试验、C反应蛋白(CRP)、降钙素原(PCT)、白细胞介素6(IL-6)的最高值等两组均无明显差异(表2)。两组胸部CT表现均为磨玻璃样改变和肺间质弥漫浸润性病变,PJP组有3例(13.64%)、PJP+CMV组有5例(16.67%)患者在院期间出现气胸或纵隔气肿(P=1.000)。

表1 伴和不伴CMV血症的PJP患者临床特征及在院期间治疗

表2 伴和不伴CMV血症的PJP患者主要实验室参数
其他病原体情况入院第1天送检的外周血mNGS结果中,PJP+CMV组有16例可见其他病原体,其中细菌11种,病毒8种,真菌2种。PJP组有14例可见其他病原体,其中细菌4种,病毒5种(表3)。住院期间送检血培养结果中,PJP+CMV组发现纹带棒状杆菌伴肺炎克雷伯菌1例、烟曲霉1例。PJP组血培养发现鲍曼不动杆菌1例。

表3 伴和不伴CMV血症的PJP患者外周血mNGS其他病原体结果
治疗所有患者PJP起病前均未接受SMZ预防治疗。入院后均予SMZ联合卡泊芬净,同时予甲泼尼龙40 mg/d至80 mg/d。外周血mNGS发现的其他细菌、真菌,参考血、痰培养病原微生物学药敏结果,均加用其他针对性抗生素治疗。所有患者均接受氧疗,其中鼻导管给氧10例,面罩给氧23例,经鼻高流量湿化氧疗(HFNC)5例,无创呼吸机4例,气管插管10例。11例患者接受连续性肾脏替代治疗(CRRT)。两组患者氧疗方式、CRRT比例均无明显差异(表1)。
预后本研究患者入院后30天内共13例(25%)患者死亡。其中肾移植术后、膜性肾病、狼疮性肾炎、足细胞病、冷球蛋白血症肾损害各2例,IgA肾病、局灶节段性肾小球硬化症、糖尿病肾病各1例。死亡中位时间为入院后15.0(8.0, 26.5)d。30d生存率PJP+CMV组为63.33%,PJP组为90.91%,两者差异显著(χ2=5.040;P=0.025)(图1)。PJP+CMV组有8例接受更昔洛韦抗病毒治疗,死亡4例,22例未接受抗病毒治疗患者,死亡7例。
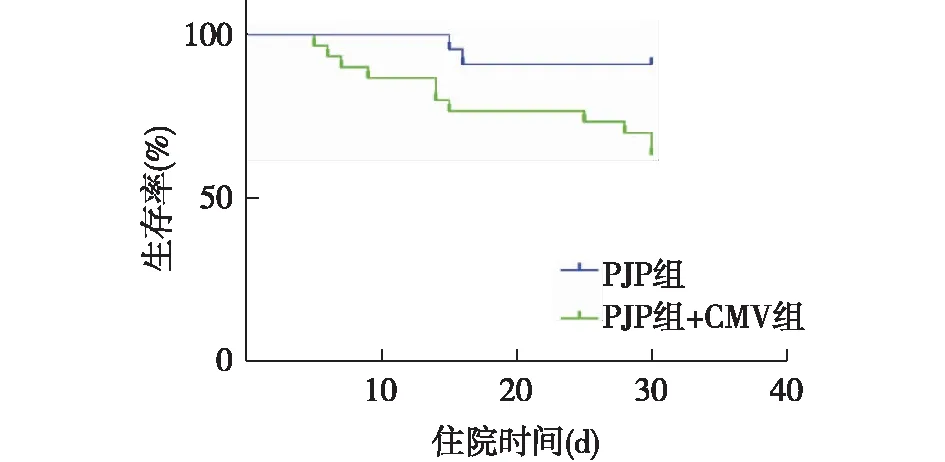
图1 本研究患者生存曲线对比PJP:耶氏肺孢子菌肺炎;CMV:巨细胞病毒
单因素COX回归分析显示合并CMV血症、低氧合指数、低CD4+T细胞数、高血清真菌G试验值、高BUN是CKD合并PJP患者死亡的危险因素,多因素COX回归分析发现合并CMV血症、低氧合指数、低CD4+T细胞数、高血清真菌G试验值是CKD合并PJP患者死亡的独立危险因素(表4)。
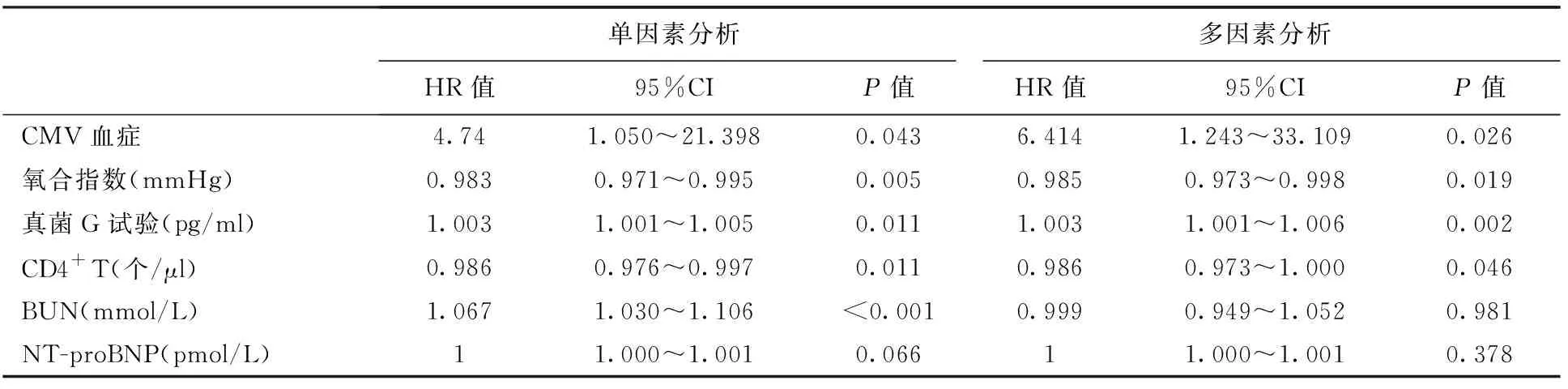
表4 COX回归分析影响CKD合并PJP患者死亡的危险因素
讨 论
原发性CMV感染主要发生在儿童时期,在人类中普遍存在,发达国家CMV IgG抗体阳性率达60%~80%,发展中国家甚至达到100%[10]。初次感染时,通常是亚临床状态或表现为非特异性的症状和体征。感染后CMV主要在潜伏于单核细胞和巨噬细胞中。当炎症、感染、免疫抑制时宿主免疫防御和非活性病毒平衡失调,触发潜伏CMV再激活,甚至出现脑炎、肺炎、肝炎、视网膜炎、结肠炎和移植器官排斥等CMV终末器官疾病[11]。荟萃分析显示在危重症患者中CMV血症与ICU死亡率、医院感染发生率、机械通气持续时间、CRRT频率等均存在明显关联[12]。非HIV-PJP患者肺泡灌洗液的高CMV载量与死亡率相关[13]。本研究发现CMV血症是CKD合并PJP患者死亡的独立危险因素,与之前研究结论一致。
目前CMV影响重症患者预后的具体机制仍不明。一方面CMV可能作为主要病原体通过三种机制致病:(1)直接通过细胞病理学损伤器官,如CMV肺炎。(2)机体对CMV的过度免疫应答,产生大量炎症介质,导致促炎/抗炎失衡,如急性呼吸窘迫综合征。(3)免疫防御体系受损,干扰抗原呈递和抑制T细胞增殖,增加其他病原微生物感染几率。另一方面CMV也可能只是反映疾病严重程度的一个标志物。例如脓毒症休克时的代偿性抗炎反应综合征、大量输血、外源性儿茶酚胺输注、细菌感染导致内毒素和肿瘤坏死因子释放可能导致CMV再激活[14]。本研究发现CMV血症并未导致CKD合并PJP患者的氧合指数进一步下降,炎症指标亦未继续上升,但治疗期间CD4+T细胞计数降低,混合感染更复杂,提示CMV可能并未加重该类病人的肺部损伤和炎症反应,但免疫系统损伤更重,混合感染增多。
本研究发现CKD合并PJP患者CMV病毒血症阳性率达57.69%。CMV血症在其他免疫缺陷人群中研究较多。HIV感染者CMV血症发生率为26.2%,CMV载量可能比HIV载量、CD4+T淋巴细胞计数与患者死亡风险相关度更高[15]。84.07%的炎性肠病患者合并CMV血症[16],20.31%的CKD患者在免疫抑制剂治疗期间出现CMV再激活[17],CD4+T细胞计数<390个/μl的风湿性疾病患者是CMV肺炎的高危人群[18]。干细胞移植患者中CMV IgG供者阳性/受者阴性(D+/R-)的人群死亡率最高,继发其他细菌或真菌感染是死亡的主要原因[19]。
由于感染PJP与CMV血症的危险因素高度重合,均包括低淋巴细胞血症和免疫抑制剂应用,对器官移植患者的荟萃分析发现CMV感染显著增加了PJP风险,故PJP合并CMV血症临床并不少见[20]。我国多中心研究发现长期免疫抑制剂治疗的患者感染时社区和医院PJP分别占20.2%和25.9%,而CMV肺炎社区和医院感染分别占29.3%和40.7%。两者易感时间亦高度重合,79%的PJP和71%的CMV肺炎在免疫抑制剂治疗6个月内起病,86%的PJP和82%的CMV肺炎在在1年内起病[2]。体外试验表明在血清中加入PJ后,CMV对单核巨噬细胞的呼吸爆发存在抑制作用[21]。动物试验表明PJ和CMV双重感染的小鼠体重下降更快,肺间质中病毒特异性CD8+T细胞增加,活化CD4+T细胞减少,导致PJ清除延迟[22]。在肾移植合并PJP患者中通过血液和肺泡灌洗液的非聚合酶链式反应(PCR)技术发现CMV感染组血白蛋白和氧合指数更低、CRP水平和需要CRRT比例更高[5]。而本研究发现两组患者入院时临床特征无明显差异。考虑本研究采用的mNGS技术敏感度更高,在PJP早期即可发现CMV血症,部分患者可能未发生CMV肺部感染。早年对HIV-PJP患者的研究发现,CMV血症并不影响预后[23]。但后续在非HIV-PJP患者中发现合并CMV血症死亡率达78.6%,显著高于对照组的46.7%[24],与本研究结论一致。
CMV血症是否需要早期针对性抗病毒治疗,目前暂无定论。在重症感染和严重创伤患者中发现更昔洛韦减少了CMV再激活率,但并未降低白细胞介素6(IL-6)水平和死亡率[25]。伐昔洛韦的临床试验甚至因为治疗组死亡率过高而提前终止[26]。对于PJP伴CMV血症,目前暂无临床试验或大样本的病例对照研究。仅有少量个案报道发现抗病毒治疗可能有效[27]。本研究发现抗病毒治疗的患者30d死亡率为50%,未接受抗病毒治疗的患者30d死亡率为31.82%,两者并无显著统计学差异(P=0.417),由于样本量较少,后续需要扩大样本量进一步探索。
本研究的局限在于缺少患者肺泡灌洗液的病原微生物学结果,CMV血症患者未能明确是否存在CMV肺炎。同时单中心回顾性研究的样本量较小,采用目前感染病学界并未达成一致共识的血液mNGS技术,而非PCR技术进行CMV血症的诊断也是本研究的缺陷,亟需后续加以进一步完善。
综上所述,CKD合并PJP患者的CMV血症阳性率较高,入院时的临床特征和实验室检查无明显差异。伴CMV血症者在院期间免疫缺陷恶化更为显著,预后更差。CKD患者PJP感染时建议明确是否同时合并有CMV血症。

