禽类光谱敏感性研究进展
潘承浩,金 定,陈金田,蒋劲松,泮进明*
(1.浙江大学生物系统工程与食品科学学院,杭州 310058;2.杭州市农业农村事务保障中心,杭州 310000;3.杭州朗拓生物科技有限公司,杭州 310020)
禽类视觉特征可分为三类:光谱敏感性(Spectral sensitivity),闪烁敏感性(Flicker sensitivity)和空间视敏度(Spatial acuity)[1]。其中光谱敏感性指动物对光刺激反应与光波频率之间关系。一般认为,人类可见光波长范围为380~780 nm,不同波长光辐射给人不同色彩体验,而单一波长光表现为特定颜色,称为单色光[2]。相比于人类,禽类视觉系统更发达,对各种单色光敏感性更强[3-4],甚至可感知人类看不见的紫外光[5]。家禽光照管理涉及因素包括光源种类、光照强度、光照时间、均匀性和光波长(光颜色)[6],其中光色对禽类生长影响最为突出。蓝绿光在生产性能、肌肉发育、肉品质等方面均有优势[7],而红光可将蛋鸡产蛋日龄提前,提高产蛋量[6,8],还可减少禽类啄癖行为的发生[9]。和红白光相比,绿光可促进下丘脑促生长激素释放激素(GHRH)和血浆生长激素(GH)释放[10],加快禽类生长发育。此外,短波光比长波光可更好地抑制松果体分泌褪黑素[11],影响睡眠质量,牵引昼夜节律[12-13]。
目前家禽光谱敏感性研究主要集中于光谱成分对家禽生产性能的影响,而光谱成分对于家禽生长发育的调节机制研究相对较少。因此难以从理论角度出发改善家禽生产过程中的光照环境,以提高禽类养殖福利,发挥其生产潜力。为解决此问题,本文首先梳理禽类视觉及非视觉的光感受机制研究,阐明光谱成分如何通过这两个途径调节家禽视觉感知和生理节律;其次分析几种家禽光谱敏感性测量方法优劣,并在文末概括家禽光谱敏感性方面亟需解决的问题及未来研究方向,为家禽生产中光环境设计和潜能提升提供参考。
1 光感受器类型
视觉感知中光感受器(Photoreceptor)主要是指视网膜中感光细胞。如图1所示,与人类相比,禽类视网膜中感光细胞种类更丰富,共包含3大类、7小类感光细胞[14]。第一大类是4种单视锥细胞(Single cone),其主要功能是调节禽类色彩感知能力[14-15];第二大类是两种双视锥细胞(Doublecone),可感知偏振光[16]和物体运动信息[15];第三大类是视杆细胞(Rod),主要负责感受昏暗光环境下亮度变化[17]。包括人类在内的灵长类动物视网膜所独有的中央凹区域集中许多视锥细胞,负责视觉高清成像[18],而禽类视网膜感光细胞呈现半随机分布(Semi-random mosaic),使禽类可凭借高视觉敏锐度感知各种波长的光[14]。

图1 鸡视网膜七类感光细胞[14]Fig.1 Seven photoreceptor cell types of the chicken retina
1.1 单视锥细胞
禽类视网膜共4种单视锥细胞,分别为红视锥细胞(Red cone)、绿视锥细胞(Green cone)、蓝视锥细胞(Blue cone)和紫视锥细胞(Violet cone)[14-15]。鸡视网膜感光细胞的细胞核主要位于外界膜(Outer limiting membrane)一侧外核层[19],感光细胞在视网膜位置如图2所示。

图2 鸡视网膜感光细胞示意图[15]Fig.2 Diagram of the photoreceptor cell types of the chicken retina
视锥细胞光谱敏感性通过油滴(Oil droplet)调节[20]。油滴是一种球形透镜状细胞器,位于脊椎动物视锥细胞外节(Outer segment)和内节(Inner segment)之间[21-22]。油滴影响外节光捕获的因素包括反射率、油滴直径和外节长度[21]。油滴由中性油脂和类胡萝卜素组成[23],存在色素的油滴可调节达到光敏感外节光的光谱成分和光照强度[21,23]。富含色素的油滴功能为一块长通滤光片(Long-pass filter),可吸收小于特定波长的光线[24-25],其功能微调主要是通过改变所含类胡萝卜素成分实现[23]。油滴理想的吸收光谱如图3表示。
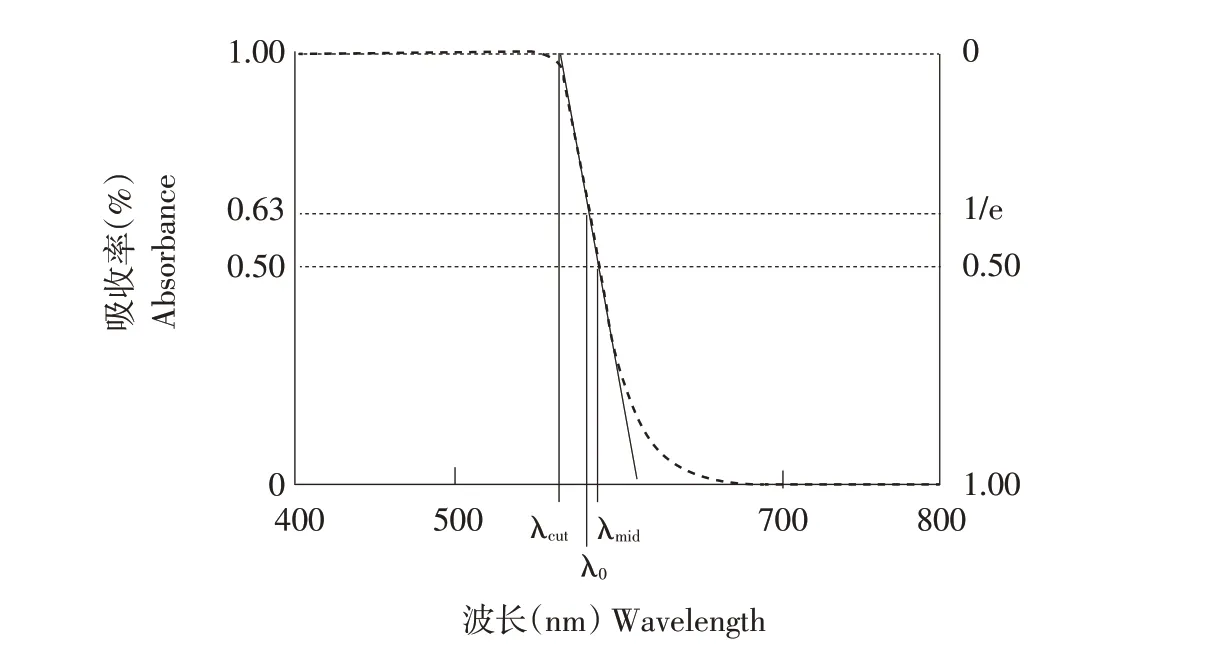
图3 理想油滴吸收光谱图[25]Fig.3 Diagram of an‘ideal’oil droplet absorptance spectrum
当油滴中色素密度较低时,油滴起带通滤光器(Band-pass filter)作用,根据所含色素不同,可特异性吸收紫外、蓝色、绿色等范围内光谱[24]。此外,禽类通过精确调节各视锥细胞中类胡萝卜素双肩共轭结构及浓度优化颜色辨别的能力,保持颜色恒常性[23]。
根据所含类胡萝卜素种类和浓度差异,禽类视网膜中油滴可分为五类:透明T型(Transparent),无色C型(Clear or Colorless),苍白色P型(Pale),黄色Y型(Yellow)和红色R型(Red)[24-26]。其中T型不含类胡萝卜素,在波长大于320 nm光下透明;C型含有棓黄质(Galloxanthin),主要吸收蓝色波段光谱;P型通常也被认为是浅绿色,包含两种类胡萝卜素,其中一种为棓黄质,另外一种为ε-胡萝卜素(ε-carotene)或玉米黄质(Zeaxanthin);Y型包含ε-胡萝卜素和玉米黄质,主要吸收中波段光谱;R型包含虾青素(Astaxanthin),主要吸收绿色或橙色波段光谱[24,27]。Goldsmith等通过显微分光光度法,得到包括家鸡(Gallus domesticus)在内的一些常见鸟类品种油滴吸光度数据平均值[27],经Stavenga等总结得到各色油滴数量和对应吸光度(图4)[24]。

图4 鸟类油滴分布情况[24]Fig.4 Distribution of the different oil droplet types of birds
如图5所示,Yoshizawa测定鸡视网膜4种单视锥细胞所含色素的吸收光谱,得到吸收峰分别为415、455、508和571 nm[28]。鸟类视锥细胞中含有以下4种视蛋白基因中一种:SWS1、SWS2、RH2和M/LWS[25]。鸟类紫外/紫色敏感视锥细胞(UVS/VScone)表达SWS1视蛋白基因(359 nm<色素λmax<426 nm),含有T类型油滴(在300~800 nm无表达明显的吸收峰);短波敏感视锥细胞(SWScone)表达SWS2视 蛋白基因(427 nm<色素λmax<463 nm),含有C类型油滴(399 nm<λcut<449 nm);中波敏感视锥细胞(MWScone)表达RH2视蛋白基因(499 nm<色素λmax<507 nm),含有Y类型油滴(505 nm<λcut<516 nm);长波敏感视锥细胞(LWScone)表达M/LWS视蛋白基因(557 nm<色素λmax<571 nm),含有R类型油滴(552 nm<λcut<586 nm)[25,29]。
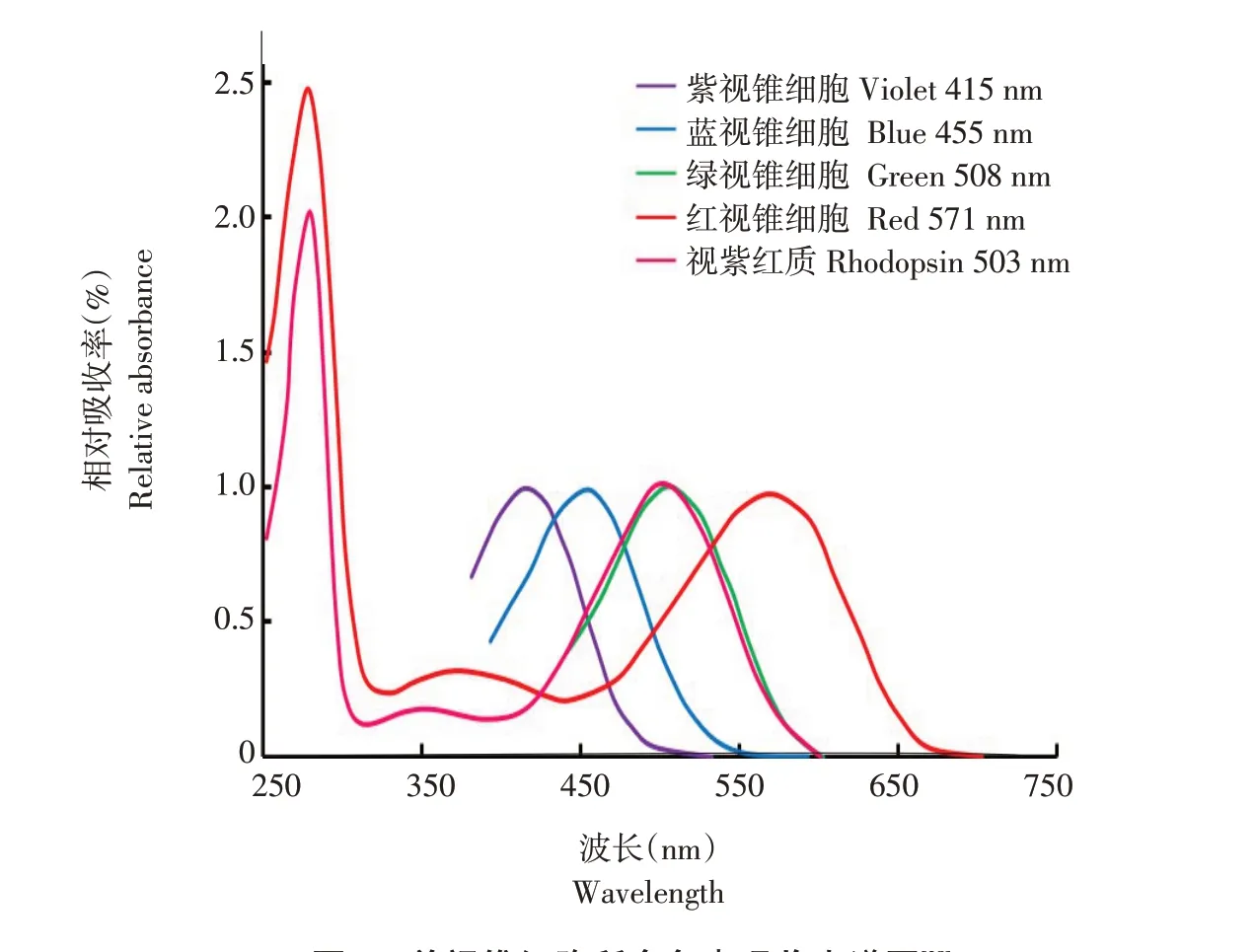
图5 单视锥细胞所含色素吸收光谱图[28]Fig.5 Absorption spectra of visual pigments in the cones
人类是三色视觉,而包括禽类在内大多数日行鸟类均为四色视觉[29-30],由于紫外/紫色敏感视锥细胞存在,鸟类可看见人类无法看见的紫外光[31]。除该细胞包含透明油滴外,剩余单视锥细胞所含油滴均有色;短波敏感视锥细胞油滴含有棓黄质;中波敏感视锥细胞油滴含有玉米黄质;长波敏感视锥细胞油滴含有虾青素[29]。
脊椎动物感光细胞中的视觉色素,由视蛋白和发色团11-顺-视黄醛(11-cis-retinal)或11-顺-3,4-脱氢视黄醛(11-cis-3,4-dehydroretinal)组成,发色团与不同视蛋白连接时造成吸收光谱存在差异的现象称为光谱调谐(Spectral tuning)[32]。色素光谱吸收特性由视蛋白的氨基酸组成和视蛋白所连的发色团性质决定。哺乳动物中,当视蛋白与11-顺式视黄醛结合时,生成视觉色素,其光谱吸收峰值范围如下:SWS1(355~440 nm)、SWS2(440~470 nm)、Rh2(480~530 nm)、LWS(500~565 nm)[33]。Hofmann等总结脊椎动物视觉色素共5种,按照视蛋白结合的发色团和氨基酸最大吸收波长(λmax)区分分别为:视紫红质(Rh1),LWS(500~570 nm)、MWS(或Rh2,480~530 nm)、SWS1(354~445 nm)和SWS2视觉色素(400~470 nm)[34]。
1.2 双视锥细胞
大多数无脊椎动物和脊椎动物均可感知偏振光(Polarized light),其中脊椎动物感知偏振光的结构基础是视网膜中的双视锥细胞[16]。双视锥细胞包含主锥体(Principal member)和附属锥体(Accessory member)[35]。如图1所示,鸡双视锥细胞分为A型和B型,其中A型附属锥体缺少油滴,而B型在主锥体和附属锥体中均存在油滴[14]。鸟类双视锥细胞包含P型油滴,和长波敏感视锥细胞同样表达LWS视觉色素[24]。Maier等研究相思鸟双锥细胞发现主锥体和附属椎体所含色素λmax与长波敏感视锥细胞色素λmax均约为568 nm[35]。
相比于单视锥细胞,双视锥细胞分布更有序,可能是由于其在运动检测中的定位作用[15]。鸡视网膜中周部(Mid-peripheral retina)不同区域5种视锥细胞比例如图6所示,可发现双视锥细胞数量多于各单视锥细胞。
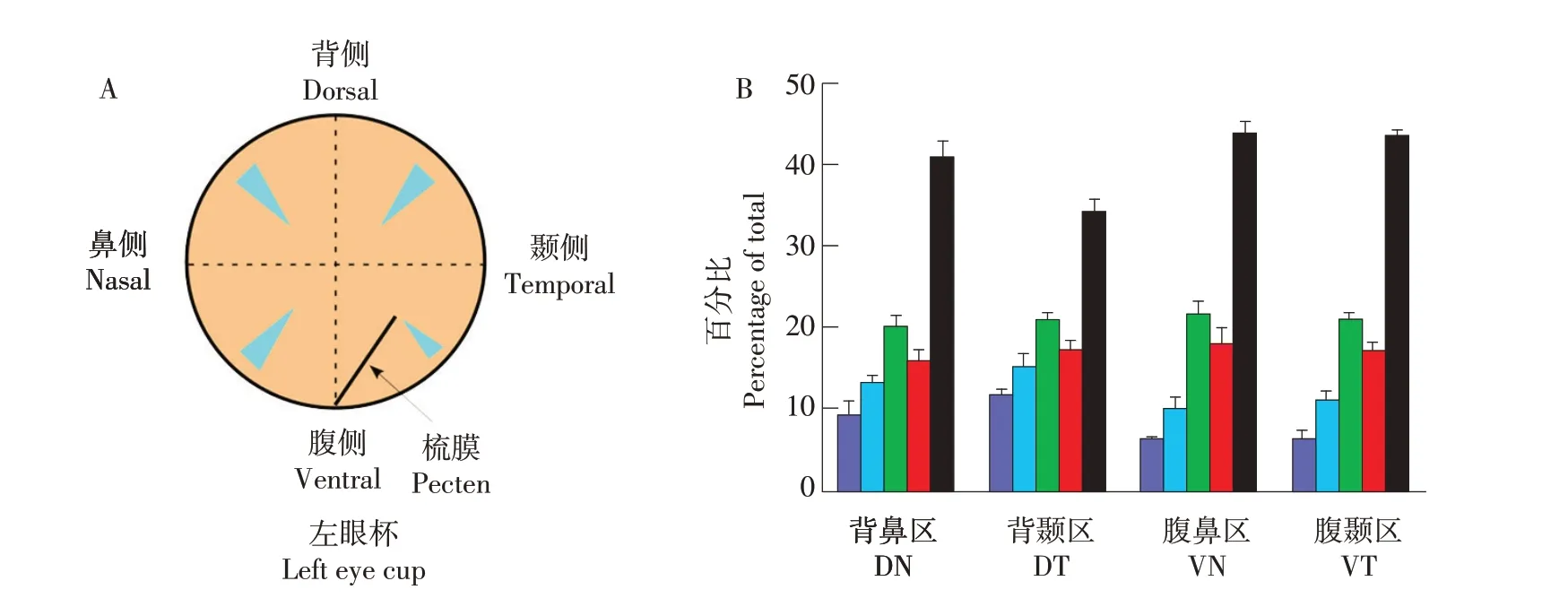
图6 视锥细胞特征比[15]Fig.6 Cone photoreceptor types are present in characteristic ratios
鸡各类型视锥细胞密度和相互之间距离如图7所示。视网膜视锥细胞分布特性决定选择普通显微镜还是荧光显微光谱检查视网膜,也反映物种间生态学差异[36]。Viets等研究发现不同鸟类视网膜的不同视锥细胞比例不同,例如海鸟有更少的长波长敏感视锥细胞[14]。原因可能是长波长较长光被海水吸收,也说明不同视锥基因分化由栖息地环境所决定。

图7 视锥细胞密度和间距关系[15]Fig.7 Density vs.average nearest neighbor distanceof different types of cones
1.3 视杆细胞
如图2所示,视杆细胞是一种特化神经元,由外节、内节、胞体、轴突和轴突末端组成,其中将光信号转化成电信号的生化途径包含在外节中,电信号通过电压门控通道传输至内节[17]。视杆细胞对光高度敏感,在暗光下可对单个光子作出反应[17,37]。不同辐照度下视锥视杆细胞反应如图8所示,在低辐照度下仅是视杆细胞起作用;在广泛的中等辐射范围内,低敏感性视杆细胞通路被视锥通路所取代;在高辐照度下,视杆细胞输入占主导作用[38]。Altimus等通过小鼠模型(视网膜感光细胞仅视杆细胞起作用,或视网膜缺少视杆细胞)研究发现,仅在高光强下视杆细胞才通过视锥细胞产生作用[39]。
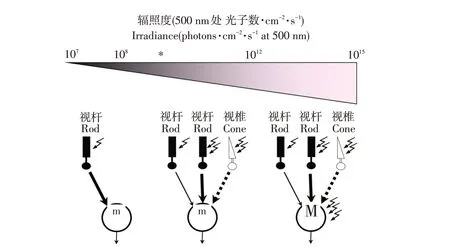
图8 辐照度与视锥视杆细胞输入关系[38]Fig.8 Relationship between irradiance and inputs from cones and rods
视杆细胞表达RH1视蛋白基因,其编码色素为视紫红质[17,25]。视紫红质吸收光子时开启视觉传导级联(Visual transduction cascade)[17]。鸟类视杆细胞所含色素和中波敏感视锥细胞表达的MWS视觉色素两者吸收光谱类似,其吸收峰范围均为499~507 nm[25]。Knott等研究发现,由于地理因素形成的不同红玫瑰鹦鹉(Platycercuselegans)亚种间,视锥视杆细胞敏感特性与羽毛颜色存在关联,虽然此种适应性功能并未得到验证,但其可能导致颜色感知行为或昏暗条件下行为产生差异,并为理解视觉在物种形成和分化中作用提供帮助[40]。Musilova等研究发现,深海脊椎动物存在多种视杆细胞蛋白,这也为进化提供了分子层面证据[41]。
根据国际照明学会(CIE)规定,亮度水平在3 cd·m-2以上视觉为明视觉(Photopic vision);亮度水平在0.001 cd·m-2以下视觉为暗视觉(Scotopic vision);明暗视觉之间存在中间视觉,亮度水平为0.001~3 cd·m-2(CIE 1978)。视锥细胞与明视觉有关,主要在强光下起作用;视杆细胞与暗视觉有关,在弱光下起作用[32,37,42]。背景光或物体亮度变化影响物体识别,在暗光下大多数脊椎动物是色盲,依靠视紫红质获取视觉信息[41]。夜行动物视网膜含有丰富的视杆细胞,而日行动物视网膜含有丰富的视锥细胞[43]。猫头鹰等黄昏或夜间活动鸟类视网膜以视杆细胞为主,缺乏感知紫外线的单视锥细胞,却也可探测紫外光,因视杆细胞敏感性增加,猫头鹰在夜晚将反射紫外线的羽毛当作更强的视觉信号[29]。
2 非视觉效应特点
1998年,Provencio等在非洲爪蟾光敏性皮肤黑色素细胞中首次鉴定出视黑素(Melanopsin)[44];2002年,Berson等发现哺乳动物视网膜中第三类感光细胞——内部感光视网膜神经节细胞(Intrinsically photosensitive retinal ganglion cell,ipRGC)[45]。视黑素和ipRGC的发现,打破以往认为光信息感知仅限于视锥视杆细胞主导的视觉感知观念[46],拉开非视觉效应(Non-visual effect)研究序幕。非视觉效应指光参与调节动物激素分泌、瞳孔收缩和昼夜节律等生物效应,因此也可称为非视觉生物效应(Non-visual biological effect)。哺乳动物中,视黑素是ipRGC中和光信号传导有关的关键色素[47-48],可调节生物钟并产生其他非视觉效应[49]。哺乳动物和啮齿类动物中,视黑素仅在ipRGC内特异性表达,但视黑素在所有脊椎动物中均表达[44,50]。鸡等禽类视网膜中其他视网膜神经节细胞(Retinal ganglion cell,RGC)也可表达视黑素[50]。
2.1 禽类光信息感知通路
禽类感知外界光刺激途径主要包括下丘脑光受体和视网膜光受体,将光信息转化为电信号,影响脑垂体释放激素调节机体生长发育、生产性能和行为活动[51]。光照可直接作用于肉鸡眼球,光信号经视锥视杆细胞转化为电信号后传递至大脑皮层形成视觉。另外,如图9所示,光照也可作用于禽类视锥视杆细胞,产生神经冲动传递到下丘脑,或光信号直接透过禽类颅骨刺激下丘脑上的光感受体,两条非视觉通路相互作用,促进下丘脑分泌促性腺激素释放激素(Gonadotropinreleasing hormone,GnRH),对垂体前叶(Anterior pituitary)产生刺激,影响相关性腺激素分泌[52]。此外,下丘脑也可通过视交叉上核(Supraoptic nucleus,SCN)和松果体(Pineal gland)调节钟基因(cClock,cBmal1,cBmal2,cCry1,cCry2,cPer2,cPer3)表达和褪黑素(Melatonin)合成关键——芳烷基胺N-乙酰基转移酶(Arylalkylamine N-acetyltransferase,AANAT)的转录,影响褪黑素合成与分泌、禽类生理节律[53-54]。鸟类生理节律由主时钟(Master clock)驱动,包括SCN、松果体和视网膜,亮暗周期是同步节律变化(如免疫反应)的重要线索[55]。

图9 禽类非视觉效应Fig.9 Non-visual effectsof light in poultry
2.2 视网膜外光受体
过去认为,视网膜和松果体是脊椎动物最主要感光组织,研究表明视网膜外光受体(Extraretinal photoreceptor)通过非视觉成像(Non-imageforming)产生非视觉效应影响行为[56]。脊椎动物前脑(Forebrain)存在的视网膜外光受体如下[57]:①松果体(Pineal organ or Pineal body),所有非哺乳脊椎动物均存在;②松果体旁器(Parapineal organ),多见于硬骨鱼和七鳃鳗;③颅外第三眼(Extracranial‘third eye’),青蛙中称为额器(Frontal organ),蜥蜴中称为顶眼(Parietal eye);④脑深层光受体(Deep brain photoreceptors),非哺乳脊椎动物大脑区域存在;⑤外侧眼(Lateral eyes),所有脊椎动物的外侧眼均包含感光细胞。
非哺乳脊椎动物普遍存在视网膜外光受体,可表达视锥细胞、视杆细胞或其他类型光色素[56-57]。低等和新生哺乳动物,存在视网膜外光受体,但成年哺乳动物中缺少视网膜外光受体[58]。视网膜外光受体拥有和视锥视杆细胞相似的细胞结构,可对光产生类似反应,其主要存在于皮肤、角膜、虹膜和中枢神经系统[59]。松果体是间脑(Diencephalon)内上丘脑(Epithalamus)的一部分,有专门分泌褪黑激素的细胞。脊椎动物中松果体器官的细胞日常功能类似于“光学神经内分泌单元”(Photoneuroendocrine unit),将光刺激转化为神经内分泌反应,其中包括合成褪黑素并释放到脑脊液(Cerebrospinal fluid,CSF)[56,59]。此外,与脑脊液接触的神经元可通过突触和非突触信号和神经内分泌系统连接[56]。鸟类光感受体常见分布如图10所示。

图10 鸟类光感受体位置[57]Fig.10 Proposed sites of encephalic photoreception in birds
鸟类光信号传导如图11所示,下丘脑室旁器官(Paraventricular organ,PVO)中表达第五类视蛋白接触脑脊液的神经元所检测到的光信息,传递至垂体结节部(Pars tuberalis,PT)诱导促甲状腺激素(Thyroid stimulating hormone,TSH)表达,从而促进脑室膜细胞(伸长细胞)中TSH受体表达2型脱碘酶(Type 2 deiodinase,DIO2),DIO2将甲状腺素(Prohormone thyroxine,T4)转化为具有生物活性的3,5,3′-三碘甲状腺氨酸(3,5,3′-triiodothyronine,T3),长时间诱导产生的T3导致神经末梢和神经胶质形态变化[60]。促进GnRH分泌,GnRH包括促黄体生成素(Luteinizing hormone,LH)和促卵泡激素(Follicle-stimulating hormone,FSH)。

图11 鸟类光信号传导示意图[60]Fig.11 Representation of thephotoperiodic signal transduction cascadein birds
2.3 常见非视觉效应
几乎所有生物均根据地球轴向自转调整其行为和生理节律(休息-活动周期、进食、新陈代谢、免疫功能、激素分泌和认知能力),这种调节关键是使内部生物钟与外部时间相适应[12]。常见非视觉效应包括钟基因表达[54,61],褪黑素分泌[54,62]和瞳孔光反应(Pupillary light reflex,PLR)[63-64]。
2.3.1 钟基因表达
与禽类生理节律相关核心钟基因包括:cBmal1、cBmal2、cClock、cCry1、cCry2、cPer2和cPer3[53,54,65]。钟基因可分正向基因(Positiveelement)和反向基因(Negative element)两类,正向基因包括cBmal1、cBmal2和cClock;反向基因包括cCry1、cCry2、cPer2和cPer3[65-66]。
光照条件下钟基因表现出明显昼夜震荡[53,61,67]。钟基因表达不依赖于光照时长,但持续光照条件导致日变化幅度降低[68]。Liu等研究发现,相比于白光,单色光养殖下鸡肝脏钟基因表达节律并未发生明显变化,但松果体切除手术明显降低肝脏钟基因表达[54]。Bian等研究鸡离体视网膜组织中钟基因的表达发现,在持续黑暗条件下,cBmal1、cCry1、cPer2和cPer3表达呈现昼夜节律[61]。
绿光提高正向基因mRNA转录振幅和中值,降低反向基因mRNA转录振幅和中值,而红光作用则反之[53,66]。Jiang等研究单色光对鸡松果体钟基因表达影响后发现,相比于白光,蓝光使反向基因表达峰值期提前0.1~1.5 h,使正向基因表达峰值期推迟0.2~0.8 h;红光推迟除cClock和cPer2外所有钟基因表达0.3~2.1 h;而绿光推迟除cBmal2外所有钟基因表达峰值期0.5~1.5 h[65]。
2.3.2 褪黑素分泌
褪黑素是指视网膜和松果体中感光细胞在黑暗中合成和释放的神经激素[59]。褪黑素分泌具有昼夜节律[69-70],夜幕降临后光刺激减弱导致合成褪黑素酶类活性增强,褪黑素分泌水平也相应升高,在2:00~3:00达到高峰[71]。不同颜色和强度的光影响鸟类褪黑素分泌、日常行为和生理节律[72]。Deep等研究光强对肉鸡日常行为影响发现,1~40 lx背景光下养殖肉鸡分泌褪黑素节律无明显差异,仅休息行为增加[73]。Zawilska等研究发现24:00前给予6 h光照,24 h后AANAT节律相位推迟(3.5±0.4)h,反映夜晚光线抑制AANAT活性和褪黑素分泌[70]。
Bian等研究鸡视网膜褪黑素分泌发现,绿光通过加速cClock和cBmal1等钟基因表达,促进AANAT表达和褪黑素合成[74]。Chen等研究褪黑素对单色光诱导的T淋巴细胞增值发现,松果体切除降低血液循环中褪黑素浓度,抑制T淋巴细胞增殖,消除绿光和红蓝光之间差异[75]。绿光通过增强正向基因表达和抑制反向基因表达,促进AANAT合成,提高褪黑素分泌[53,66]。此外在肉鸡下丘脑中,褪黑素对于绿光增强GHRH表达和血浆GH浓度起关键作用,因为绿光提高GHRH的mRNA和蛋白水平,而在松果体切除后不同单色光之间无显著差异[10]。
非视觉成像最大敏感波段为446~483 nm,因该波段褪黑素分泌明显受抑制[13]。在抑制生理节律牵引方面短波长光谱更有效,因相比于长波,短波长光谱可抑制褪黑素分泌[11]。核磁共振表明,与绿光或紫光相比,白天暴露于蓝光下,大脑皮质丘脑和脑干区域相关记忆任务更有效,因蓝光可抑制褪黑素分泌,减少反应时间提高注意力,提升视觉舒适度[13]。
2.3.3 瞳孔光反应
在人类视网膜中,ipRGC可整合来自视锥视杆细胞的信号[76-78],并将其传输到SCN等非视觉成像区域[45,77,79],从而产生广泛的非视觉效应,如瞳孔收缩、睡眠调整、节律牵引和情绪控制[76,80]。Kelbsch等发现,光刺激面积、亮度、时间、波长和背景照明均影响PLR[81]。与人类相比,家禽瞳孔收缩速度更快,但振幅更小[82]。基于人类稳定瞳孔收缩率和最大瞳孔收缩率数据的光谱敏感性曲线如图12所示[83]。

图12 基于瞳孔光响应光谱敏感型曲线[83]Fig.12 Spectral sensitivity curve based on pupillary light reflex
对于禽类来说,虽然体内缺少ipRGC,但可通过松果体等视网膜外光受体分泌褪黑素等激素影响PLR。Valdez等发现盲鸡(视网膜上无视锥视杆细胞)一天中CT6时(白天开始光照后第6个小时)PLR最为强烈,且蓝光对其影响强于白光,说明在非哺乳脊椎动物中,也存在节律性PLR[64]。另外在L:D=12:12(12 h光照,12 h黑暗)光周期下,鸡也表现明显PLR和进食节律性[84],且这种节律性可能是由维生素A为基础的光色素(最大吸收峰为480 nm)所调节[64,84]。
3 光谱敏感性测量方法
目前发展成熟的禽类光谱敏感性检测方法共有3种,分别为显微分光光度法(Microspectrophotometry)、视网膜电图法(Electroretinogram method)和行为学测试法(Behavioral test)。
3.1 显微分光光度法
视锥细胞除可单独分离外,也可通过柱层析等方法将其中色素分离纯化,然后使用显微分光光度计测定细胞或色素吸收光谱,称为显微分光光度法[25,28,85]。在本文1.1章节中关于视锥细胞所含色素最大吸收峰及油滴截止波长等测定都应用了显微分光光度法。但显微分光光度法仍存在诸多问题。首先,禽类视网膜上的油滴直径仅为2~4μm,加之油滴周围漏光,造成使用显微分光光度法获得禽类视网膜色素吸收光谱的难度较大;其次,禽类视锥细胞外节较薄,如摘除视网膜,势必破坏视锥细胞外节部分,使获得的吸收光谱无法完整反映视锥细胞光谱敏感性[86]。
3.2 视网膜电图法
将动物固定在可调支架上,将一个引导电极与角膜接触,另一个面积较大的参照电极放在额部或结膜等部位,将接地电极置于同侧前额或颊部,当给视网膜以光刺激时可在示波器上观测到一系列电位变化[87],即视网膜电图(ERG)。ERG组成包括a、b、c及d波、早期感受器电位、暗适应及明适应阈值和振荡电位等。
McGoogan等在雄性白色来航鸡ERG检测中发现,L∶D=12∶12或全程黑暗养殖环境下,ERG的a波和b波振幅白天高于夜间,且两种波潜伏期夜间比白天长[88]。Wu等在白尾鸽ERG检测中也有类似发现,白天ERG的b波振幅高于夜间,夜间ERG的a波和b波潜伏期比白天更长[89]。
视网膜电图法虽可有效测量视锥视杆细胞、双极细胞和神经节细胞的功能,但传统全视野ERG测量的是视网膜内细胞受光刺激后总电位变化,难以判别局部病变,因此多焦视网膜电图(mf-ERG)被应用于视网膜病变研究[90]。另外,ERG测量时,电极接触不良、眼睛偏差和高度近视等外界因素也影响ERG信号幅度[91]。
3.3 行为测试法
行为测试法分为适应、训练和测试3个步骤,通常在以斯金纳箱为原型设计的心理行为学实验装置中进行[3]。适应过程主要为减小实验动物在陌生环境下应激。训练时,箱子前部有两个通光孔,随机选取一个用测试光点亮,而另一个保持黑暗。禽类识别准确后得到食物奖励,经不断训练直至其对其中点亮的通光孔作出正确反应。测试时,将点亮通光孔光源换成不同波长单色光,并不断降低光照强度(以光量子通量密度表征,μmol·m-2·s-1),直至其通光孔无法被正确识别,即可得到不同波长单色光能感知的光照强度阈值,进而归一化处理得到光敏感曲线。
运用该方法,学者们研究16周龄Cobb肉鸡、17周龄雌性火鸡、19周龄母鸭和成年人明视觉光敏感曲线,对比发现3种家禽光敏感曲线存在峰值波长相近的4个峰,最敏感波长与人类相同,为544~577 nm;而该方法测得的人类光敏感曲线比CIE标准曲线也多1个约450 nm波峰(见图13)[3-4]。

图13 行为测试法测量火鸡、鸭子、鸡、人类光谱敏感性曲线[4]Fig.13 Behavioral test for measurement in spectral sensitivity curveof duck,turkey,broiler and human
行为测试法虽从生物体水平揭示家禽视网膜光谱敏感性,但此类测试具体实施具有一定挑战性。首先,不同年龄和性别家禽,光谱敏感性可能差异较大;其次,试验中背景颜色和亮度也影响动物色彩感知[92-93],昏暗光线下一般脊椎动物会失去对颜色的感知能力[94];最后,并非所有物种均可通过行为训练以重复执行特定的行为任务。另外,行为测试法并不能阐明家禽感光通路机制。
4 结论
目前禽类养殖中,光环境主要围绕人类视觉系统设计,忽视禽类实际生产需求,因此探讨不同单色光下禽类光谱敏感性特点,设计符合禽类视觉的光照环境极具研究价值和应用前景。与此同时,以下难点亟需解决:①在分子、细胞和解剖水平上,鸡胚与人类胚胎具有显著相似性,加之其可视化和实验操作可行性,因此鸡胚常作为模型研究视网膜发育[95]。但在实际生产过程中,雏鸡一般需较高光照强度和较长亮光期以辅助觅食,这可能与雏鸡出雏后视网膜发育不成熟和视觉认知的建立有关。Lopez等研究表明,视锥细胞油滴颜色分化开始于胚胎期第16、17天,约在出雏后第15天结束[96]。因此,雏鸡视网膜发育和视觉认知特性是目前迫切需解决的问题。②对于生物非视觉效应的研究始于21世纪初ipRGC的发现,该细胞主要分布在哺乳动物中,而对于禽类,光往往通过非哺乳脊椎动物普遍存在的视网膜外光受体影响相关生理激素分泌和牵引生理节律。因此研究禽类和哺乳动物在非视觉效应作用通路的区别十分重要。③在光谱敏感性测量方面,显微分光光度法由于其离体破环性无法获得完整的色素吸收光谱,区别于家禽整体光谱敏感性,故应优化视网膜剥离手段以保证视锥视杆细胞充分提取;而视网膜电图法虽具有无损的特点,但其仅反映视网膜整体光谱敏感性,故应与计算机技术结合,通过mf-ERG等技术以加强对视网膜内不同区域光谱敏感性的测量能力;行为测试法虽直观且易操作,可体现整体光谱敏感性,但无法探明测试环境的光色和光照强度对测试对象光谱敏感性的影响,因此需迫切明晰不同光色和光照强度测试环境下,禽类光谱敏感性规律。
从发展前景看,主要向突破技术难点和拓展实际应用两方面发展,今后研究重点主要集中于以下两点:①应用遗传学、分子生物学、蛋白组学等现代生物技术探索家禽光感受机制,明确家禽和人类光感受机制区别,以便为家禽光环境设计提供理论指导。②进一步探索家禽在不同生长阶段对于不同光谱、光照周期、光照强度的需求,制定适合家禽生长,可有效提升禽肉或禽蛋品质的光照制度,以推动国内家禽产业快速发展。

