肠炎沙门菌胞外分泌蛋白的核酸酶活性测定
田文静,廖成水,李 琦,毛福超,程相朝
(1. 洛阳职业技术学院食品与药品学院,河南 洛阳 471003 ; 2.河南科技大学动物科技学院 洛阳市活载体生物材料与动物疫病防控重点实验室,河南 洛阳 471023)
肠炎沙门菌(Salmonellaenteritidis)是临床上常见的宿主广泛的食源性肠道病原体,它可以引起动物感染疾病,甚至造成人的食物中毒,严重者出现全身性败血症[1-2]。肠炎沙门菌作为人兽共患病病原菌,给养殖行业以及人类的健康带来了严重的危害,被大众广泛关注和研究[3]。肠炎沙门菌的致病性主要是依赖于一些毒力因子,如菌毛、荚膜、鞭毛和脂多糖等[4]。为了能在宿主中存活,许多细菌分泌多种胞外酶,例如蛋白酶、脂肪酶、透明质酸酶和胞外核酸酶等,这些酶能使细菌逃避宿主的免疫系统[5]。这些酶类可以固定在细胞外膜上,也可以释放到细胞外空间[6]。其中,胞外核酸酶是一种由人类、动物、细菌、真菌、寄生虫等多种生物分泌的酶类,能够降解环境中DNA或RNA的酶类,对于细菌的毒力、生物被膜的形成、黏附、侵袭以及利用胞外DNA获取营养起着重要作用[7-9]。另外有研究发现,胞外核酸酶还能防御中性粒细胞胞外诱捕网(NETs),降解胞外诱捕网中的DNA[10]。
虽然近年来在研究肠炎沙门菌致病机制方面取得一定的进展,但关于肠炎沙门菌分泌的胞外蛋白在其致病机制中的作用尚未见报道。因此,本试验通过琼脂糖凝胶电泳法、琼脂扩散法和琼脂培养法检测肠炎沙门菌胞外分泌蛋白的核酸酶活性,并从温度、pH和金属离子等因素探究肠炎沙门菌胞外分泌蛋白核酸酶的最适反应条件。试验结果不仅能为研究胞外分泌蛋白的核酸酶提供理论依据,并为进一步研究肠炎沙门菌病的致病机制以及逃避机体免疫作用提供科学依据。
1 材料与方法
1.1 菌株与试剂 肠炎沙门菌由笔者实验室保存。DNase I,购自TaKaRa(大连)有限公司;λDNA,购自德国Sigma公司;核酸染料GoldView和BCA蛋白质定量检测试剂盒,均购自北京索莱宝科技有限公司;蛋白胨、NaCl、琼脂、酵母浸粉、琼脂粉、琼脂糖等常用试剂,均为国产分析纯,均购自天津市德恩化学试剂有限公司。
1.2 肠炎沙门菌胞外分泌蛋白的收集 取-70 ℃超低温冰箱保存的肠炎沙门菌,利用固体培养基进行活化培养、传代,挑取固体培养基上的单菌落接种到普通液体培养基中,放入温度为37 ℃、转速为180 r/min的恒温振荡培养箱中培养12~16 h,然后按1 mL菌液转接至新鲜的10 mL普通液体培养基中,同样温度和转速培养5 h后,用低温离心机高速离心15 min,取上清液,将上清液透析,获取胞外蛋白,BCA蛋白质定量检测试剂盒测定所获胞外蛋白的浓度,4 ℃保存备用。
1.3 琼脂培养法测定肠炎沙门菌胞外分泌蛋白的核酸酶活性 以50 mmol/L的PBS溶液(pH 7.0)为基础溶液配制普通培养基进行灭菌,加入无菌的λDNA,使其终浓度达到50 μg/mL,另外再加入GoldView核酸染料,使染料终浓度达到1 μg/mL,倒入平皿凉干备用。将已培养的肠炎沙门菌菌液稀释到合适浓度,取100 μL菌液均匀涂抹在固体平板上,放置到37 ℃培养箱培养18~24 h,取出放入凝胶成像系统,观察平板上各菌落周围λDNA的降解程度。
1.4 琼脂扩散法测定肠炎沙门菌胞外分泌蛋白的核酸酶活性 按1.3中方法配置固体培养基,用打孔器打4个直径为5 mm的孔,向其中3个孔中分别加入LB液体培养基(阴性对照组)、DNase I(阳性对照组)、胞外分泌蛋白(试验组),剩余1个孔不加任何试剂,作为空白对照组。恒温培养箱37 ℃培养24 h, 利用凝胶成像系统观察4个孔周围λDNA的降解程度。
1.5 琼脂糖凝胶电泳法测定肠炎沙门菌胞外分泌蛋白的核酸酶活性 通过设置对照组进行测定,试验组:胞外分泌蛋白的浓度分别为1、2、3、4 μg/mL和5 μg/mL;5 μL 50 mmol/L磷酸盐缓冲液(pH 7.0)、1 μL λDNA,ddH2O补充到总体积为20 μL,混合均匀。以λDNA(0.01 μg)作为参照量,DNase I为阳性对照组,普通培养基为阴性对照组。37 ℃恒温水浴30 min后,通过琼脂糖凝胶电泳法测定产物。
1.6 温度对肠炎沙门菌胞外分泌蛋白核酸酶活性的影响 参照1.5的方法,根据预试验将λDNA质量调至0.1 μg,其他参数不变,设置不同温度梯度,分别为4、16、25、30、37、42、50 ℃和60 ℃,检测温度变化对肠炎沙门菌胞外分泌蛋白核酸酶活性的影响,以λDNA(0.1 μg)作为参照量,凝胶成像系统进行观察。同样参照1.5的方法,根据预试验将λDNA质量调至0.05 μg,其他参数不变,将胞外分泌蛋白分别在50、60、70 ℃和80 ℃孵育20 min。以λDNA(0.05 μg)作为参照量,按同样操作,检测其热稳定性。
1.7 pH对肠炎沙门菌胞外分泌蛋白核酸酶活性的影响 参照1.5的方法,根据预试验将λDNA质量调至0.05 μg,分别向反应体系中加入5 μL不同pH 的缓冲溶液(pH 3.0~11.0),37 ℃孵育20 min。以λDNA(0.05 μg)作为参照量,同样利用凝胶成像系统观察pH变化对胞外分泌蛋白的核酸酶活性的影响。
1.8 金属离子对肠炎沙门菌胞外分泌蛋白核酸酶活性的影响 参照1.5的方法,测定钠离子(Na+)、钾离子(K+)、钙离子(Ca2+)、钴离子(Co2+)、钡离子(Ba2+)、镁离子(Mg2+)、镍离子(Ni2+)、锌离子(Zn2+)、铜离子(Cu2+)、锰离子(Mn2+)和铁离子(Fe3+)对胞外分泌蛋白核酸酶活性的影响,配置上述不同金属离子终浓度分别为0.01、0.1、1、5 mmol/L和10 mmol/L的20 μL反应体系,根据预试验将λDNA质量调至0.05 μg,其他参数不变,37 ℃孵育20 min,利用凝胶成像系统观察。
2 结果
2.1 琼脂培养法测定肠炎沙门菌胞外分泌蛋白的核酸酶活性 将稀释后的肠炎沙门菌菌液均匀涂抹在固体培养基上,在37 ℃恒温培养箱中培养12 h,利用凝胶电泳成像系统观察,结果如图1A所示,固体琼脂平板上有单个菌落长出且菌落周围出现酶切圈,肠炎沙门菌胞外分泌蛋白表现出对λDNA具有切割能力,说明胞外分泌蛋白具有核酸酶活性。

图1 琼脂培养法测定肠炎沙门菌胞外分泌蛋白的核酸酶活性Fig.1 Detection of nuclease activity in Salmonella enteritidis exocrine proteins by agar culture assayA:胞外分泌蛋白; B:对照A:Extracellular secreted proteins; B:Control
2.2 琼脂培养法测定肠炎沙门菌胞外分泌蛋白的核酸酶活性 将含有λDNA和核酸染料的琼脂平板打4个孔,并加入对应的溶液,37 ℃恒温培养箱培养24 h。凝胶电泳成像仪观察结果如图2所示,DNase I阳性对照组和胞外分泌蛋白试验组出现了酶切圈,说明λDNA被降解,而阴性对照组和空白对照组没有出现酶切圈(图2),进一步证实了肠炎沙门菌胞外分泌蛋白具有切割λDNA的能力,具有核酸酶活性。

图2 琼脂扩散法测定肠炎沙门菌胞外分泌蛋白的核酸酶活性Fig.2 Detection of the nuclease activity in Salmonella enteritidis exocrine proteins by agar diffusion methodA:DNase Ⅰ 阳性对照组; B:胞外分泌蛋白试验组; C:阴性对照组; D:空白对照组A:DNase Ⅰ positive control group; B:Extracellular secreted proteins experimental group; C:Negative control group; D:Blank control group
2.3 琼脂糖凝胶电泳法测定肠炎沙门菌胞外分泌蛋白的核酸酶活性 通过琼脂糖凝胶电泳法测定肠炎沙门菌胞外分泌蛋白的核酸酶活性[11],结果如图3所示,DNase I阳性对照组中的λDNA被完全降解,阴性对照组中的λDNA未被降解,试验组不同浓度的胞外分泌蛋白均能将λDNA降解,并且随着胞外分泌蛋白浓度的增加核酸酶的活性逐渐增强,4 μg/mL胞外分泌蛋白就可以把λDNA完全降解。结果说明肠炎沙门菌胞外分泌的蛋白具有核酸酶活性。
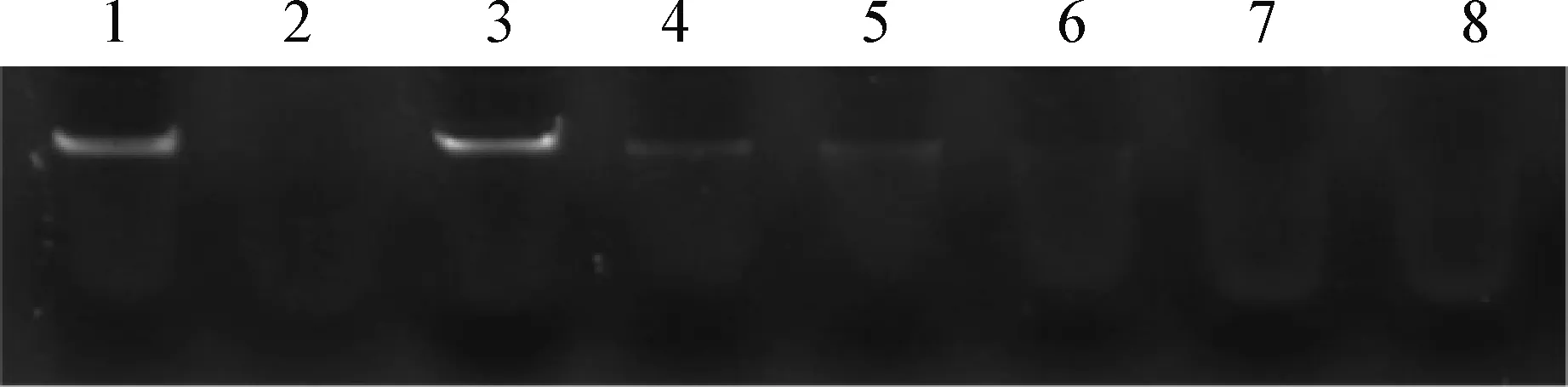
图3 琼脂糖凝胶电泳法测定肠炎沙门菌胞外分泌蛋白的核酸酶活性Fig.3 Detection of the nuclease activity in Salmonella enteritidis exocrine proteins by agarose gel electrophoresis 1:λDNA; 2:DNase Ⅰ 阳性对照组; 3:阴性对照组; 4~8:1、2、3、4 μg/mL和5 μg/mL胞外分泌蛋白试验组1:λDNA; 2:DNase Ⅰ positive control group; 3:Negative control group; 4-8:1,2,3,4 μg/mL and 5 μg/mL extracellular secreted proteins experimental group
2.4 温度对肠炎沙门菌分泌蛋白核酸酶活性的影响 通过检测温度对胞外分泌蛋白核酸酶活性的影响发现,在不同温度下胞外分泌蛋白均能表现出降解λDNA的活性,其中在4~30 ℃时胞外分泌蛋白的核酸酶活性较弱,37~50 ℃时核酸酶活性较强,37 ℃时降解λDNA活性最强(图4A),60 ℃时酶活性又有所降低。对其热稳定性进行分析,肠炎沙门菌胞外分泌蛋白经50、60、70 ℃和80 ℃处理后再进行酶切试验。结果显示,胞外分泌蛋白在低于60 ℃时具有核酸酶活性,在高于60 ℃时核酸酶活性降低,但并未完全消失(图4B)。结果表明肠炎沙门菌胞外分泌蛋白的核酸酶的热稳定性差。

图4 温度对肠炎沙门菌胞外分泌蛋白核酸酶活性的影响Fig.4 Effect of temperature on the nuclease activity of Salmonella enteritidis exocrine proteinsA:胞外分泌蛋白在不同孵育温度下的核酸酶活性(1:λDNA; 2:4 ℃; 3:16 ℃; 4:25 ℃; 5:30 ℃; 6:37 ℃; 7:42 ℃; 8:50 ℃; 9:60 ℃);B:胞外分泌蛋白在高温条件下的热稳定性(1:λDNA; 2:50 ℃; 3:60 ℃; 4:70 ℃; 5:80 ℃)A:Nuclease activity of extracellular secreted proteins at different temperatures; B:Heat stability of extracellular secreted proteins under high temperature conditions
2.5 pH对肠炎沙门菌分泌蛋白核酸酶活性的影响 采用琼脂糖凝胶电泳法测定不同pH环境对肠炎沙门菌胞外分泌蛋白核酸酶活性的影响,结果如图5所示,肠炎沙门菌胞外分泌蛋白核酸酶在环境pH 3.0~6.0时酶活性较弱,而在pH 7.0~8.0时肠炎沙门菌胞外分泌蛋白核酸酶活性逐渐增强,pH 8.0时胞外分泌蛋白的核酸酶活性最高,pH 9.0~11.0时核酸酶活性又被有所抑制。

图5 pH对肠炎沙门菌胞外分泌蛋白核酸酶活性的影响Fig.5 Effect of pH on nuclease activity of Salmonella enteritidis exocrine proteins1:λDNA; 2:pH 3.0; 3:pH 4.0; 4:pH 5.0; 5:pH 6.0;6:pH 7.0; 7:pH 8.0; 8:pH 9.0; 9:pH 10.0; 10:pH 11.0
2.6 金属阳离子对肠炎沙门菌分泌蛋白核酸酶活性的影响 用琼脂糖凝胶电泳法测定不同浓度金属阳离子对肠炎沙门菌胞外分泌蛋白核酸酶活性的影响。结果如图6所示,不同金属阳离子对肠炎沙门菌胞外分泌蛋白切割DNA的能力影响存在显著差异,其中Na+、K+(0.01~10 mmol/L)对胞外分泌蛋白的核酸酶活性没有影响;Ca2+在低浓度时(0.01 mmol/L)促进胞外分泌蛋白的核酸酶活性,在0.1~10 mmol/L时抑制胞外分泌蛋白的核酸酶活性;Co2+、Cu2+、Mg2+、Ba2+和Fe3+五种金属离子浓度为0.01~1 mmol/L时抑制胞外分泌蛋白的核酸酶活性,浓度为5~10 mmol/L时促进胞外分泌蛋白的核酸酶活性;而Ni2+、Zn2+和Mn2+三种金属离子则是在低浓度区间(0.01~1 mmol/L)时能促进胞外分泌蛋白的核酸酶活性,在高浓度区间(5~10 mmol/L)时可抑制胞外分泌蛋白的核酸酶活性(图6)。

图6 金属阳离子对肠炎沙门菌胞外分泌蛋白核酸酶活性的影响Fig.6 Effect of metal ions on nuclease activity of Salmonella enteritidis exocrine proteinsA:Na+; B:K+; C:Ca2+; D:Co2+; E:Ba2+; F:Mg2+; G:Ni2+; H:Zn2+; I:Cu2+; J:Mn2+; K:Fe3+1:λDNA; 2:λDNA+DNase Ⅰ; 3:λDNA+胞外蛋白; 4~8:各离子不同浓度(0.01、0.1、1、5 mmol/L和10 mmol/L)1:λDNA; 2:λDNA and DNase Ⅰ; 3:λDNA and extracellular secreted proteins; 4-8:Different concentrations of each ion(0.01,0.1,1,5 mmol/L and 10 mmol/L)
3 讨论
鞭毛、纤毛、Ⅲ型分泌系统、黏附系统、外毒素等是沙门菌致病机制研究中常见的致病因子[12-13],但肠炎沙门菌分泌的胞外蛋白在其致病过程中的作用至今尚未见报道。本试验以肠炎沙门菌分泌的胞外蛋白为切入点,初步研究肠炎沙门菌分泌的胞外蛋白是否具有核酸酶的活性,然后对影响酶活性的因素进行研究,分析酶学特性。本试验证明了肠炎沙门菌胞外分泌蛋白具有切割λDNA的能力,并且随其浓度增加,胞外分泌蛋白核酸酶的切割能力逐渐加强,说明肠炎沙门菌胞外分泌蛋白的核酸酶具有活性,该结果为今后研究肠炎沙门菌胞外分泌蛋白的核酸酶在致病过程中以及逃避机体免疫作用提供了新的思路。
细菌胞外核酸酶在人类和植物的致病菌中尤为常见,致病菌分泌的胞外蛋白核酸酶主要具有内切活性。部分胞外核酸酶以镶嵌形式存在于细胞膜上,有的则可以直接分泌到周围的环境中,均为I型核酸酶,该酶型不仅具有核酸内切酶,同时还具有3′核苷酸酶活性,可以降解RNA、ssDNA、dsDNA等底物[14-16]。在不同环境中,多种因素均能影响核酸酶的活性,例如温度、酸碱和金属离子等。多数微生物核酸酶在温度35~44 ℃表现出高活性[17],如DNase、ITREX1和FEN I等核酸酶最佳活性温度是37 ℃。本试验结果显示,肠炎沙门菌胞外核酸酶在37~50 ℃均表现出较高活性,最适酶活性温度为37 ℃,说明肠炎沙门菌分泌的胞外核酸酶可能属于I型核酸酶。通常情况下,微生物产生的核酸酶在pH 6.0~10.0时具有活性,且在反应环境pH 8.0~8.5时活性最高[17],而本试验发现,肠炎沙门菌分泌的核酸酶在pH 8.0时活性最高,在酸性条件下(pH 3.0~7.0)胞外核酸酶的活性较弱,这说明肠炎沙门菌胞外分泌蛋白中可能不存在酸性核酸酶或者含量较少。大多数核酸酶的活性至少需要Ca2+和Mg2+离子活化[18]。本试验发现,Ca2+在低浓度时能促进胞外分泌蛋白的核酸酶活性,而超过0.1 mmol/L时则出现抑制胞外分泌蛋白的核酸酶活性现象;而Mg2+则在高浓度时能促进胞外分泌蛋白的核酸酶活性,这说明该胞外核酸酶依赖Ca2+和Mg2+离子的活化,但对其依赖的浓度不同。本试验还发现,无论低浓度还是高浓度的Na+和K+都不能促进肠炎沙门菌胞外分泌蛋白的核酸酶活性;Co2+、Cu2+、Mg2+、Ba2+和Fe3+五种金属离在高浓度时促进胞外分泌蛋白的核酸酶活性;而Ni2+、Zn2+和Mn2+三种金属离子则是在低浓度时促进胞外分泌蛋白的核酸酶活性,试验结果充分说明了该胞外核酸酶具有金属离子选择依赖性,还能表明肠炎沙门菌胞外分泌蛋白可能存在不止一种具有活性的核酸酶。
对于致病菌来说,胞外核酸酶不仅可以影响生物被膜上DNA的含量,提供补救合成核苷酸的原料,还有可能参与致病菌对抗宿主的免疫应答[19-21]。在生物膜形成过程中,这些核酸酶通过诱导生物膜扩散以控制生物膜的形成[22],但是其潜在的分子和调控机制仍不为人所知,有待进一步阐明。有趣的是,Heun等[11]在研究中发现,希瓦氏菌的胞外核酸酶在生物膜形成过程中并没有发挥重要作用,这充分地说明了不同的核酸酶具有不同的功能。本试验证实了肠炎沙门菌胞外分泌蛋白的核酸酶活性,但从核酸酶的部分酶学特性来看,该胞外分泌蛋白中可能含有多种核酸酶。所以,肠炎沙门菌胞外核酸酶是否与肠炎沙门菌生物被膜的形成存在联系,有待以后继续探究。在对抗宿主的免疫应答方面,胞外核酸酶的另一个重要功能是防御中性粒细胞胞外诱捕网(NETs),降解胞外诱捕网(ETs)中的DNA骨架,从而进行逃逸。研究发现,普氏菌[23]、化脓性链球菌[15]、分支结核杆菌[24]和金黄色葡萄球菌[25]等细菌所产生的胞外核酸酶能够降解破坏ETs,对病原菌具有明显的保护作用。另外,有研究发现,某些寄生虫分泌的胞外核酸酶也有破坏ETs的作用[26-27],肠炎沙门菌是否也是通过分泌核酸酶的途径逃避先天性免疫防御也是今后深入研究的一个方向。

