肠内营养联合同步放化疗对局部晚期宫颈癌患者营养状况与免疫功能的影响
郑 侠,张 璐,张兰胜
(徐州医科大学第二附属医院放疗科,江苏 徐州 221006)
宫颈癌是一种位于子宫颈的恶性肿瘤,在妇科肿瘤中较为常见,多发于围绝经期妇女和更年期女性。临床多采用手术切除的方式治疗肿瘤性疾病,但疾病一旦发展为晚期,应以缩小肿瘤体积,延长患者生存时间为主要治疗原则,放化疗可通过放射同位素产生的α、β等各类射线照射与化学治疗药物杀灭或消除癌细胞,但在放化疗过程中患者易出现因放疗引起的放射性肠炎、腹泻及化疗导致的食欲减退、恶心呕吐等消化道反应,同时常规营养中的营养素不够全面,易造成机体免疫功能缺陷,最终导致患者营养不良、抵抗力严重下降,影响治疗效果与患者预后[1]。因此放化疗中辅以肠内营养治疗,维持与改善患者的营养状态至关重要,肠内营养粉剂中含有大量的脂肪和蛋白质等营养物质,且已有研究显示,肠内营养制剂对于提高食管癌肿瘤患者的营养状态具有重要意义[2]。基于此,本研究探讨了肠内营养联合同步放化疗对局部晚期宫颈癌患者营养状况、CD4+、CD8+百分比及CD4+/CD8+比值的影响,现将研究结果报道如下。
1 资料与方法
1.1 一般资料按照随机数字表法将徐州医科大学第二附属医院2017年3月至2021年3月局部晚期宫颈癌患者62例分为两组,各31例。对照组患者年龄26~68岁,平均(50.25±1.20)岁;体质量47~69 kg,平均(52.18±1.12) kg;病理类型:鳞癌30例,腺癌1例。研究组患者年龄28~66岁,平均(50.78±2.18)岁;体质量49~68 kg,平均(51.89±1.43) kg;病理类型:鳞癌30例,腺癌1例。两组患者一般资料相比,差异无统计学意义(P>0.05),组间具有可比性。纳入标准:符合《妇产科疾病诊疗指南》[3]中局部晚期宫颈癌的相关诊断标准且经临床检查确诊者;病理类型明确,且疾病发展为Ⅱ B~Ⅳ a者;一般状况良好,体力状况评分(PS)[4]为0~1分者等。排除标准:合并意识障碍或精神类疾病不能配合治疗者;合并有心、肝、肾等其他器官严重疾病者;同时患有其他肿瘤者等。本研究经院内医学伦理委员会批准,所有患者及其家属均签署知情同意书。
1.2 治疗方法予以对照组患者同步放化疗治疗,具体治疗方式如下:所有患者均实施强调放疗(IMRT),首先采用医用直线加速器Linear Accelarator进行盆腔外照射放疗,5 040 cGy/28 次,5次/周,治疗5 d后休息2 d继续治疗;腔内放疗应用192铱三维后装近距离放疗,单次剂量为 600 cGy,共 3 000~3 600 cGy/5~6 次,1 次 /周,在治疗当日暂停盆腔外照射治疗。在化疗周期第1天予以静脉滴注紫杉醇注射液(扬子江药业集团有限公司,国药准字H20053001,规格:5 mL∶30 mg)135~175 mg/m2,治疗第1~2天同时联合顺铂注射液(江苏豪森药业集团有限公司,国药准字H20040813,规格:6 mL∶30 mg)静脉注射,40 mg/m2,以21 d为1个周期。治疗期间同时给予一般膳食指导,如适当多摄入蛋白质类食物等。研究组患者患者在对照组的基础上,于放化疗1周前实施肠内营养治疗,具体治疗方式如下:患者进食困难或轻度轻度进食困难给予普通饮食,进食量减去正常食量的1/3,予以温冷水冲服肠内营养粉剂(TP)(ABBOTT LABORATORIES B.V.,注册证号 H20181147,规格:400 g/罐)15 kcal/(kg·d)(1 kcal=4.186 kJ),1次/d;中度进食困难者,进食量减去正常食量的 1/3~2/3,予以肠内营养粉剂 20 kcal/(kg·d),1次/d;重度进食困难者,进食量减去正常食量的2/3,并予以肠内营养粉剂25 kcal/(kg·d),1次/d,治疗期间应根据患者具体体质量与营养状况的变化及时调整肠内营养给予方案。两组患者均连续治疗2个周期。
1.3 观察指标①近期疗效。根据《实体瘤治疗疗效评价标准:RECIST》[5]判断两组患者治疗后临床疗效,完全缓解(CR):所有病灶全部消失且没有新病灶出现,并维持4周;部分缓解(PR):肿瘤最大直径总和缩小≥ 30%,并维持4周;疾病稳定(SD):肿瘤最大直径缩小但未达到PR,或肿瘤最大直径增大未达到PD。疾病恶化(PD):出现新病灶或肿瘤最大直径增大≥ 20%;并计算客观缓解率(ORR)=(CR+PR)例数/总例数×100%。②营养指标。采集两组患者治疗前后空腹静脉血5 mL,以3 000 r/min的转速离心15 min取上层血清,采用全自动生化分析仪检测血红蛋白(Hb)、白蛋白(ALB)及前白蛋白(PA)水平。③营养达标率。采用主观全面评定法(PG-SGA)[6]评估两组患者的营养状况,该量表分为3个等级,0~1分表示营养良好,为A级;2~8分表示中度或可疑营养不良,为B级; ≥ 9分表示重度营养不良,为C级。营养达标率=(A级+B级)例数/总例数×100%。④免疫功能。血液采集方式同②,采用流式细胞仪检测CD4+、CD8+百分比,并计算CD4+/CD8+比值。④不良反应。比较两组患者治疗期间国际肿瘤化疗药物不良反应评价系统分级≥Ⅲ级[7]的不良反应发生情况,包括骨髓抑制、恶心、呕吐、腹痛、腹泻等。
1.4 统计学方法应用SPSS 24.0统计软件分析数据,计量与计数资料分别以 (±s)、[例 (%)]表示,分别采用t、χ2检验比较。以P< 0.05为差异有统计学意义。
2 结果
2.1 近期疗效研究组患者的ORR为74.19%,高于对照组的64.52%,但经比较,差异无统计学意义(P>0.05),见表1。
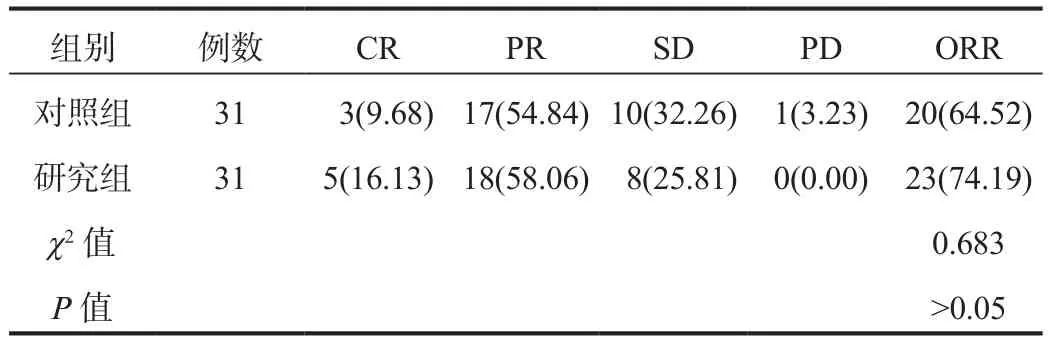
表1 两组患者近期疗效比较[例(%)]
2.2 营养指标与治疗前比,治疗后两组患者血清Hb、ALB、PA水平均显著降低,但观察组显著高于对照组,差异均有统计学意义(均P<0.05),见表2。
表2 两组患者营养指标比较( ±s)
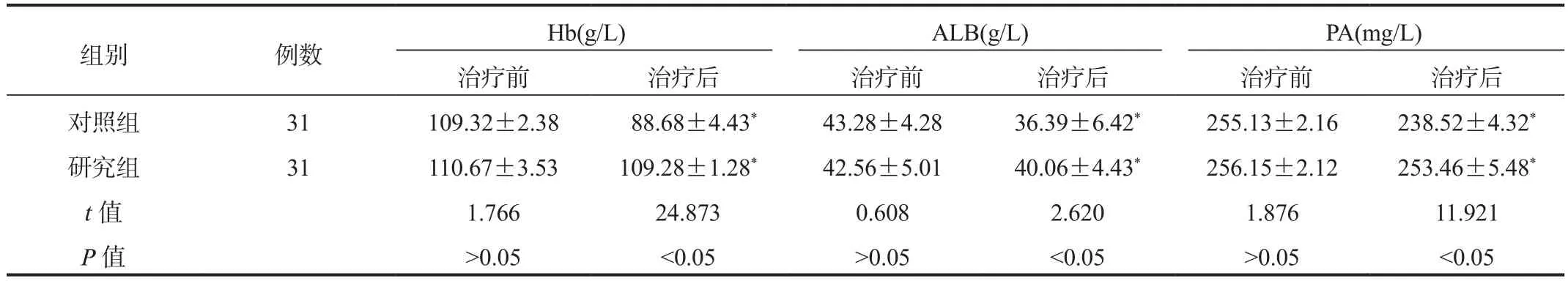
表2 两组患者营养指标比较( ±s)
注:与治疗前比,*P < 0.05。Hb:血红蛋白;ALB:白蛋白;PA:前白蛋白。
组别 例数 Hb(g/L) ALB(g/L) PA(mg/L)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 31 109.32±2.38 88.68±4.43* 43.28±4.28 36.39±6.42* 255.13±2.16 238.52±4.32*研究组 31 110.67±3.53 109.28±1.28* 42.56±5.01 40.06±4.43* 256.15±2.12 253.46±5.48*t值 1.766 24.873 0.608 2.620 1.876 11.921 P值 >0.05 <0.05 >0.05 <0.05 >0.05 <0.05
2.3 营养达标率治疗后,研究组患者的营养达标率为90.32%,显著高于对照组的67.74%,差异有统计学意义(P<0.05),见表3。
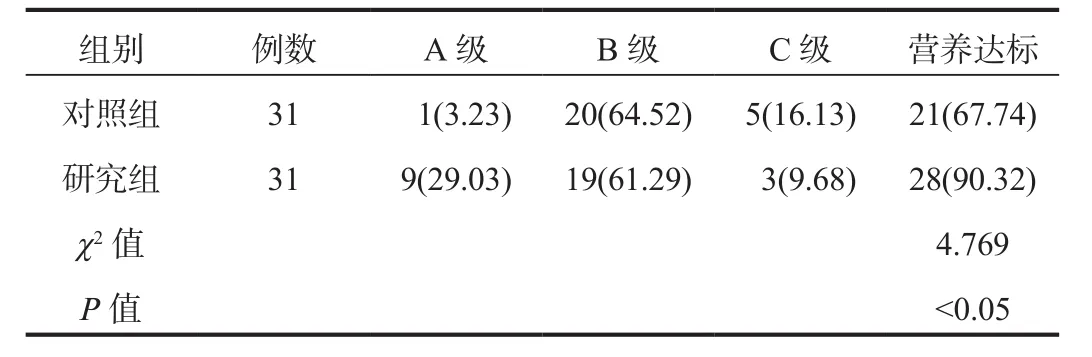
表3 两组患者营养达标率比较[例(%)]
2.4 免疫功能与治疗前比,治疗后研究组患者CD4+百分比与CD4+/CD8+比值均显著升高,而对照组均显著降低,且研究组显著高于对照组;研究组患者CD8+百分比显著降低,而对照组显著升高,且研究组显著低于对照组,差异均有统计学意义(均P<0.05),见表4。
表4 两组患者免疫功能比较( ±s)
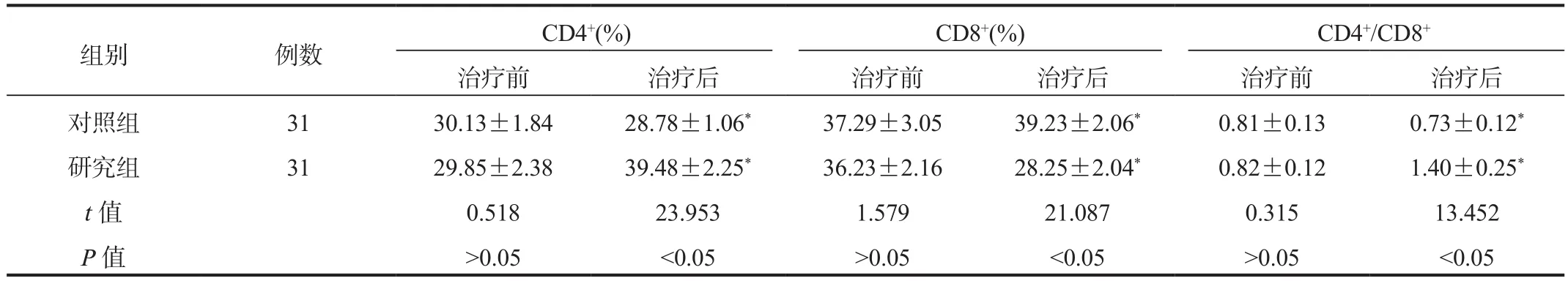
表4 两组患者免疫功能比较( ±s)
组别 例数 CD4+(%) CD8+(%) CD4+/CD8+治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 31 30.13±1.84 28.78±1.06* 37.29±3.05 39.23±2.06* 0.81±0.13 0.73±0.12*研究组 31 29.85±2.38 39.48±2.25* 36.23±2.16 28.25±2.04* 0.82±0.12 1.40±0.25*t值 0.518 23.953 1.579 21.087 0.315 13.452 P值 >0.05 <0.05 >0.05 <0.05 >0.05 <0.05
2.5 不良反应治疗期间,研究组患者国际肿瘤化疗药物不良反应评价系统分级≥Ⅲ级的骨髓抑制、腹痛及腹泻的发生率均显著低于对照组,差异均有统计学意义(P<0.05);而两组患者恶心与呕吐的发生率经比较,差异无统计学意义(P>0.05),见表5。
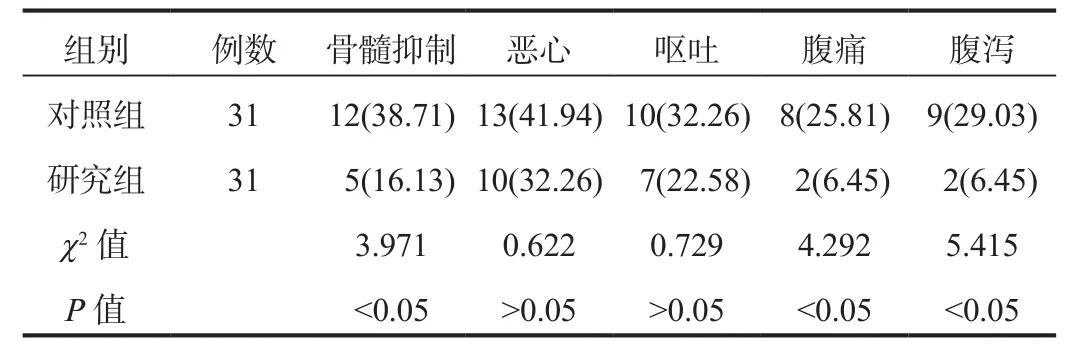
表5 两组患者不良反应比较[例(%)]
3 讨论
目前临床对宫颈癌的发病机制尚无明确性认识,多认为与人乳头瘤病毒(HPV)感染有关,主要发生于有多个性伴侣与性生活、生育较早、多产的妇女。局部晚期宫颈癌的治疗以提升患者的生存质量与为主,其中放化疗可通过局部各类射线照射与药物有效消灭癌细胞,但这两种治疗方式带给患者的不良反应较多,且因疾病本身导致的阴道不规则出血可致使患者发生贫血、食欲低下等,长期的营养缺乏严重影响了疾病的治疗效果,因此,改善宫颈癌患者的营养状况至关重要[8]。
肠内营养是经胃肠道提供代谢需要的营养物质及其他各种营养素的营养支持方式。本研究中应用的肠内营养粉剂以整蛋白为氮源,以蔗糖和淀粉为糖原,属于低渗性肠内营养制剂,应用不良反应少,安全性高。近年来,临床多认为,肿瘤患者的营养状况与疾病的预后密切相关,营养状况不良可使患者体质量下降,进而导致放疗摆位出现误差,影响放疗的精确度。在营养指标中,血清Hb、ALB、PA水平有着重要的检测意义,因放化疗治疗半衰期的不同,其反映营养指标的敏感程度也不一致,因此三者结合一同评估患者的营养状况更为准确[9]。PG-SGA评分是为肿瘤患者设计的肿瘤特异性营养评估工具,同时也是公认的肿瘤患者营养评估首选方法,目前已经广泛应用于临床,其由患者自我评估与医护人员评估两部分组成。本研究结果显示,治疗后,两组患者各项营养指标均显著降低,但研究组显著高于对照组,且营养总达标率显著高于对照组,同时近期疗效也较对照组有所提升,但差异无统计学意义,提示肠内营养联合同步放化疗可提升局部晚期宫颈癌患者的治疗效果,改善营养状况。
肠内营养粉剂(TP)中含大量维生素、蛋白质及脂肪等营养物质,经肠内给药的治疗方式可有效预防癌症晚期患者机体营养的大量消耗,稳定患者的营养状况,提升生活质量。研究表明,晚期癌症患者的体质量均有不同程度的降低,并伴有贫血,及时给予营养支持,可有效改善机体的营养状况与贫血症状,有利于患者的预后[10]。
临床认为,机体的抗肿瘤免疫以细胞免疫为主,通过T淋巴细胞亚群的检测可了解不同治疗方法治疗前后患者两种机能状态下的T细胞数目,如CD4+、CD8+百分比与CD4+/CD8+比值等,可以初步了解患者的免疫状态与治疗效果,若患者CD4+T淋巴细胞呈进行性或不规则性减少,CD8+细胞比率升高,则提示机体免疫系统受到严重损害[11]。本研究中,与治疗前比,治疗后研究组患者CD4+百分比与CD4+/CD8+比值均显著升高,而对照组均显著降低,且研究组显著高于对照组;研究组患者CD8+百分比显著降低,而对照组显著升高,且研究组显著低于对照组,提示同步放化疗对患者免疫功能具有一定的损害作用,但联合肠内营养可在一定程度上改善和预防患者进一步的机体免疫能力下降。这可能与肠内营养粉剂中含有的免疫营养素单不饱和脂肪酸,如ω-3脂肪酸或核苷酸等物质相关,这些营养素均可直接提高机体免疫能力,对肿瘤的预后有一定的改善作用[12]。但是本次研究中未检测患者B细胞与自然杀伤细胞(NK)等指标情况,这需要在后续的治疗过程中对患者进行动态监测与随访,以获得更多治疗数据,加以印证。
局部晚期宫颈癌患者由于放射治疗治疗和化疗药物的刺激会产生较多的不良反应,加之放疗部位位于下腹部,因放疗部位的特殊,其发生营养不良的可能性更高,进而影响饮食,出现营养状况低下、免疫力下降等,加重放化疗的不良反应,因此保证患者摄入营养的均衡是提高免疫力的重要方法。肠内营养针对不同临床特征的患者给予相对应的营养支持,保证了每位患者都能摄入科学的营养且不过量,有效提高放化疗治疗的耐受性,且肠内营养粉剂(TP)的渗透压较低,对胃肠道的影响较小,可减少因营养与免疫力低下等状况引起的不良反应[13]。本研究中,研究组患者的不良反应总发生率显著低于对照组,提示肠内营养联合同步放化疗治疗局部晚期宫颈癌可提高患者的耐受性,减少不良反应的发生。但是,临床进行营养支持治疗时也需要认识到,有效的营养供给需要多管齐下,规范的营养支持是基础,机体内在免疫调节功能的改善才是根本。
综上,肠内营养联合同步放化疗治疗局部晚期宫颈癌可有效改善患者的营养状况,提升机体免疫功能,减少不良反应的发生,提升近期治疗效果,但本研究观察周期短,缺乏远期疗效评估,因此仍需临床开展进一步深入研究。

