630 nm LED照射阻滞STAT1核转位抑制M1型巨噬细胞极化
潘 越,宋武琦,张凤民,刘海亮
(哈尔滨医科大学医学微生物学教研室,哈尔滨医科大学伍连德研究所,哈尔滨 150081)
关键字:发光二极管;M1型巨噬细胞极化;单核细胞;STAT1;核转位
巨噬细胞(macrophage)作为天然免疫中最有效的细胞类型之一,可以调节宿主防御和体内炎症反应平衡[1]。其具有强大的细胞吞噬、抗原呈递和分泌细胞因子的能力,可控制先天性免疫和适应性免疫的起始和消退[2]。针对不同的局部微环境,静息巨噬细胞(M0型)可以极化为经典活化型巨噬细胞(M1型)和替代活化型巨噬细胞(M2型)[3]。M1型巨噬细胞是抵抗细胞内病原体和抑制肿瘤生长的关键效应细胞,M2型巨噬细胞与免疫抑制、促进组织重塑和肿瘤进展有关[4-6]。M1/M2型巨噬细胞比例的精确调节可以改变组织内的微环境,在自身免疫性疾病、慢性炎症性疾病和肿瘤中发挥重要作用,并且对疾病的预后及转归起关键性作用。调控巨噬细胞极化是药物治疗的重要手段,因此调控巨噬细胞极化的分子可作为治疗巨噬细胞极化相关疾病的重要靶点[7]。许多转录因子在调控巨噬细胞极化中起重要作用,如干扰素调节因子(interferon regulatory factor,IRF)、核转录因子-κB(nuclear transcription factor,NF-κB)、信号转导和转录激活因子(signal transducer and activator of transcription,STAT)等[8]。Jiang等[9]报道了T细胞 Ig黏蛋白3(T cell Ig mucin-3 ,TIM-3)可通过Y256和Y263残基与 JAK竞争结合STAT1,抑制STAT1的磷酸化和核转位,从而抑制巨噬细胞中的STAT1-miR-155信号轴,促进巨噬细胞极化为 M2 表型。Ding等[10]发现,酸枣仁甙D能抑制STAT1的激活和核转位,同时增强STAT6的核转位,促进巨噬细胞向M2型转化,从而调节巨噬细胞M1/M2极化。这些研究发现了STAT1 在调控巨噬细胞极化中起关键作用,为治疗相关疾病提供了科学有效的解决方案。
光生物调节(photobiomodulation,PBM)是一个发展较快的生物医学研究领域,如使用低功率密度的红光或近红外光能对细胞或组织产生有益影响[11]。与传统的激光光源疗法相比,发光二极管(light-emitting diode,LED)光疗法的优势在于可以提供大型平面阵列照射大面积身体区域[12]。除此之外,LED与激光相比还具有发光波长涵盖范围广、光转换效率高、可以以脉冲的形式输出、操作便利、使用成本低、安全、可靠、适宜进行专用的医学设计等优点。鉴于这些特点,LED在医疗应用和光生物调节中得到了迅速发展。LED光疗已被证实在多种临床适应症中均有效,如减轻疼痛、促进伤口愈合、嫩肤、缓解过敏性鼻炎等[12]。Cheong等[13]报道了850 nm LED照射能够抑制T细胞诱导的细胞因子表达。Kim等[14]证明了633 nm LED照射会增加I型前胶原的合成,并降低皮肤成纤维细胞中基质金属蛋白酶的表达。本课题组前期研究结果证实,630 nm LED照射可能通过TRPV4/PI3K/AKT/mTOR信号通路抑制人滑膜细胞的增殖[15],同时,630 nm LED照射能抑制巨噬细胞产生促炎症因子,从而发挥抗炎作用[16]。然而,630 nm LED照射对于巨噬细胞极化的作用及其机制尚未报道,故本研究对630 nm LED照射对人髓系白血病单核细胞(human acute monocytic leukemia,THP-1)来源的M1型巨噬细胞极化的影响进行评价,探讨其对M1型巨噬细胞极化的作用机制。
1 材料与方法
1.1 细胞培养及630 nm LED照射处理
将THP-1培养在含有10%胎牛血清(fetal bovine serum,FBS,Gibco,USA)、100 U/mL青霉素和100 mg/mL链霉素的RPMI-1640培养基(Gibco,USA)中,于37℃、5% CO2孵箱中培养。THP-1细胞于100 nmol/L佛波酯(phorbol myristate acetate,PMA,Solaribio,中国北京)中孵育24.0 h,将其分化为巨噬细胞(M0型),更换无血清培养基继续培养24.0 h。用20 ng/mL干扰素-γ(interferon-γ,IFN-γ,peprotech,USA)和100 ng/mL 脂多糖(lipopolysaccharide,LPS,Sigma,USA)刺激M0型巨噬细胞18.0 h,使其极化为M1型。LED照射组在诱导极化的第14小时对细胞进行630 nm LED照射,每2.0 h照射1次,每次10 min,共照射3次。本研究使用的630 nm LED 照射灯板由北京创盈光电科技有限公司研制。
1.2 细胞活性测定(MTT、CCK-8、LDH)
THP-1细胞以1×104个/孔接种在96孔板中,根据试验条件培养细胞和LED照射处理后,在每孔中加入20 μL 4 mg/mL的噻唑蓝(methyl thiazolyl tetrazolium,MTT)溶液,37℃孵育3.5 h后弃掉培养基,每孔中加入200 μL二甲基亚砜(dimethyl sulfoxide,DMSO)37℃ 孵育30 min,在波长为570 nm处测量吸光度。细胞计数试剂盒(cell counting kit-8,CCK-8)检测细胞活性,每孔中加入10 μL CCK-8溶液,37℃孵育4.0 h,在波长为450 nm处测量吸光度。乳酸脱氢酶(lactic dehydrogenase,LDH)活性检测参照试剂盒说明书操作(Solarbio, 中国北京),在波长为450 nm处测量吸光度。
1.3 实时荧光定量PCR(RT-qPCR)
收集照射后的细胞,用Trizol法(Invitrogen,USA)提取细胞的总RNA,用HiFiScript cDNA第一链合成试剂盒(康为世纪,中国)逆转录2 μg总RNA,反应体系和反应程序参照试剂盒说明书。用ChamQ Universal SYBR qPCR Mix(诺唯赞生物,中国)和引物(10 μmol/L,库美生物,中国)进行扩增反应。以β-actin为参照基因进行归一化,采用阈值循环法计算目的基因的表达量。实时荧光定量PCR(real-time quantitative PCR,RT-qPCR)试验数据中各基因在各样本组细胞中的表达量用循环阈值(cycle threshold,Ct)表示,采用 2-ΔΔCT法表示 LED 照射组与对照组目的基因mRNA的相对表达量,引物序列如表1。
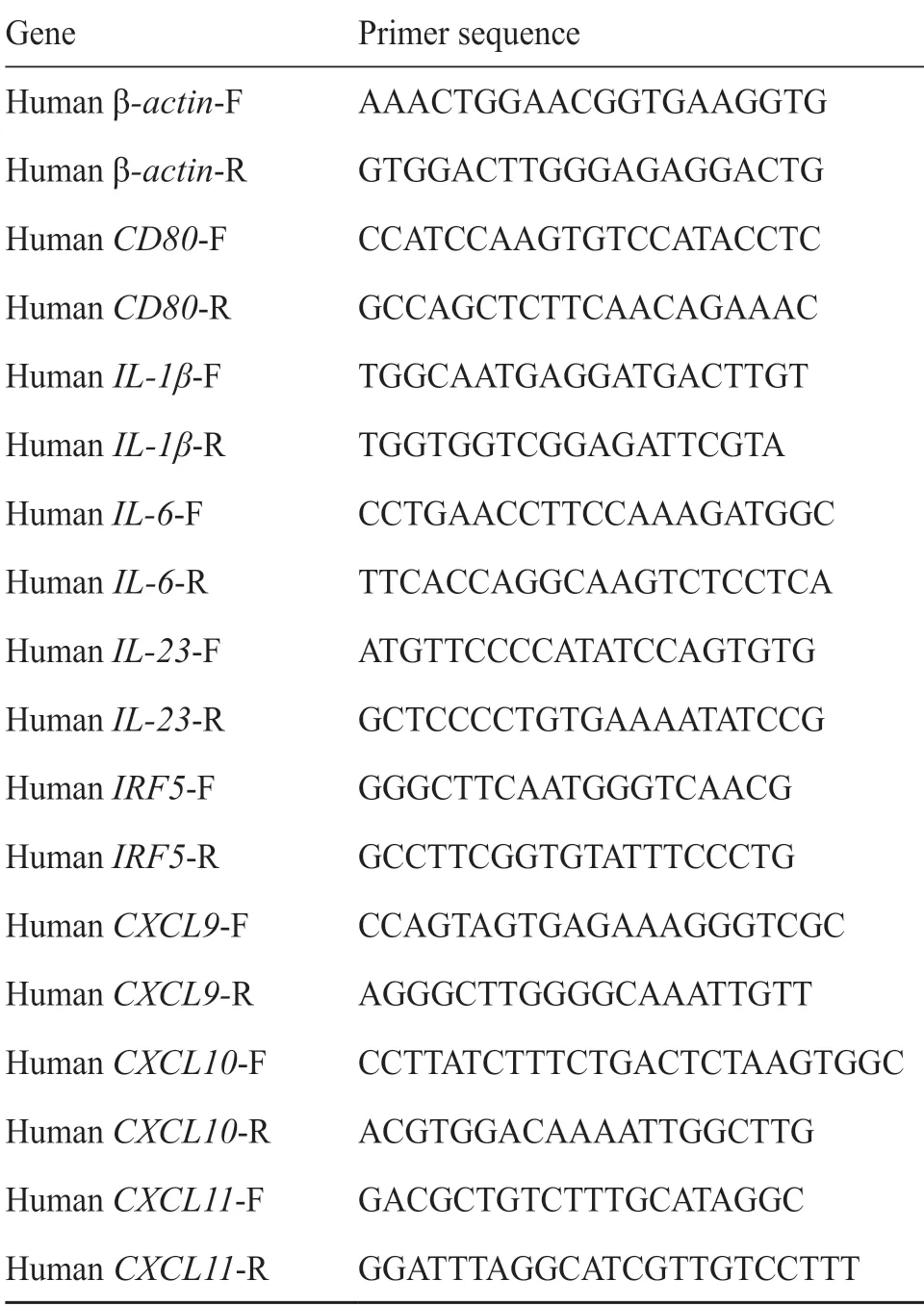
表1 RT-qPCR引物序列Tab.1 The primer sequences of RT-qPCR
1.4 蛋白质提取和免疫印迹分析
收集照射后的细胞,用细胞核浆蛋白提取试剂盒(Solarbio,中国)分离细胞核和浆蛋白。用BCA蛋白浓度测定试剂盒(Beyotime,中国)进行蛋白浓度测定后,将样品置于10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)凝胶上分离,然后转移到聚偏氟乙烯(polyvinylidene fluoride,PVDF)上转膜(300 mA 恒流,1.5 h),5%脱脂牛奶封闭1.0 h,抗体4℃过夜。主要抗体为STAT1(Cell Signal Technology,USA)、Histone H3(Cell Signal Technology,USA)、GAPDH(Cell Signal Technology,USA),抗体稀释倍数均为1∶1 000,一抗孵育后用Tris-HCl缓冲液(Tris-buffered saline tween,TBST)洗膜3次,辣根过氧化物酶标记的二抗室温孵育1.0 h,TBST洗膜3次后加入电化学发光(electrochemiluminescence,ECL)试剂显色(Affinity,中国),进行凝胶显影成像。
1.5 细胞免疫荧光
试验前准备封闭缓冲液(1×PBS/5% BSA/0.3%Triton X-100)和抗体稀释缓冲液(1×PBS/1%BSA/0.3% Triton X-100)。细胞经LED照射处理后,用预冷的4%多聚甲醛固定15 min,PBS清洗3次,在封闭缓冲液中封闭1.0 h,吸去封闭缓冲液,加入用抗体稀释缓冲液稀释的一抗STAT1(1:200),4℃孵育过夜。用PBS 漂洗3次,用抗体稀释缓冲液稀释荧光二抗(1∶100,FITC Goat Anti-Rabbit IgG,ABclonal,中国),室温下避光孵育标本1.0 h,PBS 漂洗3次,用4,6-二脒基-2-苯基吲哚(4,6-diamidino-2-phenylindole, DAPI)染核10 min,PBS漂洗3次后用含抗荧光淬灭剂的封片液封片,在荧光显微镜下观察并采集图像。
1.6 统计分析
2 结果与分析
2.1 630 nm LED照射对THP-1来源的M1型巨噬细胞活性的影响
为确定630 nm LED照射对于THP-1来源的M1型巨噬细胞活性的影响,我们分别采用CCK-8、MTT、LDH法对细胞活性进行测定。图1a为试验照射过程。图1b~1d结果显示,与对照组相比,630 nm LED照射(40.02 mW/cm2)对细胞活性无显著影响[所有试验重复3次,结果以均数±标准误(n=3)表示]。因此,在不影响巨噬细胞活性的条件下,后续试验均采用此照射条件探讨LED对巨噬细胞极化的作用。
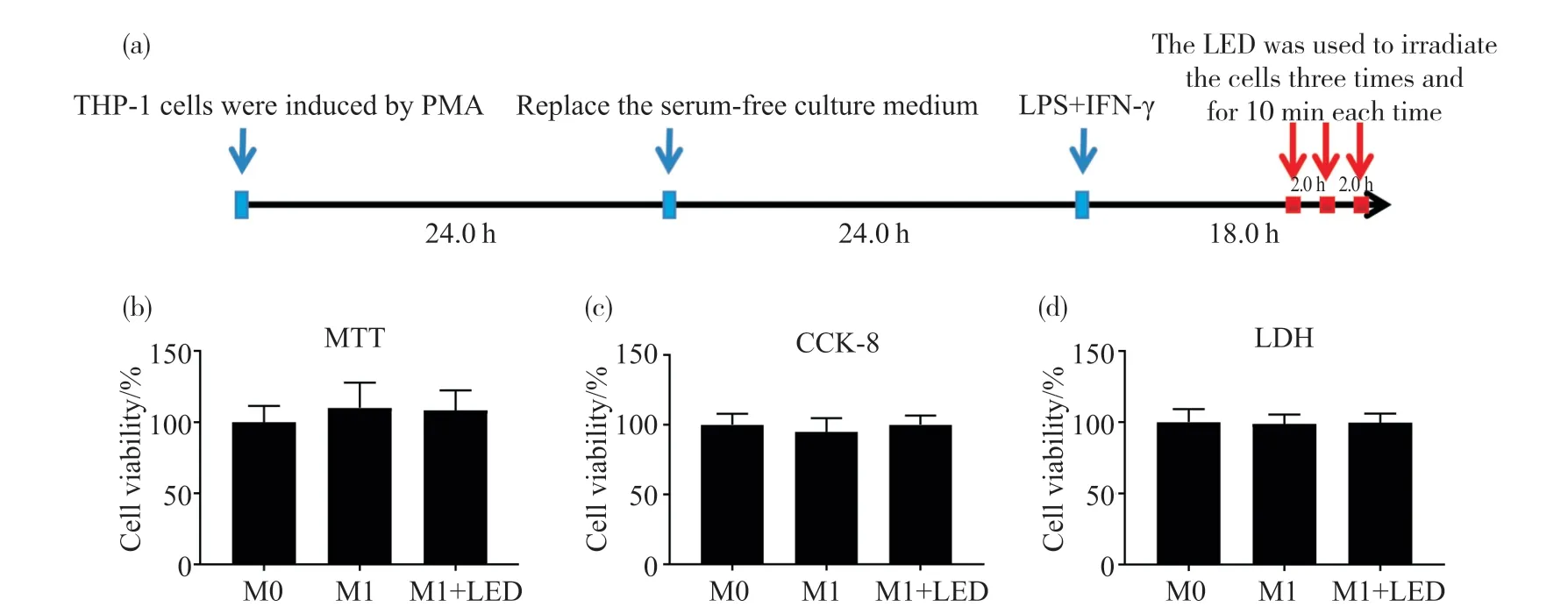
图1 630 nm LED照射对THP-1来源的M1型巨噬细胞活性的影响Fig.1 Effects of 630 nm LED on THP-1-derived M1 macrophages viability
2.2 630 nm LED照射抑制M1型巨噬细胞相关因子的mRNA表达
RT-qPCR法检测630 nm LED照射对M1型巨噬细胞相关基因表达的影响。图2结果显示,M1组的CD80、白介素6(interleukin 6,IL-6)、白介素23(Interleukin 23,IL-23)、干扰素调节因子5(interferon regulatory factor 5,IRF5)、趋化因子配体9(C-X-C motif chemokine ligand ,CXCL9)、CXCL10、CXCL11明显高于M0组,表明M0巨噬细胞经LPS和干扰素作用18.0 h后已极化为M1型巨噬细胞(****P<0.000 1)。图2a~2d显示,LED照射处理组中CD80、白介素1β(interleukin 1,IL-1β)、IL-6、IL-23的 mRNA表达与对照组相比无统计学意义(P>0.05)。图2e~2h结果显示,LED照射处理组中IRF5、CXCL9、CXCL10、CXCL11mRNA的表达较M1对照组显著降低(*P<0.05,**P<0.01)。结果表明,630 nm LED照射可抑制M1型巨噬细胞的极化。
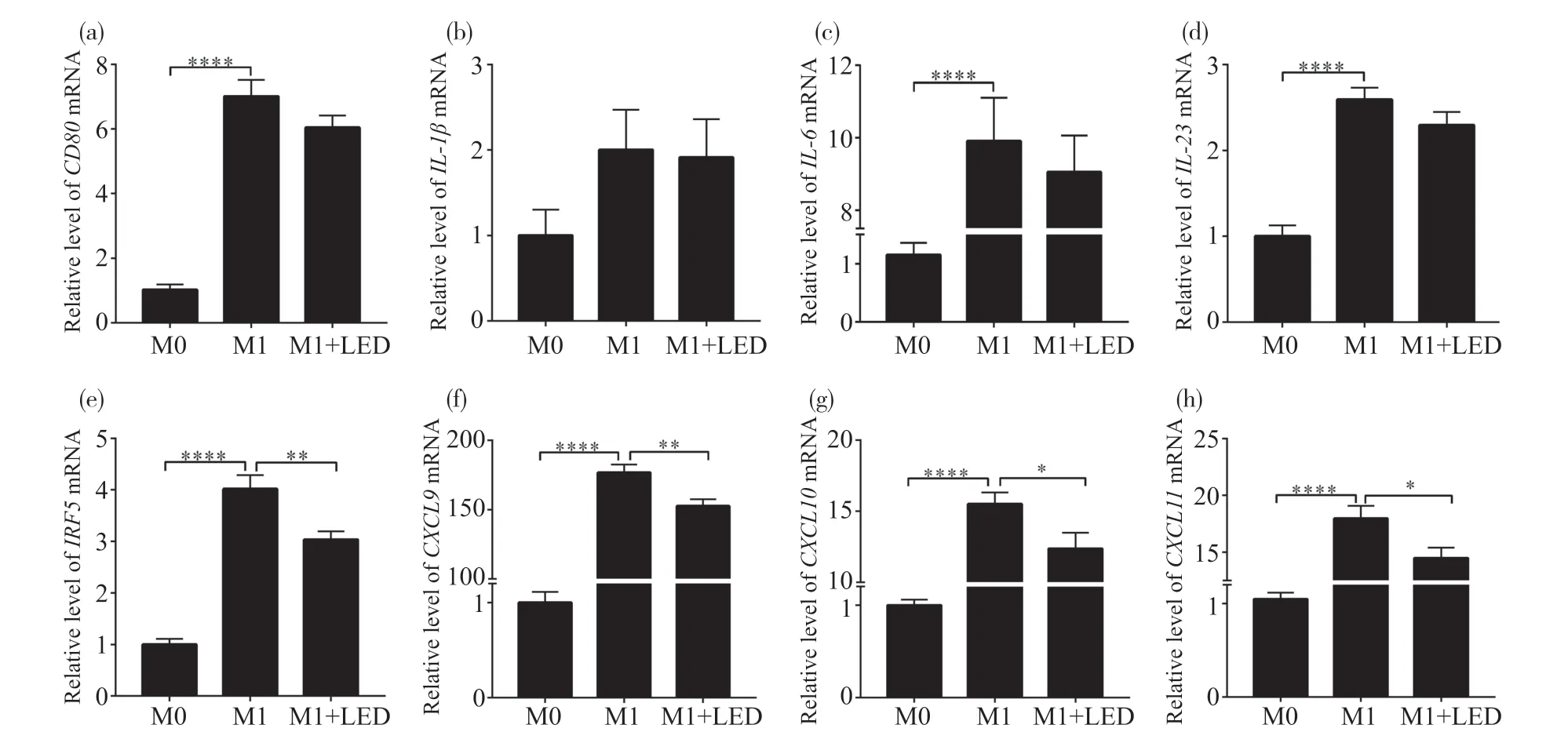
图2 630 nm LED照射抑制M1型巨噬细胞相关基因mRNA的表达Fig.2 630 nm LED irradiation inhibits M1 macrophage-related mRNA expression
2.3 630 nm LED照射抑制M1型巨噬细胞核蛋白中STAT1蛋白的表达
在巨噬细胞中,STAT1转位至细胞核,从而与DNA结合促进巨噬细胞向M1型极化。本研究从M0、M1、M1+LED三组细胞中提取总蛋白,用免疫印迹法检测巨噬细胞总STAT1的蛋白水平。如图3a所示,M1组与M0组相比,巨噬细胞总蛋白中STAT1水平升高,而照射处理组与M1组STAT1没有显著差异(**P<0.01)。将三组细胞进行核浆蛋白分离,以GAPDH和Histone分别作为浆蛋白和核蛋白的内参,用免疫印迹法进一步检测M1型巨噬细胞核浆蛋白中STAT1的表达水平。如图3b所示,M1组巨噬细胞核蛋白中的STAT1较M0组其相对表达量明显升高,而经630 nm LED照射处理后,核蛋白中STAT1的相对表达量降低(图3b中左侧的三组)(*P<0.05,***P<0.001)。在LED照射处理组中,浆蛋白STAT1的表达量与M1组相比无统计学意义(图3b中右侧的三组)。结果表明,630 nm LED光照不影响巨噬细胞总STAT1的表达水平,但可抑制巨噬细胞中STAT1向核内转移。
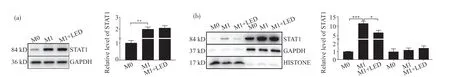
图3 630 nm LED照射抑制M1型巨噬细胞核蛋白中STAT1蛋白表达Fig.3 630 nm LED irradiation inhibits nuclear STAT1 expression in M1 macrophages
2.4 630 nm LED照射抑制M1型巨噬细胞中STAT1向核内转移
免疫荧光检测结果显示,未用LPS和IFN-γ刺激的M0组STAT1蛋白大部分表达在胞浆中,LPS和IFN-γ刺激后的M1型巨噬细胞STAT1 大部分入核,而经630 nm LED照射后STAT1入核减少(图4)。结果表明,630 nm LED照射可抑制M1型巨噬细胞中STAT1向核内转移。
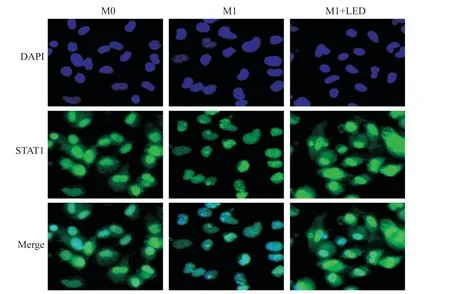
图4 630 nm LED照射抑制THP-1来源巨噬细胞的STAT1向核内转移Fig.4 630 nm LED irradiation inhibits the intranuclear transfer of STAT1 in THP-1-derived macrophages
3 讨论
LED光疗因为具有抗炎、镇痛和愈合伤口的作用,在临床实践中被广泛应用,将适当的 LED光疗法作为辅助手段与许多其他手术或非手术方法结合,可达到显著的治疗效果。有研究报道,945 nm LED可诱导IL-6和肿瘤坏死因子-α(tumor necrosis factor,TNF-α)的基因下调,转化生长因子(transforming growth factor,TGF)和精氨酸酶-1(arginase-1,ARG1)的基因上调,表明巨噬细胞极化为M2表型有助于组织修复和炎症消退[17]。另有研究报道,630 nm LED通过Nrf2和NF-κB信号通路抑制单核/巨噬细胞炎症和降低细胞内活性氧(reactive oxygen species,ROS)水平。因此,LED对于调节巨噬细胞有重要作用。
在本研究中,我们检测了630 nm LED对THP-1来源的M1型巨噬细胞活力的影响,结果表明,以40.02 mW/cm2的功率对THP-1来源的M1型巨噬细胞进行单次10 min(24 J/cm2)照射3次不影响其细胞活性。有报道指出,630 nm LED照射超过30.6 J/cm2后,THP-1细胞的存活能力下降[16]。可见选择正确波长、提供适当的光功率密度和足够的能量密度对于巨噬细胞极化以及相关疾病的治疗十分重要。
M1型巨噬细胞表达CD80、CD86等分子可通过分泌多种促炎症因子(如IL-6、IL-23、IL-1β和TNF-α等)以及趋化因子(CXCL9、CXCL10、CXCL11)促进炎症的发展,加速细胞外基质降解和细胞凋亡,调节并促进 Th1 型免疫应答[18]。IRF5作为干扰素调节因子(interferon regulatory factor,IRF)家族的成员具有多种功能,包括激活编码炎症细胞因子、I型干扰素(interferon type I,IFN-I)和肿瘤抑制因子的基因,已被定义为 M1 巨噬细胞极化的关键转录因子[19]。在本研究中,我们检测了M1型巨噬细胞的相关基因表达,发现经630 nm LED照射后,IRF5、CXCL9、CXCL10、CXCL11mRNA的相对表达较M1对照组显著降低。有研究报道,810 nm PBM 抑制了经典活化巨噬细胞的标志物,减少了促炎细胞因子包括TNF-α和IL-1βmRNA的表达和分泌,除此之外,PBM可显著降低经典激活的骨髓来源的巨噬细胞(bone marrow-derived macrophages,BMDM)中NF-κB p65的表达和磷酸化,表明PBM可以成功调节经典激活小鼠骨髓来源的巨噬细胞BMDM的炎症和极化[20]。与之前的研究一致的是,我们的数据也证明了630 nm LED照射对于M1型巨噬细胞极化具有显著的抑制作用。还有研究表明,780 nm和660 nm两种激光都能够减少TNF-α和诱导性一氧化氮合酶(inducible nitric oxide synthase,iNOS)的基因的表达,但660 nm 激光会导致IL-6表达和产生的上调[21],说明不同的光照参数对于细胞的调节效应不同。因此,选用正确的参数,如波长、功率密度、能量密度、照射频率、操作制度和连续照射之间的间隔,是实现预期结果的基础。
巨噬细胞极化受多种转录因子的影响,JAK激活的STAT蛋白家族成员是调控巨噬细胞 M1/M2 极化的关键转录因子[22]。通过刺激IFN-γ受体触发JAK介导的酪氨酸磷酸化和STAT1二聚化,STAT1以同源二聚体的形式迁移到细胞核,与编码iNOS、MHC II类反式激活因子(MHC class IItransactivator,CIITA)和IL-12等基因的启动子中的顺式元件γ激活序列结合,调节M1巨噬细胞的极化[23]。虽然LED疗法在临床上治疗疾病中的应用显著增多,但对光照射的作用机制,特别是红光照射对预防和治疗巨噬细胞极化相关疾病的作用机制研究较少。为了阐明其相关机制,我们研究了630 nm LED照射对于经典巨噬细胞极化的转录因子STAT1的影响。与对照组相比,M1+LED组巨噬细胞中总STAT1的相对表达量没有显著变化,但核蛋白中STAT1经照射处理后的相对表达量较M1组显著降低。与免疫印迹结果一致的是,细胞免疫荧光结果显示,630 nm照射处理后STAT1入核减少。抑制STAT1入核是调控巨噬细胞极化的重要因素。如TIM-3通过Y256和Y263残基与JAK 竞争结合STAT1,可抑制 STAT1 磷酸化和核转位,从而抑制巨噬细胞中的STAT1-miR-155信号轴,促进巨噬细胞极化为M2 表型[10]。新色胺S5通过降低促炎细胞因子、下调NF-κB和STAT1信号显著抑制M1样巨噬细胞的极化[24]。然而,巨噬细胞极化的机制复杂,630 nm LED调节巨噬细胞极化的其他分子机制还需进一步研究。本研究首次发现630 nm LED照射可通过抑制STAT1核转位对M1型巨噬细胞极化产生抑制作用,这一发现可能对治疗巨噬细胞极化相关疾病提供治疗策略。

