利用拉曼光谱对Ⅲ、Ⅳ级脑胶质瘤诊断和分级的研究
李燕雏,沈 兰,王 丹,李 平*
(1.四川大学华西医院头颈肿瘤科,成都 610041;2.重庆市江津区中心医院神经内科,重庆 402260)
拉曼光谱用于化学、物理学、生物学和医学等各领域,是物质组份鉴定的重要研究手段[1]。生物组织中,约90%的拉曼峰分布在Δν~为500~1 800 cm-1的区域内,10%分布在Δν~为2 700~3 300 cm-1的区域内[2]。既往研究已证实,拉曼光谱对于诊断Barrett食管上皮类瘤变和乳腺癌具有较好的特异性和敏感性[3-5]。
临床中,世界卫生组织(World Health Organization,WHO)Ⅲ、Ⅳ级脑胶质瘤属于高级别胶质瘤。患者预后差,术后须行脑部放疗、全身化疗或替莫唑胺等综合治疗。对于WHO Ⅲ级间变胶质瘤,患者中位生存期为3~4年,而WHO Ⅳ级脑胶质母细胞瘤的中位生存期仅14.6~17.0个月。因此,相较于Ⅲ级脑胶质瘤,Ⅳ级脑胶质瘤的恶性程度更高,患者总生存时间(overall survival,OS)更低。因此,准确鉴别诊断Ⅲ、Ⅳ级脑胶质瘤对判断患者预后及指导治疗具有重要意义。目前临床应用中,一方面,脑胶质瘤分级主要依靠术中冰冻及术后石蜡病理诊断,通过镜下观察肿瘤细胞的类型、细胞核分裂相、有无坏死组织、有无肿瘤血管生成和免疫组织化学综合分析得出WHO脑胶质瘤的分级[6],但基于光镜观察及免疫组织化学检查得出的脑胶质瘤分级诊断存在缺陷;另一方面,Ⅲ和Ⅳ级脑胶质瘤术中快速冰冻切片诊断的准确性和及时性是辅助判定手术切除范围的重要参考指标,继而可直接影响患者的预后。因此,需要更加敏感而准确的方法辅助确认脑胶质瘤的术中和术后分级。近年来,因拉曼光谱简便快速的特点,用于神经系统疾病的诊断研究逐步受到重视[7-9]。既往研究显示,利用拉曼光谱技术区分脑胶质瘤组织与正常组织具有可行性[10-11]。Senada等[12]和Christoph等[13]的研究显示,将胶质瘤活组织与坏死组织的拉曼谱带进行聚类分析,并结合病理诊断将聚类的光谱归类到活组织或者坏死组织这一分类模型的准确率可达100%,但其研究没有证明拉曼光谱能鉴别诊断Ⅲ和Ⅳ级脑胶质瘤。
本研究利用激光共聚焦拉曼光谱探讨正常脑组织与Ⅲ、Ⅳ级脑胶质瘤组织的差异,并探索Ⅲ、Ⅳ级脑胶质瘤的拉曼光谱鉴别诊断方法。
1 材料与方法
1.1 设备和标本测量
本研究纳入1例正常脑组织标本(病灶切缘周围正常组织)及13例Ⅲ、Ⅳ级脑胶质瘤组织标本(表1)。新鲜脑组织样本随脑胶质瘤手术取材于四川大学华西医院神经外科,未单独再次取材。所有标本离体后立即存入液氮,并于离体后48 h内制作冰冻切片(德国,Leica CM 1 950)。切片前使用预冷生理盐水清洗组织样本3次,冰冻切片厚度为25 μm,切片平整。冰冻切片制作后2 h内进行拉曼光谱检测。

表1 脑胶质瘤入组样本信息Tab.1 Information on the glioma samples
采用InVia显微聚焦拉曼光谱仪(英国,Renishaw公司)进行冰冻切片样本检测。在室温、暗光环境下,采用514 nm激光光源进行样本扫描,设定曝光时间为15 min,光谱分辨率大于0.65 cm-1,扫描能量为20.2 mW,放大倍率为1 000倍。扫面范围为400~4 000 cm-1的拉曼位移。样本测量前预处理石英载玻片,在分析中去除载玻片本底光谱的影响[14-16]。
1.2 特征峰分析及统计学方法
使用Origin 8.0软件(美国,OriginLab公司)进行拉曼谱线的绘制和分析。采用人工寻峰及Peak Analysis插件在基线拟合后与自动寻峰相结合的方法找出典型的拉曼特征峰进行比较。在人工寻峰及自动寻峰找出的拉曼特征性峰中对比正常脑组织、Ⅲ级脑胶质瘤、Ⅳ级脑胶质瘤组织的拉曼绝对峰位移、特征峰位移比值,并采用聚类分析等方法找出正常脑组织与脑胶质瘤组织之间拉曼位移的差别,同时分析Ⅲ、Ⅳ级胶质瘤的特征峰及其代表的分子键的变化,利用特征峰的位移判断脑胶质瘤的级别。经Origin分析后得出的特征峰数据采用GraphPad Prism 8.0(美国,GraphPad Software公司)进行统计分析,P值小于0.05具有统计学意义。
2 结果与分析
2.1 拉曼峰进行谱带指认
经病理分级证实的Ⅳ级脑胶质瘤样本有9例(样本1~9),占总例数的69.2%;Ⅲ级脑胶质瘤样本有4例(样本10~13),占总例数的30.8%。将所获得原始拉曼谱线进行平滑、去基线和识别拉曼峰及其峰位处理,并通过对比谱带数据库对拉曼峰进行谱带初步指认(表2)。
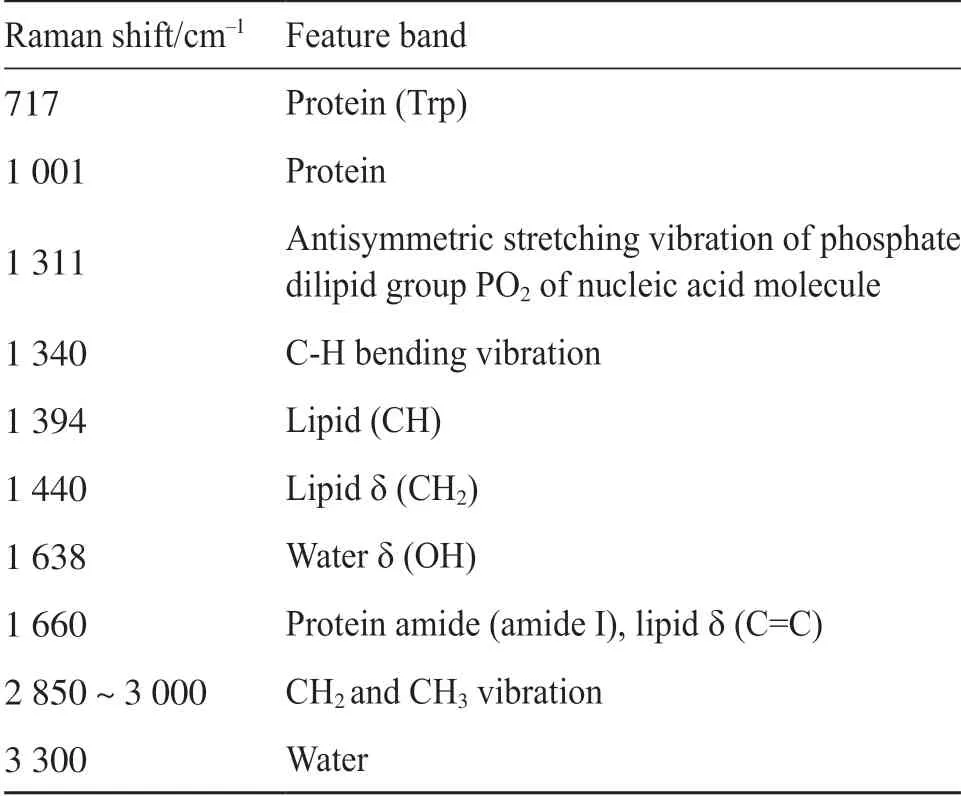
表2 脑胶质瘤冰冻切片拉曼谱带归属表Tab.2 Classification of Raman bands in frozen sections of glioma
2.2 正常脑组织特征拉曼光谱
经测量并结合数据库资料发现,正常脑组织在1 064、1 297、1 437、1 664、2 852、2 883和2 932 cm-1峰位处表现出典型的胆固醇键和脂键,在1 005 cm-1峰位处表现为苯基丙氨酸。此外,正常脑组织I2932与I2852、I2883处拉曼峰值的比值分别为:I2932/I2852=0.92±0.10、I2932/I2883=0.95±0.15,说明2 852和2 883 cm-1处峰值相对2 932 cm-1处峰值明显增高,这与脑胶质瘤组织在I2930/I2850=1.58±0.26(P=0.04*)、I2930/I2898=1.25±0.10(P=0.02*)处拉曼峰值比值存在显著差别(图1)。相较正常脑组织中在1 664 cm-1表现出的单峰,Ⅲ、Ⅳ级胶质瘤中其对应峰蓝移至1 660 cm-1峰处。通过谱带指认得出,肿瘤组织中1 660 cm-1处蛋白质键取代了正常脑组织中1 664 cm-1处的脂键(表3)。
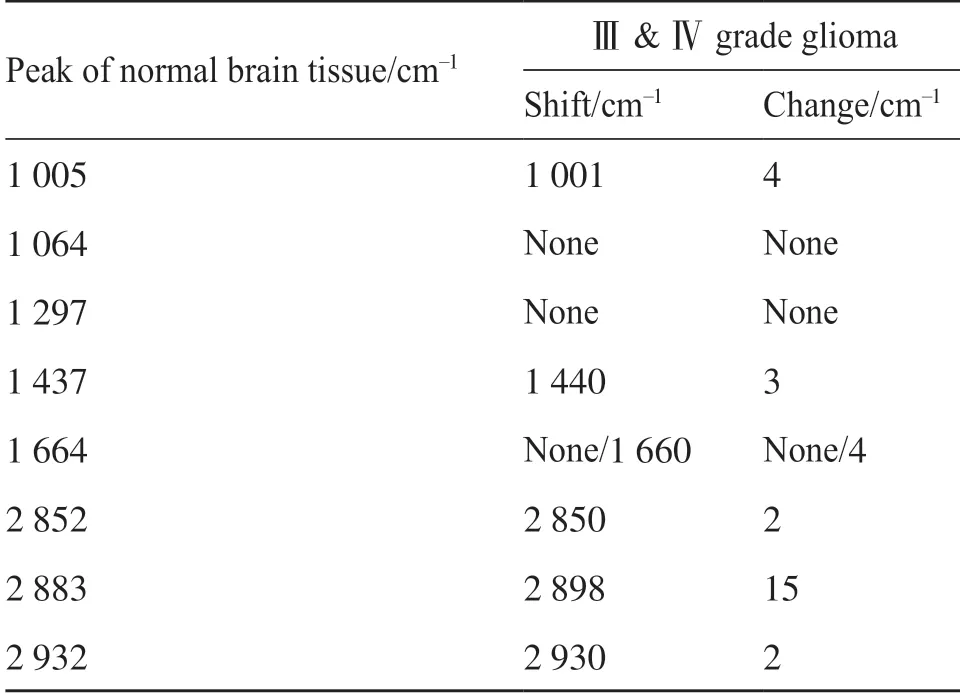
表3 正常脑组织和Ⅲ、Ⅳ级脑胶质瘤拉曼位移特征分析结果Tab.3 Characteristics of Raman shift in normal brain tissue and grade Ⅲ & Ⅳ glioma
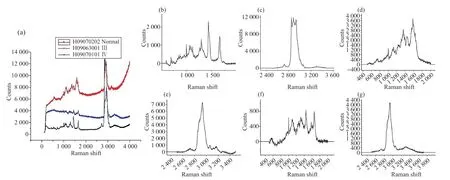
图1 正常脑组织与Ⅲ、Ⅳ级脑胶质瘤组织的拉曼特征光谱Fig.1 Raman characteristic spectra of normal brain tissue and grade Ⅲ and Ⅳ glioma tissues
2.3 Ⅲ、Ⅳ级脑胶质瘤特征性拉曼光谱
本研究发现,Ⅲ和Ⅳ级脑胶质瘤样本的拉曼绝对峰位在565、717、1 001、1 103、1 205、1 340、1 394、1 440、2 725、2 850、2 872、2 898、2 930、3 011和3 060 cm-1等处相同,而在1 235、1 260、1 311、1 360、1 583、1 660、3 160和3 300 cm-1处出现有差异的拉曼特征峰(图2)。
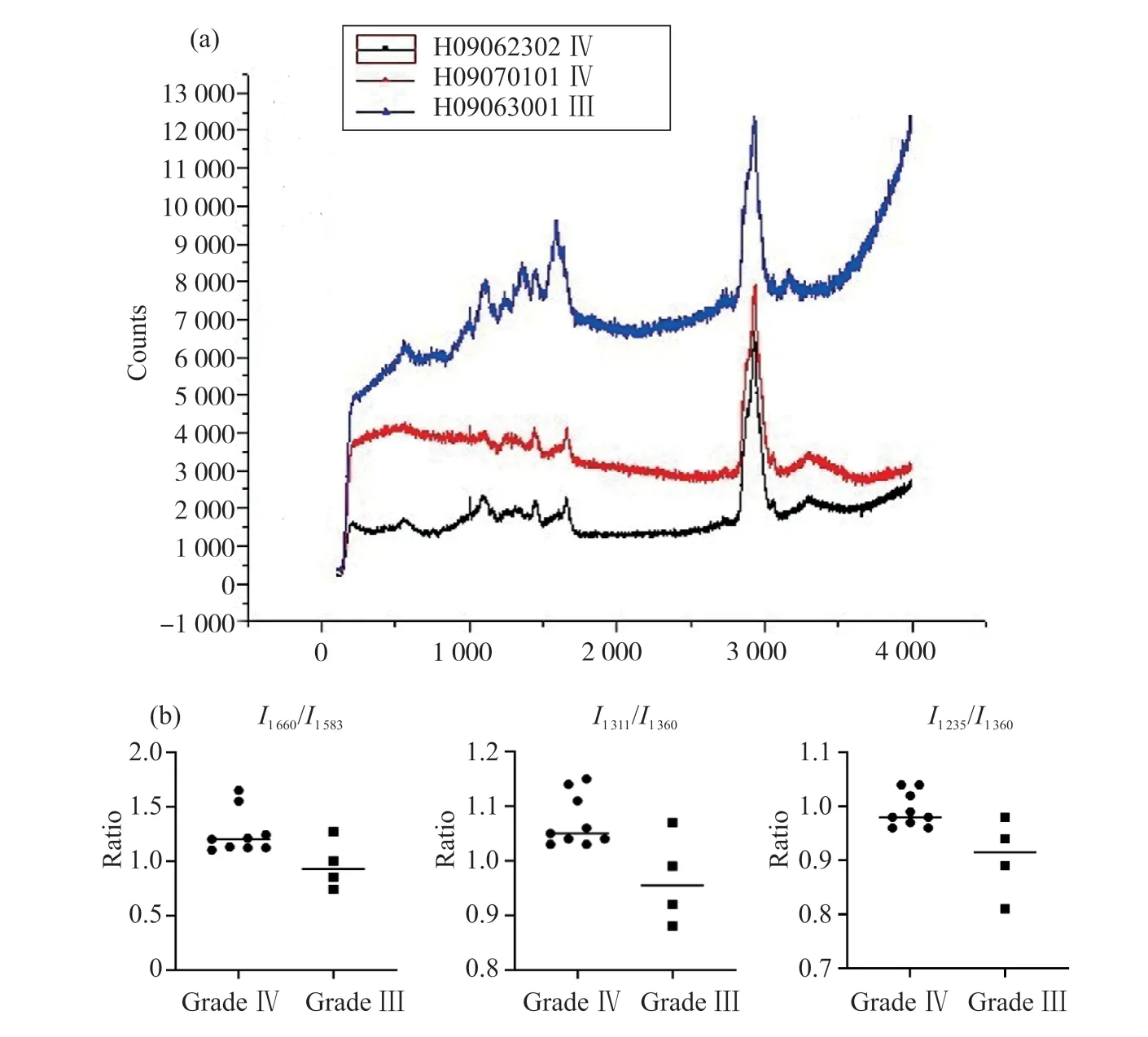
图2 Ⅲ及Ⅳ级脑胶质瘤组织拉曼特征光谱对比及聚类分析结果Fig.2 Comparison of Raman characteristic spectra in grade Ⅲ and Ⅳ glioma tissues
分析峰位和峰强度发现,Ⅲ级脑胶质瘤的样本在1 311 cm-1的特征峰被1 360 cm-1处掩盖,仅表现为次峰,其主峰移位到了1 235 cm-1处;而Ⅳ级脑胶质瘤样本的在1 311 cm-1峰位处为主峰,并未被1 360 cm-1峰位处波峰掩盖。进一步分析发现,在1 583 cm-1和1 660 cm-1处出现的拉曼特征峰具备显著的定性区分价值。进一步通过对两组样本位于I1660/I1583、I1311/I1360和I1235/I1360等处的峰强度比值分析发现:在Ⅳ级及Ⅲ级脑胶质瘤中,拉曼位移I1660/I1583的比值分别为1.26±0.20和0.98±0.20(P=0.03*);拉曼位移I1311/I1360的比值分别为1.07±0.05和0.98±0.08(P=0.04*);拉曼位移I1235/I1360比值分别为0.99±0.03和0.91±0.07(P=0.01*)。Ⅲ、Ⅳ级脑胶质瘤特征拉曼位移比值的比较见表4。
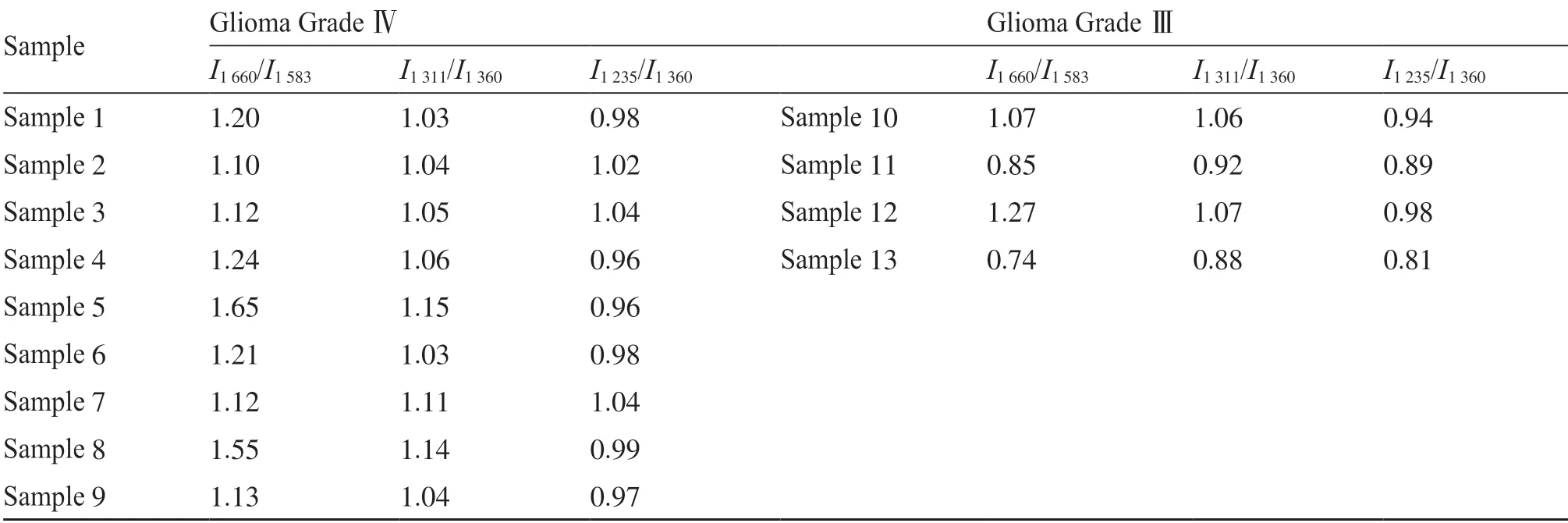
表4 Ⅲ&Ⅳ级脑胶质瘤特征拉曼位移比值比较Tab.4 Comparison of Raman shift ratios between grade Ⅲ and Ⅳ glioma
本研究将13例脑胶质瘤拉曼波谱样本归为两类,并与WHO病理分级相对照,结果两例样本(样本10与样本12)的病理分级结果与拉曼检测判别结果不一致。由此可得出,拉曼光谱判别Ⅲ、Ⅳ级脑胶质瘤分期与病理分期的符合率为86%。进一步分析两例异质性样本,经高年资病理科医生共同讨论后认为:样本10的病理应诊断为Ⅲ级少突胶质细胞瘤,但其细胞核异型性、血管生成程度及组织坏死程度与Ⅳ级胶质瘤组织病理病变程度相当;经复核,样本12含有Ⅲ级和Ⅳ级胶质瘤的成分。因此两例异质性样本病理复核结果支持Ⅳ级胶质瘤的诊断。
3 讨论
脑胶质瘤的分级与治疗方法和预后密切相关。临床中病理诊断为低级别胶质瘤的患者的病变可呈现出高级别胶质瘤生长、复发现象,这类患者更需要对其病理分级诊断进行补充,进一步提升诊断准确性。拉曼光谱是一种用于检测生物信息的分子光谱成像技术[17-18]。任何组织的病理改变均伴随着细胞内组分的分子结构或量的改变,恶性肿瘤组织的颜色有别于正常组织,并且颜色的差别是由细胞中分子的电子能及跃迁强度所决定[19]。因此,组织标本颜色差异的现象和电子跃迁的微观理论可说明,在微观层面研究病变组织是可行的,分子内的细微改变将会体现在拉曼光谱谱带变化之中。同时,拉曼光谱检测具有无损伤性、高灵敏度、检测迅速等特点,可通过分子谱带找出组织分子结构差别,是研究肿瘤诊断和判断预后的良好方法之一[20-21]。既往研究中,Catherine等[3]及Galli等[22]不仅获得了正常脑组织的特征拉曼谱带,其研究结果还发现,拉曼光谱分析对原发多形性胶质母细胞瘤(glioblastoma multiforme,GBM)的识别率可达94%,复发性GBM的识别率可达100%。临床中需基于不同分级脑胶质瘤类型制定不同的化疗、靶向、放疗及电场治疗方案,因此脑胶质瘤分级对临床治疗具有重要的指导意义。本研究不仅对正常脑组织与高级别脑胶质瘤组织进行了对比分析,更进一步创新地对Ⅲ、Ⅳ级脑胶质瘤间的特异性进行了探讨,阐述了Ⅲ、Ⅳ级脑胶质瘤之间在拉曼光谱上的特异性及其对应分子层面改变,并因其灵敏性更具备脑胶质瘤快速诊断的潜力,可为脑胶质瘤术中准确诊断和确定切除边界提供新的参考和指导,为降低脑胶质瘤局部复发奠定了基础。
既往研究表明,细胞内核酸、脂类、蛋白质、糖类等组分的差异会导致细胞拉曼特征位移的差异,故拉曼光谱可用于肿瘤良恶性的鉴别[23]。本研究中,Ⅲ级和Ⅳ级脑胶质瘤细胞的细胞异型性程度不同,因此两级肿瘤的恶性程度也不同,拉曼光谱检测结果发现了不同级别脑胶质瘤显示不同的特征拉曼峰位分布。结果可见:测量细胞的拉曼特征峰位移差异反应了两级脑胶质瘤的恶性程度的差异;正常组织与Ⅲ、Ⅳ级脑胶质瘤组织在1 750~2 750 cm-1峰位之间有较大的差别,但Ⅲ级与Ⅳ级胶质瘤样本细胞内蛋白质Trp、蛋白质Phe、脂类δ(CH2)成分种类无明显变化。同时,无论Ⅲ级脑胶质瘤样本是否出现1 660 cm-1拉曼特征峰,其终究会在1 583 cm-1处出现较强峰值的拉曼特征峰,而Ⅳ级脑胶质瘤样本均在1 660 cm-1峰位出现特征峰,但并未在1 583 cm-1峰位处表现出特征峰;再对Ⅲ、Ⅳ级脑胶质瘤在1 583和1 660 cm-1处相对峰强度比较,结果可见,Ⅲ级与Ⅳ级脑胶质瘤在I1660/I1583、I1311/I1360峰位的比值具有显著的差异。基于这些研究结果,我们认为,当以比值“1”为I1660/I1583和I1311/I1360的界值时,I1660/I1583和I1311/I1360比值可用于区分Ⅲ级和IV级脑胶质瘤,证明了1 235 cm-1峰位随1 311 cm-1峰位的峰强度变化而变化,即说明1 360 cm-1仅影响1 235 cm-1和1 311 cm-1的绝对峰强度,而不影响其相对峰强度,可推测Ⅲ、Ⅳ级脑胶质瘤细胞内物质改变呈比例变化。
研究过程中出现了两例病理分级结果与拉曼检测结果不一致的争议样本,但经病理复核后支持了拉曼光谱分析结果,体现出拉曼光谱诊断的敏感性及准确性,也在一定程度上解释了临床工作中有些患者虽然病理诊断为低级别脑胶质瘤,但治疗后亦出现迅速局部复发等高级别脑胶质瘤具备的生物学行为。因此,通过对两例争议样本的分析可以初步认为,拉曼光谱测得的分级结论不依赖于脑胶质瘤细胞的类型,而是直接通过检测细胞内的组分物质中电子变化实现的,其检测结果可以直接反映脑肿瘤病变的异型性和组织坏死程度,为脑胶质瘤的诊断和分级提供了更丰富的信息。
综上,激光共聚焦拉曼光谱能辅助病理诊断,特别是对于取材少、细胞混合的病理组织,其能快速、准确地判断切除肿瘤包块的边界是否有肿瘤组织残存,成为神经外科术中鉴别残余肿瘤的重要参考[24],有助于优化治疗方案及辅助确定手术切除范围,并最大限度保护正常脑组织。因此,激光共聚焦拉曼光谱是一种高效、准确的对脑胶质瘤进行诊断及分级的辅助手段,具备可期的临床应用前景。

