从某核衣壳抑制剂临床试验结果看慢性乙肝抗病毒治疗评价指标选择的重要性
李桂馨, 刘 慧, 姜倩倩, 陈红松, 鲁凤民
乙型肝炎病毒(hepatitis B virus,HBV)是慢性乙型肝炎(chronic hepatitis B,CHB)的主要致病因素。目前,全球慢性HBV感染者高达2.96亿。若不及时进行有效的抗病毒治疗,有15%~40%的CHB患者可进展至肝硬化、肝细胞癌等终末期肝病[1-2]。目前,临床用于治疗慢性HBV感染的药物包括核苷(酸)类似物[nucleos(t)ide analogues,NAs]与长效干扰素,这两种药物均可显著减缓疾病进展,有效减少终末期肝病的发生。其中,NAs强效抑制HBV复制,可快速降低患者体内HBV DNA水平,且口服方便,在临床上被广泛使用。但由于停药后易出现病毒反弹及疾病复发,接受NAs治疗的患者往往需要长期甚至终生服药;而长效干扰素类药物,尽管抑制病毒复制的能力相对较弱,但在一些病毒载量特别是血清表面抗原(hepatitis B surface antigen,HBsAg)较低的优势人群,可显著提高临床治愈[3]。但由于存在引发患者出现不同程度副作用的风险,临床上对长效干扰素的使用往往采取有限疗程的策略。更为重要的是,二者均无法清除或持续静默HBV转录模板共价闭合环状DNA(covalently closed circular DNA,cccDNA)[4]。因此,针对HBV复制不同环节的抗病毒新药的研发显得尤为重要。
1 HBV生命周期概述
在HBV Dane颗粒感染肝细胞的过程中,进入细胞内的核衣壳脱去包膜并被转运到核孔复合体附近,核衣壳因主动或被动变构被打开,所含的基因组松弛环状DNA(relaxed circular DNA,rcDNA)随即被递送进细胞核内,经宿主DNA修复系统形成cccDNA,建立感染。作为复制模板的cccDNA可转录产生包括前基因组RNA(pregenomic RNA,pgRNA)在内的病毒RNA,其中pgRNA作为典型的双顺反子结构,是翻译产生核心蛋白(HBV core,HBc)和病毒聚合酶(polymerase,P)蛋白的信使RNA(mRNA)。翻译产生的P蛋白随即与其转录模板pgRNA结合形成复合物[5],并招募二聚体化的核心蛋白通过相邻二聚体界面疏水相互作用最终组装成正二十面体的核衣壳。在核衣壳内部,pgRNA被P蛋白逆转录为rcDNA,含rcDNA的核衣壳即成为成熟的核衣壳,后者或获得包膜形成Dane颗粒释放至细胞外,开始下一个循环,或重新被运输到细胞核内以回补cccDNA池[6](见图1)。由此可见,无论是在从头感染过程中,还是新合成的携带rcDNA的核衣壳,其在特定的空间位置被有序地打开以释放rcDNA入核,或精细地组装成包裹P蛋白/pgRNA复合物的核衣壳,对于有效建立感染和病毒的持续复制都是至关重要的。

图1 乙型肝炎病毒生命周期示意图[7]
2 核衣壳抑制剂作用机制
如前所述,核衣壳在病毒基因组包装、提供逆转录场所、胞内运输及维持cccDNA池稳定等病毒生命周期的多个环节均有重要作用[8]。鉴于核衣壳在HBV复制中的多重作用,研发人员已将其作为重要的直接抗病毒靶点,并相应研发出一类代表性药物核心蛋白变构调节剂(core protein allosteric modulators,CpAMs)。CpAMs可干扰正常核衣壳形成从而抑制pgRNA包装及随后的HBV DNA复制;也可作用于已包装的成熟核衣壳,诱导其变构或错误解聚,导致rcDNA无法被精准递送至细胞核,最终抑制cccDNA合成[9-10]。另外,少量文献也已发现CpAMs还具有直接降低HBV e抗原(HBV e antigen,HBeAg)的作用[11-12]。目前,已有多种不同结构类型的CpAMs处于临床研发阶段(见表1)。
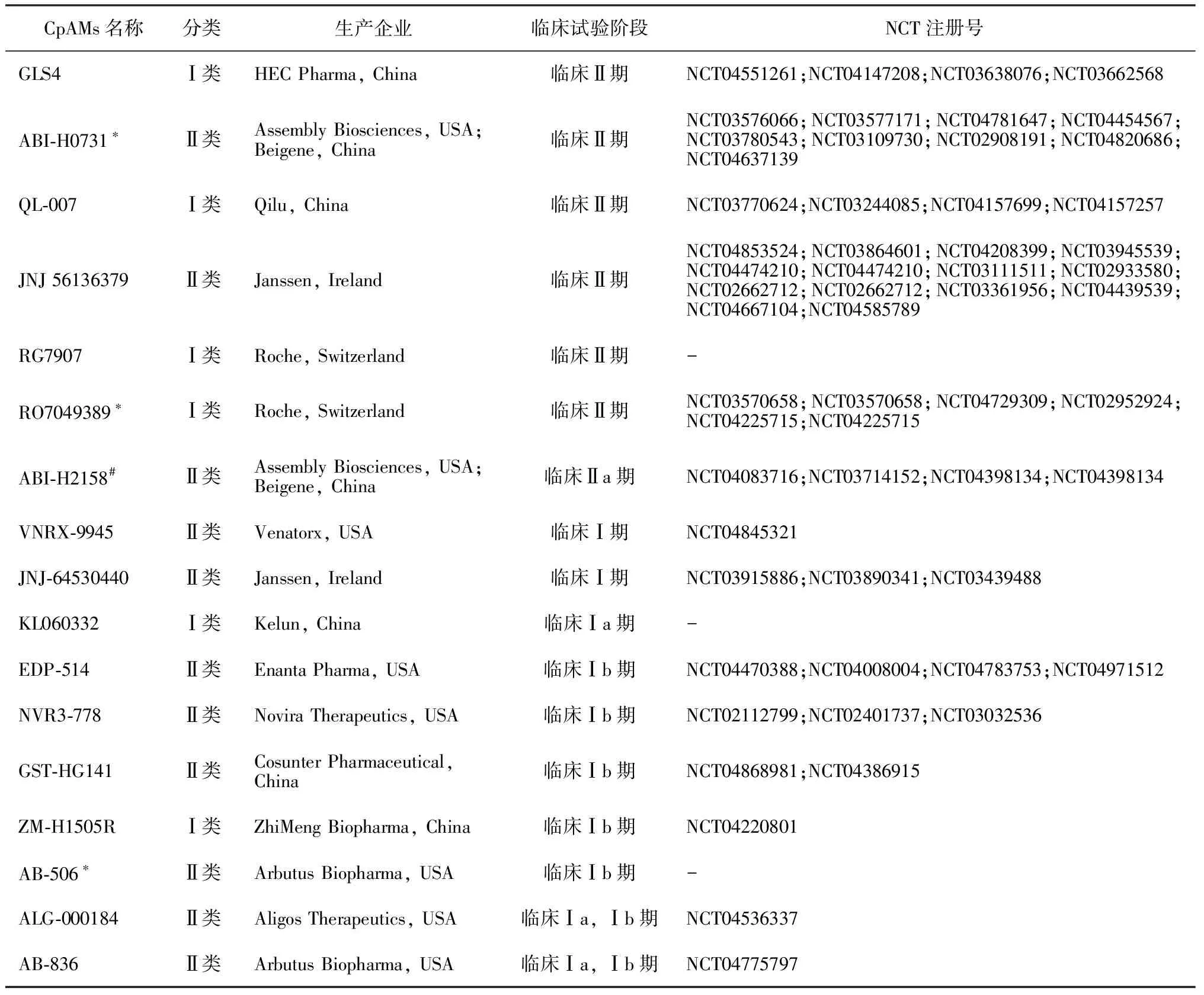
表1 CpAMs临床试验总结
表1中的ABI-H0731由Assembly Biosciences公司开发[13],其展示的作用机制主要包括:(1)干扰核衣壳有效包裹pgRNA/P蛋白复合物,进而导致rcDNA无法被合成,最终抑制Dane颗粒合成及释放。但须注意的是,该作用同样也显著抑制了HBV RNA病毒样颗粒的释放。(2)抑制从头感染后肝细胞内脱去包膜的成熟核衣壳的正确解聚,干扰rcDNA的递送入核及后续cccDNA形成,直接导致感染无法建立。(3)对于已建立感染的肝细胞,其对子代新合成rcDNA的抑制将使cccDNA贮存池的补充难以为继,长期用药可能使cccDNA耗竭(见图2)。CpAMs的这些作用使其成为备受关注的在研直接抗乙肝病毒药物,并被人们寄予极大的希望。

图2 核衣壳抑制剂ABI-H0731作用机制图[引自EASL 2021(PO-482)][13]
3 NAs治疗下HBV RNA可反映cccDNA转录活性并作为安全停药评价指标
2017年,Lok等[14]欧美专家在共识中提出了“部分治愈”(partial cure)的概念。这一概念随后于英国伦敦召开的“2019欧洲肝病研究协会-美国肝病研究协会HBV治疗终点会议”上被再次强调。所谓部分治愈,是指接受NAs治疗的患者虽仍能检测到HBsAg,但其HBV DNA水平低于灵敏试剂检测下限并在停药后仍能维持HBV DNA不反弹、ALT水平正常。但由于需要停药观察才能知道哪部分CHB患者达到了“部分治愈”。为减少停药后疾病复发的风险,各大主流指南均推荐在患者血清HBV DNA低于检测下限12~36个月甚至更长时间的巩固治疗后才停药,以提高停药的安全性[15-17]。然而,即便严格遵循指南的指导意见,仍有相当比例的患者在停药后出现病毒学反弹,甚至发生暴发性肝炎。其原因在于NAs作用于核衣壳内以pgRNA为模板的逆转录过程,通过与细胞内的脱氧核糖核苷酸竞争性掺入并不可逆地阻断rcDNA负链合成[18],从而使得患者的血清HBV DNA很快低于检测下限。但此时cccDNA仍可有活跃转录,因此,临床上以血清HBV DNA“消失”作为NAs安全停药的指标并不恰当。近年来一些研究也已证实,HBV复制过程中,部分被核衣壳包裹但未经逆转录的HBV pgRNA也可获得包膜,进而形成RNA病毒样颗粒并被释放至血清中[19-20]。并且,当NAs阻断以pgRNA为模板逆转录合成rcDNA时,核衣壳包裹的处于NAs作用下的残余HBV pgRNA将以HBV RNA病毒样颗粒的形式释放入血循环[19]。因此,升高的血清HBV RNA水平可反映宿主肝细胞内cccDNA的转录活跃状态。对比而言,此时患者血清HBV DNA的“消失”仅仅代表NAs阻断HBV DNA复制的有效性,并不代表cccDNA的耗竭或转录静默,而决定停药后病毒学反弹和临床复发的原因是感染肝细胞核内有转录活性的cccDNA的存在。因此,在后续的研究中以HBV DNA和RNA双检测阴性作为巩固治疗后NAs停药的实验室指标[21],使得NAs的安全停药得到了保证。血清HBV RNA作为反映cccDNA活跃转录的血清学指标也被写入欧美国家及我国的新版指南中[15-17]。
4 核衣壳抑制剂临床试验结果解读及药物评价指标选择的重要性
截至目前,ABI-H0731是临床试验进展最快的核衣壳抑制剂之一,已经完成临床 Ⅱ 期研究,其公布的201研究共招募了47例HBeAg(+)及26例HBeAg(-)的NAs经治CHB患者,分别进行NAs联合ABI-H0731或NAs联合安慰剂治疗。该项研究结果显示,相较于联合安慰剂治疗,NAs联合ABI-H0731治疗24周后,更多的经治患者达到病毒学应答[HBeAg(-):94% vs 70%;HBeAg(+):83% vs 29%]。其公布的202研究招募了25例HBeAg(+)的初治CHB患者,研究结果显示,相较于联合安慰剂治疗,恩替卡韦(entecavir,ETV)联合ABI-H0731治疗24周后患者的HBV DNA、HBV pgRNA水平明显降低、ALT复常率明显升高。这些结果说明联合ABI-H0731可在单用NAs基础上进一步抑制病毒复制,发挥抗病毒作用。在后续的研究中,为进一步评价NAs联用ABI-H0731是否可实现持续病毒学应答,上述201及202研究所有患者均开放标签进行NAs联合ABI-H0731至少治疗24周,之后每4周对患者进行评估,如果HBV DNA+pgRNA低于检测下限并且HBeAg转阴或≤5 IU/ml,即停止治疗,否则,继续治疗。在202研究中,患者在入组后持续治疗72周时间内,虽然HBV DNA及pgRNA水平持续下降,但均未低于检测下限。201研究中,最终共23例基线HBeAg(-)患者及18例基线HBeAg(+)患者达到停止治疗标准停药,并进行了持续随访。然而随后的数据表明,基线HBeAg(-)患者在停止治疗后16周内全部复发,基线HBeAg(+)患者在随访12周内全部复发,Assembly Biosciences公司也因此于2021年9月份因该药的Ⅱ期临床研究未达到其预期的停药终点而遗憾地宣告终止。另外两种在研核衣壳抑制剂NVR3-778、JNJ56136379被报道可明显降低HBV DNA及RNA水平,且下降具有相似的动力学,但以血清中HBV DNA、HBV RNA作为患者病毒学应答的评价指标并停药后,部分患者血清HBV DNA及RNA水平均出现反弹,甚至达到了基线水平[22-23]。CpAMs可干扰衣壳蛋白对pgRNA的包装环节。因此,理论上ABI-H0731等CpAMs不仅可直接抑制上清中HBV DNA的水平,由于CpAMs同样抑制了pgRNA包裹入核衣壳,从而也抑制了血清中HBV RNA的水平,这意味着在CpAMs治疗下血清HBV DNA和(或)pgRNA水平均不能再反映患者cccDNA的转录活性,这可能也是本研究中ABI-H0731以HBV DNA+pgRNA联合作为患者停药标准却导致所有患者停药后病毒学反弹的主要原因。
5 核衣壳抑制剂临床试验及药物评价指标新建议
这些临床试验的结果,使我们注意到CpAMs在临床试验中如何选择合适的病毒学指标作为其合理停药标准这一现实问题。目前,仅有肝活检可准确监测肝内cccDNA水平,但其有创性及操作后可能出现的并发症限制了在常规临床实践中的应用。除HBV DNA和HBV RNA外,来源于cccDNA的其他病毒产物,还包括HBsAg及乙型肝炎核心相关抗原(hepatitis B core-related antigen,HBcrAg)。但由于HBsAg可来源于HBV基因组整合,此时HBsAg水平与cccDNA的相关性较差,因此并不能准确反映cccDNA的转录活性[24]。HBcrAg包括HBV核心抗原(HBV core antigen,HBcAg)、HBeAg及22 kDa的前核心蛋白(22 kDa precore protein,P22cr),在CHB患者中,HBcrAg与cccDNA转录活性密切相关[25-26]。从作用机制上,CpAMs可分为诱导异常组装的衣壳的形成(Ⅰ类,杂芳基二氢吡啶类)或正常组装的空衣壳形成(Ⅱ类,苯丙酰胺类及氨磺酰类)。前者通常在细胞内降解,后者虽可释放,但由于没有病毒核酸,不具备感染性[9,27-28]。因此,我们推测,对于Ⅱ类CpAMs,血清HBcrAg消失或许能较好反映cccDNA转录静默。据报道,通过荧光的生化衣壳组装实验发现ABI-H0731干预后快速产生了空衣壳结构,且未出现HBc降解,属于Ⅱ类CpAMs[29]。因此,基于其药物作用机制,我们建议在临床试验中,血清HBV DNA及HBV RNA联用血清HBcrAg阴性作为停药指标,以提高停药的安全性,但仍需要高质量临床研究进一步验证。而对于Ⅰ类CpAMs,由于其会组装成异常衣壳并在胞内降解,此情况下血清HBcrAg是否还能准确地反映cccDNA转录活性存疑,未来应考虑与其他血清学指标联用来进一步降低停药后病毒学反弹的风险。
6 结语
目前,乙肝新药的研发如火如荼,上述临床研究案例提示我们,在不同机制的抗病毒药物治疗下,如何选用合适的指标还需谨慎全面地进一步总结。

