枣GH3基因家族的鉴定与表达分析
付鸿博,于斯嘉,袁盛勇,李 杰,杨永超,岳 龙,罗振兴
(1.红河学院 a.生物科学与农学学院;b.云南省高校滇南特色生物资源研究与利用重点实验室,云南 蒙自661199;2.吉林省东辽县农业技术推广总站,吉林 东辽 136600;3.白城市林业科学研究院,吉林 白城 137000)
植物生长素在植物的生长发育过程中至关重要[1],生长素也是最先被发现的植物激素,它对植物顶端优势、根系和果实的生长发育均有重要的影响[2-3]。GH3(Gretchen Hagen 3)基因家族是一类主要的生长素原初反应[4],可以使吲哚-3-乙酸(IAA)与某些特定的氨基酸形成共轭化合物[5],从而影响IAA含量,进而对植物生长发育起到调控作用。首个GH3基因从大豆中鉴定后,陆续在多种植物中鉴定出GH3基因[6]。随着GH3基因在不同植物中逐渐被克隆后,其功能分析也逐渐受到关注[7]。GH3基因在植物生长发育、胁迫响应及影响果实成熟等方面均具有重要的作用。拟南芥AtGH3.11基因编码的蛋白参与了远红光对基因的影响,与植物光形态建成密切相关[8],过表达拟南芥GH3基因后叶片的生长状况和形态都有所变化[9],AtGH3.9影响植物初生根的发育[10]。水稻中GH3基因影响了茉莉酸甲酯的表达[11],在光形态建成过程中能同时调控光信号和茉莉酸信号途径。印度芥菜的BjGH3.1的表达量变化影响了叶片和根系的生长[12]。水稻OsGH3-2调节生长素和脱落酸水平,提高了抗旱性和抗寒性[13]。过表达拟南芥AtGH3.5基因提高植物系统抗病性,提示GH3基因介导GH3与生长素信号通路的相互作用[14]。在辣椒果实中,GH3蛋白的活性与果实成熟有关,在心包膜和胎盘中高度表达,GH3基因受乙烯诱导,过表达辣椒GH3基因刺激番茄果实提早成熟[15]。
‘枣’是枣属(Ziziphus)植物的总称,为鼠李科(Rhamnaceae)植物中最重要的一个属,在我国,‘枣’(Ziziphus jujuba)主要指枣属植物之中的一个栽培种,为落叶乔木或灌木。我国枣演化历史悠久,种质资源丰富,最早起源于黄河中下游地区,除高海拔和高纬度等地区外均有分布[16]。目前关于枣生长发育及果实品质与相关激素的研究主要集中在外源激素调控[17]和内源激素含量的变化[18],关于激素相关分子机制的研究较少。本研究通过生物信息学的方法对枣GH3基因家族做了比较完整的分析,为进一步研究枣GH3基因功能奠定了重要的基础。
1 材料与方法
1.1 枣GH3基因家族成员鉴定
枣基因组数据下载于NCBI数据库,隐马尔可夫模型(PF03321)下载于Pfam数据库,利用Hmmer 3.0构建本地蛋白数据库并进行搜索,对候选GH3基因的结构域利用NCBI数据库进行验证,最终确定得到19个枣GH3基因家族成员。
1.2 枣GH3基因的生物信息学及表达分析
利用在线数据库ProtParam, PSORT II Prediction和SOMPA对最终确定的枣GH3基因家族成员的理化性质、亚细胞定位和二级结构进行分析。利用MEGA 7采用Neighbor-Joining法(Bootstrap replications=1000)对所鉴定到的ZjGH3和拟南芥GH3蛋白进行系统进化树构建。根据基因位置信息对枣GH3基因结构和染色体定位进行分析,利用在线数据库MEME和PlantCARE对motif基序和启动子元件进行分析。利用课题组前期测得的转录组数据,将枣GH3基因在‘壶瓶枣’果实发育的三个时期白熟期(H1),半红期(H2)和全红期(H3)的表达情况进行分析。利用TBtools软件进行可视化绘图。
2 结果与分析
2.1 枣GH3基因家族成员进化树分析
为了解枣GH3蛋白的进化关系,利用MEGA 7对所鉴定得到的19个ZjGH3基因家族成员与拟南芥GH3蛋白进行了系统进化树分析(图1),结果显示,根据拟南芥的分类依据可将枣GH3基因家族成员分成三大类,其中Clade1包括了5个成员,Clade2和Clade3均包括了7个成员。

图1 枣和拟南芥GH3基因家族成员的系统进化树分析Fig.1 Phylogenetic tree analysis of GH3 family members from Z.jujuba and Arabidopsis thaliana
2.2 枣GH3基因家族成员的多序列比对及基因结构分析
根据枣GH3蛋白序列单独构建了进化树(图2A),分类结果与同拟南芥分析时的结果一致,同样可分为三大类,包括Clade1~Clade3。通过分析枣GH3蛋白结构域发现(图2C),19个枣GH3基因家族成员包括了GH3保守结构域,进一步说明19个GH3基因均属于GH3基因家族成员。为了进一步了解枣GH3基因信息和蛋白特征,对其motif基序(图2B)和基因结构(图2D)进行分析,结果表明motif3和motif6保守度最高,只在ZjGH3-4中没有被预测到,在其他18个ZjGH3中均被预测到,同时发现ZjGH3-10只包括了motif3和motif6。其次为motif1和motif4,motif1在ZjGH3-1和ZjGH3-10未被预测到,motif4在ZjGH3-9和ZjGH3-10未被预测到。基因结构分析结果表明,所有家族成员的基因结构都较为简单,包括2到5个外显子且均有UTR组成。Clade2中ZjGH3-4含有两个外显子,其他的6个基因家族成员均含有3个外显子。Clade1中的5个家族成员的外显子数量有差异,ZjGH3-9和ZjGH3-10含有2个外显子,ZjGH3-13含有3个外显子,ZjGH3-14含有4个外显子,ZjGH3-15含有5个外显子。Clade3中的7个成员的外显子数量在3-5个,但外显子的分布格局相对一致。

图2 枣GH3基因家族的进化树(A)、motif基序(B)、保守结构域(C)和基因结构(D)分析Fig.2 Analysis of phylogenetic relationships (A), motif structure (B), conserved domain (C) and gene structure (D) in ZjGH3 gene family
2.3 枣GH3基因家族成员的理化性质分析
对所鉴定的枣GH3基因家族成员进行理化性质和二级结构分析后发现(表1),ZjGH3基因家族成员所编码的氨基酸长度范围较大,为149 aa(ZjGH3-10)~629 aa(ZjGH3-15),除ZjGH3-1、ZjGH3-4、ZjGH3-10、ZjGH3-13和ZjGH3-16五个家族成员外,其余14个家族成员所编码的氨基酸长度基本均在600 aa左右。分子量在17.35~71.24 kD之间。等电点在5.21 (ZjGH3-13)~8.90 (ZjGH3-1),其中ZjGH3-1、ZjGH3-2、ZjGH3-3和ZjGH3-4的等电点大于7,均为碱性蛋白,其余的家族成员均为酸性蛋白。不稳定系数范围在34.34 (ZjGH3-3)~56.54 (ZjGH3-10),其中有11个为稳定蛋白,8个为不稳定蛋白。脂肪族氨基酸指数范围在80.54 (ZjGH3-10)~94.91(ZjGH3-11),亲水性范围在-0.501 (ZjGH3-10)~-0.063 (ZjGH3),表明所有家族成员均为亲水性蛋白。亚细胞定位分析后发现,全部家族成员被定位在细胞质(15个)和细胞核(4个)上。
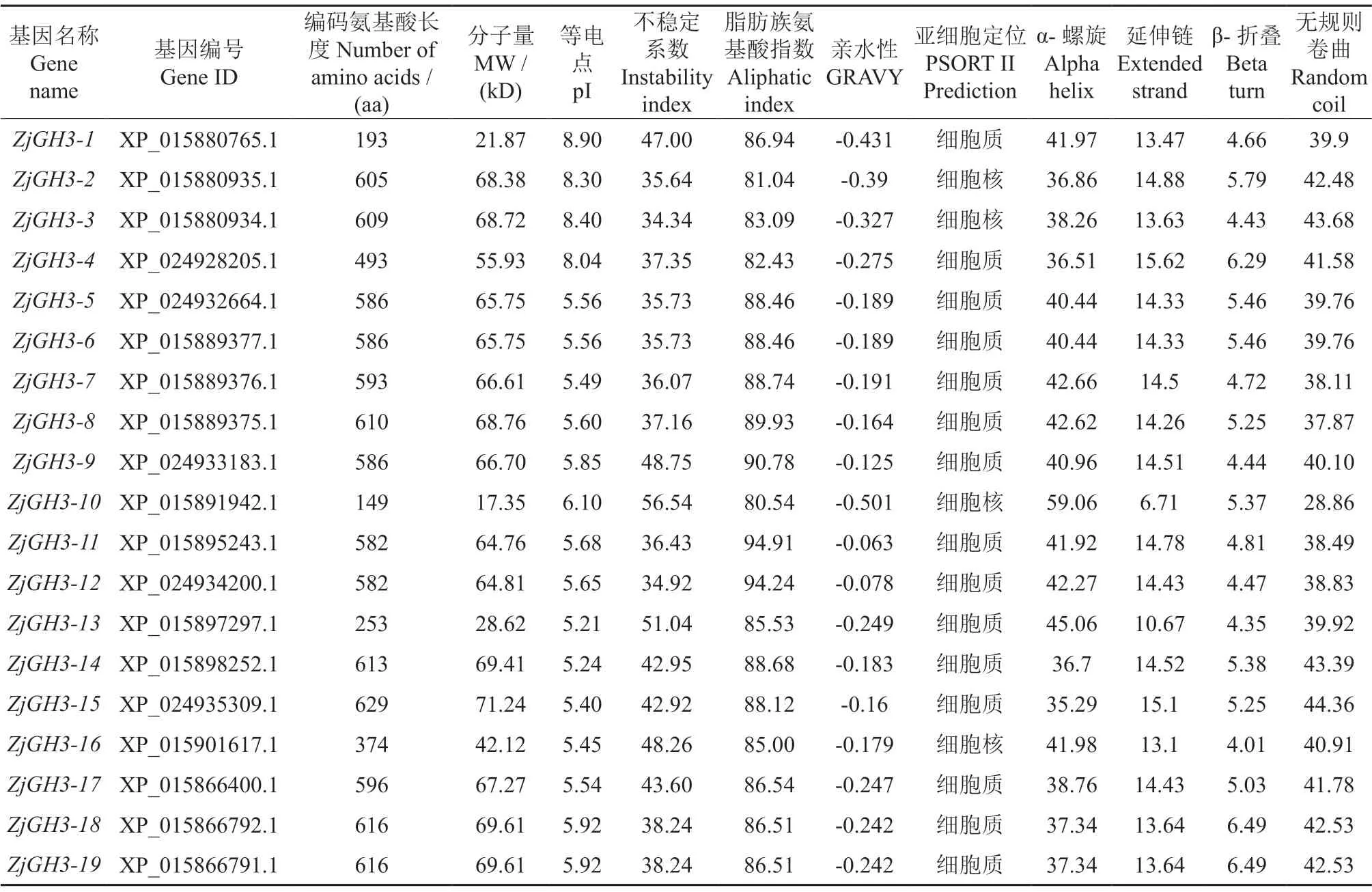
表1 枣GH3基因家族成员的理化性质及二级结构Table 1 The physicochemical properties and secondary structure of the GH3 gene family of Z.jujuba
对二级结构预测后发现,全部家族成员均有α-螺旋、延伸链、β-折叠和无规则卷曲构成,其中β-折叠的比例最低,分布范围在(4.01%~6.49%),α-螺旋(35.29%~59.06)和无规则卷曲(28.86%~44.35)的占比最高,除ZjGH3-10以外的其他家族成员的α-螺旋和无规则卷曲的比例相差较小,基本均在40%左右。说明ZjGH3家族成员的二级结构主要由α-螺旋和无规则卷曲构成且行使主要功能。
2.4 枣GH3基因启动子顺式作用元件分析
利用PlantCARE在线工具对枣GH3基因前2.0 kb序列的启动子顺式作用元件进行分析(图3)。结果表明,ZjGH3基因家族含有类型丰富的启动子元件且分布不规律。所有基因都分析到了光响应元件(G-box、Box II、TCCC-motif和I-box等),ZjGH3-17和ZjGH3-13基因均分析到了超过15个光响应元件,为所有基因所有元件中数量最多的。与结合MYB位点的元件包括MRE、MBS和CCAAT-box,三大类中的基因基本都分析到了上述三个元件,但数量较少。与激素相关的响应元件包括茉莉酸甲酯响应元件(CGTCA-motif和TGACG-motif)、赤霉素响应元件(P-box)、生长素响应元件(TGA-element和AuxRE)和脱落酸响应元件(ABRE),19个ZjGH3基因中只有ZjGH3-12和ZjGH3-18两个基因没有与茉莉酸甲酯响应相关的元件,ZjGH3-16与茉莉酸甲酯响应相关的元件数量较多,共10个。Clade1和Clade3两大类中的12个家族成员都有与脱落酸响应相关的元件。与生长素响应的元件较少,只在ZjGH3-16、ZjGH3-17、ZjGH3-9和ZjGH3-10四个基因中分析到。与植物生长发育响应的相关元件中,Clade3分类中只有ZjGH3-11和ZjGH3-12分析到与玉米醇溶蛋白相关的元件(O2-site)。与种子特异性调控相关的元件(RY-element)只在Clade2分类中ZjGH3-4基因的启动子区域被分析得到。与胁迫响应相关的元件中,无氧诱导元件(ARE)只在ZjGH3-4和ZjGH3-7基因的启动子区域没有被分析到,机械损伤(WUN-motif)、防御和应激(TC-rich repeats)响应元件只在Clade3中的部分基因的启动子区域被分析到。综上,ZjGH3基因可能受光照、茉莉酸甲酯和无氧诱导等多种因素的调控。

图3 枣GH3基因的启动子分析Fig.3 Promoter analysis of ZjGH3 genes
2.5 枣GH3基因的染色体分布
为了解枣GH3基因家族成员在枣染色体上的分布情况,通过绘制染色体定位图可以发现(图4),19个枣GH3基因家族成员中有15个基因被定位到枣的12条染色体中的Chr4、Chr8、Chr9、Chr10、Chr11和Chr12共6条染色体上,其他的6条染色体没有枣GH3基因分布。在Chr4和Chr8定位到了最多的ZjGH3基因,均包括了4个。在Chr11上只定位1个ZjGH3基因。ZjGH3-16、ZjGH3-17、ZjGH3-18和ZjGH3-19这4个基因未被定位到枣的12条染色体上。通过分析枣GH3基因发现,19个GH3基因中有14个基因都有基因复制事件,包括ZjGH3-2~ZjGH3-3、ZjGH3-2~ZjGH3-4和ZjGH3-5~ZjGH3-6等8对基因复制事件。

图4 枣GH3基因在染色体上的分布Fig.4 Chromosome location of the ZjGH3 genes
2.6 枣GH3基因的表达分析
通过对不同发育时期‘壶瓶枣’果实中GH3基因的表达情况分析发现(图5),19个枣GH3基因在枣果实发育的H1(白熟期)、H2(半红期)和H3(全红期)三个时期中的一个或多个时期均有表达,不存在三个时期均不表达的基因。ZjGH3-2和ZjGH3-3基因在H1表达,在H2不表达,在H3又表达,但在H1和H3两个时期表达量极低(FPKM<1)。ZjGH3-13基因在H1不表达,在H2和H3两个时期表达,但表达量低(FPKM<1)。ZjGH3-1基因在H1和H2两个时期表达量低(FPKM<1),在H3不表达。ZjGH3-10、ZjGH3-14、ZjGH3-15、ZjGH3-18和ZjGH3-19五个基因在枣果实发育的3个时期均表达,但表达量较低(FPKM<1)。ZjGH3-5、ZjGH3-6、ZjGH3-7、ZjGH3-8、ZjGH3-11和ZjGH3-12六个基因从H1到H3时期表达量逐渐降低,ZjGH3-5、ZjGH3-6、ZjGH3-7和ZjGH3-8四个基因表达量较高,ZjGH3-11和ZjGH3-12基因表达量较低。ZjGH3-4、ZjGH3-16和ZjGH3-17三个基因的表达量随果实的发育从H1到H3时期均表现出逐渐升高的趋势,ZjGH3-4基因在H1时期不表达,到H2时期开始表达,但在H2和H3两个时期表达量均较低(FPKM<0.1),ZjGH3-16和ZjGH3-17两个基因的表达量在三个时期均较高,且从H1到H3基因表达量升高的幅度较大。

图5 不同发育时期枣果实中GH3基因表达分析Fig.5 Expression analysis of GH3 genes during fruit development stages
3 讨 论
GH3基因家族是一类重要的生长素响应基因,且具有GH3蛋白保守结构域,编码生长素酰胺合成酶催化自由态IAA与氨基酸偶联反应转换为结合态生长素,使之失活,以维持植物体内自由态生长素的动态平衡[14]。通过对GH3基因家族成员的全面分析,有助于揭示GH3基因在植物生长发育过程中的作用机制,对于枣生长发育的调控具有重要意义。目前,在众多植物中已经对GH3基因家族成员进行鉴定,包括桃(8个)[19]、茶树(20个)[20]、苹果(15个)[21]、番茄(15个)[22],在桃的研究中,8个桃GH3基因所编码的氨基酸长度在574~614 aa,且全都为酸性蛋白[19]。在茶树的研究中,20个茶树GH3基因所编码的氨基酸长度在246~774 aa,且大部分为酸性的亲水性蛋白,并被定位在细胞质和细胞核上[20]。本研究共鉴定得到19个枣GH3基因,基因数量与他物种相比较多。通过对枣GH3基因理化性质分析后发现19个枣GH3基因所编码的氨基酸长度在149~629 aa,但大部分家族成员所编码的氨基酸长度基本均在600 aa左右,且为酸性的稳定蛋白,并被定位在细胞质上,所有成员均为亲水性蛋白。本研究结果基本与前人的研究结果一致。基因重复事件在新基因扩展和新功能中发挥着不可或缺的作用,它包括了染色体的大片段复制和串联重复事件。枣的19个GH3基因虽然不存在大片段复制事件,但是包含了8对串联重复事件,这是枣GH3基因家族数量扩张的重要原因。启动子对基因的转录起始具有重要作用,启动子区域含有一系列基本作用元件,它们能够反映基因的潜在功能,由此可以推断出该基因的作用。基因的表达或转录由上游的启动子区域来完成,起始位点位于上游几百或几千bp[23]。启动子顺式作用元件分析有利于预测其在各种刺激或激素下的表达情况。通过对枣19个GH3基因家族成员的启动子分析发现,所有基因均含有与激素相关的顺式作用元件,多数基因含有茉莉酸甲酯响应元件(CGTCA-motif和TGACGmotif)、赤霉素响应元件(P-box)和脱落酸响应元件(ABRE),少数基因含有生长素响应元件(TGAelement和AuxRE)。这也说明枣GH3基因广泛参与激素相关的响应,表明在许多激素信号通路中起到了重要作用。同时这结果也与水稻和棉花的研究结果一致[24]。导致这一结果的原因可能是生长素响应元件的存在和缺失与大多数GH3基因的诱导或缺失存在着重要的关系[25]。同时还分析得到响应生长发育和胁迫等相关的顺式作用元件,包括低温、机械损伤和分生组织、栅栏叶肉组织等。在茶树的研究中发现,20个茶树GH3基因也分析得到与防御和应急、干旱、低温和机械损伤等胁迫响应元件以及胚乳、分生组织等表达的生长发育元件[20]。
为了进一步研究枣GH3基因的进化关系,根据拟南芥的功能对枣GH3家族成员的功能做了初步预测。AtGH3-6基因通过调控生长素浓度影响了拟南芥茎细胞的发育,其过表达株系显示出更短的下胚轴,叶片形态也会发生显著变化[26]。GH3-9基因通过调节生长素的浓度及活性影响了拟南芥初生根的生长与发育[27]。依据进化树结果可知,ZjGH3-10与AtGH3-9关系最近,ZjGH3-18和ZjGH3-19与AtGH3-6被聚在一起,可依次来推测ZjGH3-10基因可能影响枣根系的生长发育,ZjGH3-18和ZjGH3-19可能对枣茎和叶片的生长有影响。近年来随着对GH3基因研究的逐步深入,发现GH3基因对生长信号转导途径、生长素与其他激素信号之间的互作及在植物生长发育等方面都具有重要的作用。在桃的研究中发现,PpGH3-1,PpGH3-2,PpGH3-3,PpGH3-4和PpGH3-5参 与调节生长素动态平衡来控制桃果实各个时期的发育,PpGH3-3和PpGH3-4在桃果实成熟阶段的表达量明显上调,它们可能参与了桃果实的成熟[19]。在葡萄的研究中发现,VvGH3-1基因的表达在果实成熟期增加,提示该基因可能参与了低浓度IAA诱导果实衰老的建立和维持过程,与果实生长发育密切相关[28]。在番茄的研究中发现,虽然大多数SlGH3基因在果实成熟初期没有作用,但是SlGH3-1和SlGH3-2在果实成熟初期的表达上调,表明这两个基因可能在果实成熟过程中发挥作用[22]。本研究通过表达分析发现,ZjGH3-16和ZjGH3-17随‘壶瓶枣’果实发育表达量逐渐升高,在果实成熟期(H3)表达量上调,在‘壶瓶枣’果实发育的白熟期、半红期和全红期呈现出明显的规律且表达量均较高,推测ZjGH3-16和ZjGH3-17基因可能与果实发育存在一定的关系。本研究鉴定了枣GH3基因家族成员,并对做了理化性质、分类、基因结构、保守基序、启动子顺式作用元件和表达模式进行了全面的分析,但ZjGH3基因在果实发育过程中的表达分析时只选用了‘壶瓶枣’这一个品种,虽然目前‘壶瓶枣’栽培面积很广,但由于枣品种众多,‘壶瓶枣’虽然具有一定的代表性,但只限于这一个品种也存在一定的局限性,并且通过表达分析后筛选出来的关键基因的功能没有得到进一步验证。基于以上结果,在未来的研究中,要在栽培面积达到一定规模,对具有代表性的多个枣品种在果实发育期进行ZjGH3基因的表达分析,对确定的候选基因进行克隆及功能验证。
4 结 论
基于枣全基因组数据,本研究共鉴定得到19个GH3基因并将其分成了三大类,每个类别中的基因结构和保守基序较为一致。19个GH3基因共分析得到8对基因复制事件,且均为串联重复事件,这是枣GH3基因家族成员扩张的直接原因。枣GH3基因启动子区域有多个与激素和生长发育相关的顺式元件,可能是GH3基因参与生长发育的因素并依据表达分析推测ZjGH3-16和ZjGH3-17两个基因参与枣果实生长发育。

