油茶节律基因LHY的克隆及其在外源激素处理下对光合作用的影响
何之龙,张 震,许彦明,王 瑞,王湘南,陈永忠
(湖南省林业科学院,湖南 长沙 410004)
油茶Camellia oleifera作为我国主要的经济树种之一[1],以其良好的适应性与经济价值,在我国南方广大红壤丘陵地区有广泛种植[2]。按照2019年全国油茶产业发展现场会上国家林业和草原局提出的油茶发展规划,我国油茶面积将从现有的10.2万hm2发展到13.5万hm2,未来5年计划新造油茶林3万hm2,加上近6万hm2的低产林亟需品种改造,优良油茶品种的需求巨大。长期以来我国油茶品种的选育进展缓慢,如何突破油茶高效育种技术的瓶颈,提高油茶良种选育的效率,培育聚合高产、优质、高抗等多目标性状的新品种,是油茶育种工作者关注的热点问题[3]。
植物自身具有内源性的生物钟系统,在植物从萌发、营养生长、生殖生长到授粉等的整个生命循环中,生物钟系统广泛地调控了植物自身的生理、代谢和发育的过程,使这些生命活动能在最佳时间发生[4]。其中一些发育过程是在日周期的基础上直接受到生物钟系统调控的;其他一些发育过程是在年周期的基础上,通过生物钟系统检测日照时长的变化,从而受到调控。高等植物的生物钟系统由输入途径、振荡器、输出途径3个主要部分构成。输入途径参与环境信号的感知和传输;振荡器是生物钟系统的核心,负责产生和维持节律;输出途径将振荡器产生的节律同步传递到下游的植物代谢和生理过程[5]。振荡器作为高等植物生物钟系统的最为核心的组成元件,由昼夜循环的转录抑制回路组成,在这个回路中的元件通过正向或者逆向调控振荡器中其他元件的表达来调节自身的表达[6]。节律基因LHY是MYB家族转录因子,其编码的蛋白质是高等植物生物钟系统核心振荡器中维持日间循环的一个重要组成部分[7]。
光合作用是植物积累生物量最主要的途径,通过改良植物本身光合作用效率来提高产量的育种方法被称为高光效育种[8]。目前,油茶主要以经济性状等作为主要育种指标[9],虽然关于油茶光合作用的研究已经有一些报道,但是这些研究主要集中在光合作用日动态模式、不同品种间光合效率差异以及不同环境胁迫下的光合作用响应等方面[10-11]。本研究中从昼夜节律切入,采用同源克隆技术[12]获得油茶节律基因LHY的cDNA全长序列,利用不同植物激素对油茶节律基因LHY的表达调控作用,研究节律基因的表达与油茶光合作用强度的相关性,解析油茶节律基因表达调控光合作用的机制,旨在为油茶的高光效育种研究提供新的思路。
1 材料与方法
1.1 试验材料
以油茶良种‘湘林210’的2年生嫁接苗为试验材料,置于人工气候箱模拟的中日照环境下培养。24 h的循环条件:从6:00开始,以10 000 lx光照强度在30 ℃下培养12 h;从18:00开始,以无光照条件在28 ℃下培养12 h。经过为期1周的适应性培养后,分别选取5株长势相同的幼苗作为生物学重复。分别使用100 μg/L脱落酸(abscisic acid,ABA)和100 mg/L赤霉素(gibberellin,GA)溶液在光照开始时(6:00)对幼苗进行叶面喷施处理,并设置以蒸馏水喷施为对照组。
1.2 试验方法
1.2.1 基因片段克隆
在24 h的培养周期内每隔6 h取油茶苗木幼嫩叶片作为样本,用蒸馏水洗净后放入液氮进行速冻,提取植物叶片样本的总RNA并反转录合成cDNA第1链,反转录cDNA直接用于油茶LHY基因序列片段PCR扩增反应。根据叶片转录组测序数据,设计油茶LHY基因序列片段克隆引物(CoLHY-sense:5′-CTGCCTTGG TCCATCACA-3′;CoLHY-antisense:5′-GGCCCAT TCATTTCCTTG-3′),将早晨(6:00)、中午(12:00)、傍晚(18:00)和午夜(24:00)4个时间点叶片样本的cDNA第1链等量混合作为模板,进行油茶节律基因LHY序列片段PCR扩增反应,采用1.0%的琼脂糖凝胶电泳检测PCR产物,并以DL2000 DNA Marker指示PCR扩增产物大小,选择符合预期长度的特异性扩增条带进行纯化与回收。目的片段经加A尾处理后连接pMD18-T(TaKaRa)载体,采用冻融法转化JM109感受态细胞,涂布平板培养基后在37 ℃下暗培养24 h,经蓝白斑筛选阳性克隆,转接液体LB培养基后培养2 h,取吸光度值约为0.6的菌液进行质粒提取并测序。
1.2.2 基因片段序列分析
通过NCBI数据库在线进行Blast比对,筛选与目的基因编码的氨基酸序列相似性较高的其他物种氨基酸序列,使用MEGA5软件将各物种的氨基酸序列进行多序列比对,并构建系统进化树;使用ORF-finder在线分析软件预测目的基因的开放读码框,在Expasy数据库(http://au.expasy.org/tools/)中使用ProtParam软件和ProtScale软件分别进行氨基酸序列特征的预测分析,使用SOPMA在线分析软件进行二级结构等的预测。
1.2.3 光合作用指标测定
经人工气候箱模拟的日照光周期适应培养1周后,于处理前48 h内从6:00起每隔6 h以及处理后0、2、4、6、8和10 h,分别用LI-6400XT型光合仪,在每株幼苗顶端部位选取3片健康的1年生叶片进行光合参数测定,空气流量设为500 μmol/s,光强设为1 000 μmol/(m2·s),CO2气体由小钢瓶提供,控制摩尔分数为400 μmol/mol。
1.2.4 荧光定量PCR分析
在进行光合作用指标测定的同时,取每株幼苗顶端部位3片成熟的新鲜叶片,经液氮速冻后,用CTAB法提取样品总RNA,cDNA第1链的合成和荧光定量PCR所用的试剂均购于宝日医生物技术(北京)有限公司,以ETIF3H基因为荧光定量PCR反应的内参基因,用2-ΔΔCT相对定量法分析油茶节律基因LHY在外源激素处理下表达模式。
2 结果与分析
2.1 油茶LHY基因同源序列片段的PCR扩增
以早晨(6:00)、中午(12:00)、傍晚(18:00)和午夜(24:00)4个时间点的油茶叶片样本总RNA的反转录产物等量混合作为模板,用CoLHY-sense/antisense引物进行PCR扩增。扩增产物经1.2%琼脂糖凝胶电泳,结果如图1所示。由图1可见,第1泳道检测到1条长度约2 500 bp(>2 000 bp)的特异扩增条带,与预测目的产物长度相符。
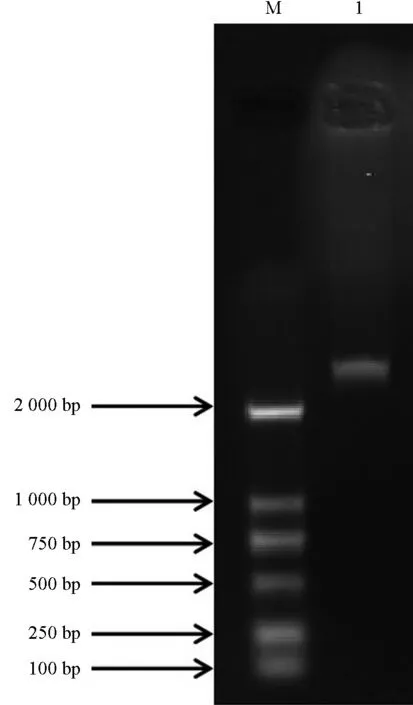
图1 油茶节律基因LHY序列片段PCR产物琼脂糖凝胶电泳结果Fig.1 Electrophoresis of PCR product of circadian gene LHY sequence fragment in C.oleifera
将含有目的片段重组质粒的阳性克隆提取质粒并测序,结果显示目的片段为2 565 bp的核苷酸序列,通过NCBI BLAST在线比对后发现,该目的片段核苷酸序列与茶树LHY基因同源性达到98%,覆盖率达89%;与中华猕猴桃LHY基因同源性达到73%,覆盖率达89%。将该目的片段使用在线工具ORF Finder进行开放阅读框预测,结果显示该序列包含1个长度为2 301 bp的编码序列(coding sequence,CDS),编码766个氨基酸,如图2所示。

图2 油茶LHY基因的核苷酸和氨基酸序列Fig.2 Nucleotide and amino sequences of LHY gene in C.oleifera
2.2 油茶LHY基因编码蛋白质的生物信息学分析
使用ProtParam tool在线分析软件预测油茶LHY基因编码蛋白质的氨基酸序列特征,其氨基酸组成见表1。预测的油茶LHY基因编码蛋白质的相对分子质量为83.88 kDa,分子式为C3617H5694N1062O1187S26,其 中Ser、Ala、Glu、Pro、Thr和Leu的占比较高,分别为10.40%、9.40%、7.60%、7.30%、6.80%和6.70%。油茶LHY基因编码蛋白质的不稳定指数和理论等电点分别为53.98和5.93,说明该蛋白质是不稳定的酸性蛋白。
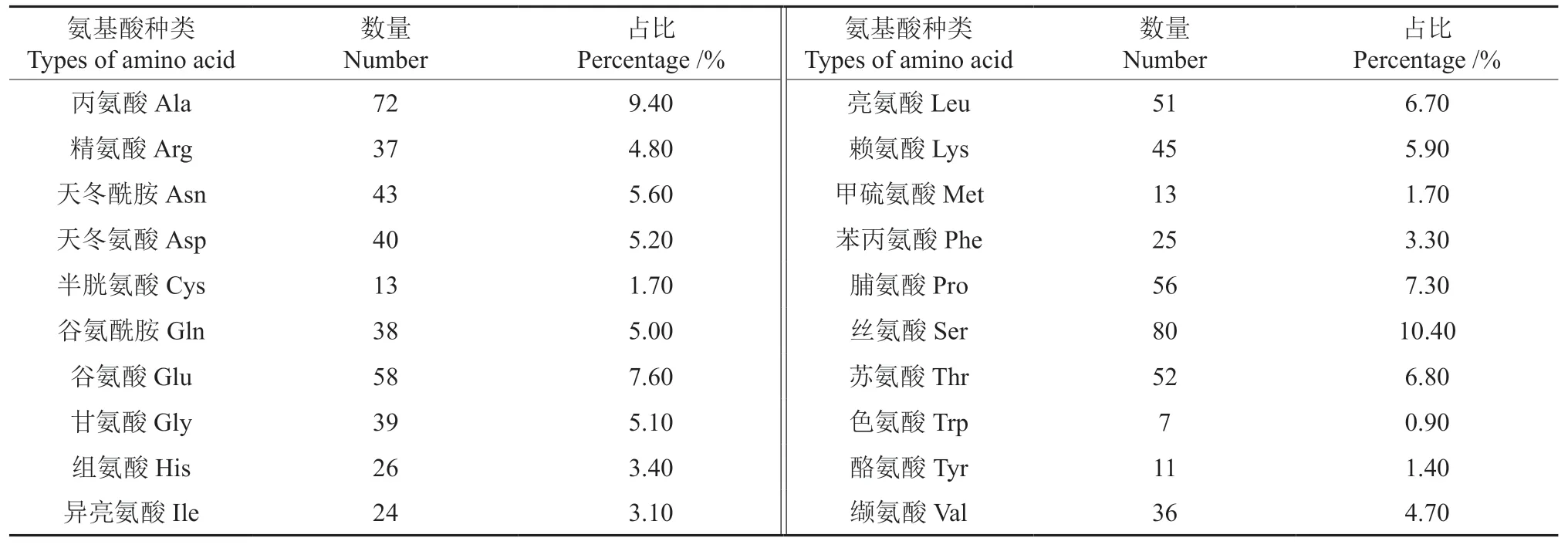
表1 油茶LHY基因编码蛋白的氨基酸组成Table 1 Amino acid composition of LHY gene encoding protein in C.oleifera
使用ProtScale在线分析软件对油茶LHY基因编码的蛋白质进行亲水性/疏水性预测,结果如图3所示。由图3可见,第446~449个氨基酸区域的疏水性最强,得分为2.089~2.100;第600~608个氨基酸区域的亲水性最强,得分为-3.600~-2.156,推测油茶LHY基因编码的蛋白质是亲水性蛋白质。

图3 油茶LHY基因编码蛋白的亲水性/疏水性预测结果Fig.3 Predicted distribution of hydrophilicity/hydrophobicity of LHY gene encoding protein in C.oleifera
使用SOPMA在线分析软件对油茶LHY基因编码蛋白质的二级结构进行预测分析,结果如图4所示。由图4可见,无规则卷曲(random coil)是油茶LHY基因编码蛋白质的二级结构的主要成分,占67.62%;其他结构中,α-螺旋(24.28%)、β-转角(2.09%)、延伸链(6.01%)散布于整个蛋白质中。

图4 油茶LHY基因编码蛋白质二级结构的预测结果Fig.4 Prediction of the secondary structure of LHY gene encoding protein in C.oleifera
2.3 油茶LHY基因编码氨基酸序列的比对及系统进化树构建
将预测的油茶LHY基因编码蛋白质的氨基酸序列提交NCBI进行在线Blast比对分析,选择其中显示同源比对相似性较高的19个物种LHY基因编码蛋白质的氨基酸序列,包括茶树C.sinensis(ARM20189.1)、中华猕猴桃Actinidia chinensis(PSS00200.1)、欧洲栓皮栎Quercus suber(XP_023925259.1)、柑橘Citrus sinensis(XP_006491389.1)、胡杨Populus euphratica(XP_011039461.1)、树棉Gossypium arboreum(XP_017637446.1)、核 桃Juglans regia(XP_018834196.1)、烟 草Nicotiana tabacum(XP_016450418.1)、芝麻Sesamum indicum(XP_020553443.1)、可可Theobroma cacao(XP_017979073.1)、葡萄Vitis vinifera(XP_010661511.1)、开 心 果Pistacia vera(XP_031251101.1)、蓖 麻Ricinus communis(XP_002515093.1)、橡 胶 树Hevea brasiliensis(XP_021676056.1)、川桑Morus notabilis(XP_024028464.1)、木槿Hibiscus syriacus(XP_039036712.1)、木薯Manihot esculenta(XP_021611101.1)、榴梿Durio zibethinus(XP_022757633.1)和枣Ziziphus jujuba(XP_015888949.1)。使用DNAMAN 6.0软件,将预测的油茶LHY基因编码蛋白质的氨基酸序列与筛选出的19个LHY基因编码蛋白质的氨基酸序列进行两两比对,结果显示这些氨基酸序列相似性为53.38%~91.06%。其中,相似性最高的是茶树LHY基因编码蛋白质,为91.06%;相似性最低的是烟草LHY基因编码蛋白质,为53.38%。使用MEGA5.1软件计算以上共计20个物种的LHY基因编码蛋白质的氨基酸序列的相似性,并采用Neighbour-Joining方法绘制系统进化树,结果如图5所示。由图5可见,油茶LHY基因与同为山茶属的茶树亲缘关系最近,与蓖麻和烟草亲缘关系较远。
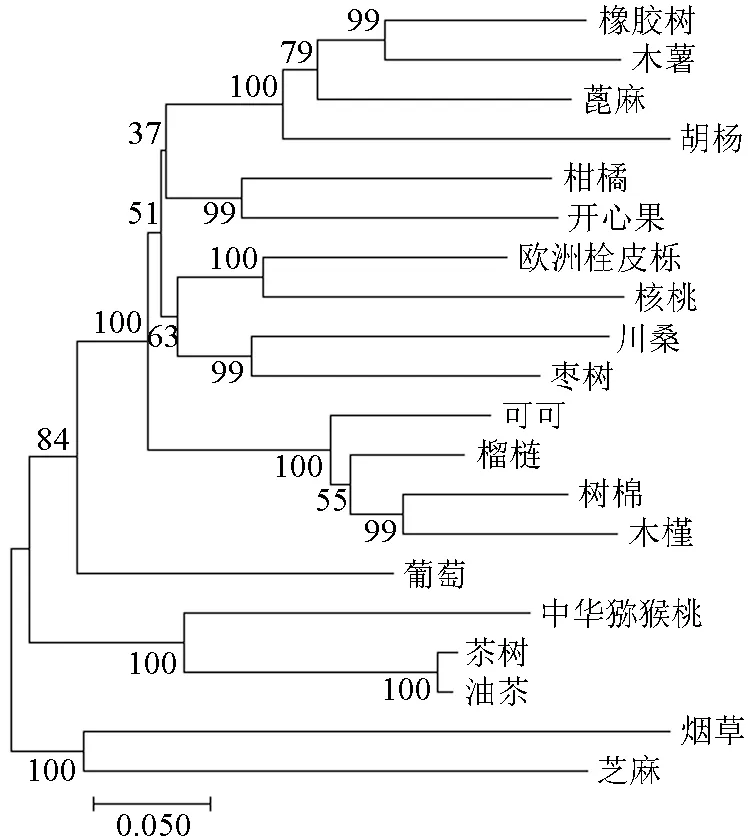
图5 油茶LHY基因编码氨基酸序列系统发育树Fig.5 Phylogenetic tree of LHY gene encoding amino acid sequence in C.oleifera
2.4 外源植物激素对油茶光合作用的影响
2.4.1 对净光合速率的影响
外源激素处理下油茶叶片净光合速率的变化如图6所示。

图6 外源激素处理下油茶叶片净光合速率的变化Fig.6 Net photosynthetic rate under exogenous hormones treatment in C.oleifera leaves
由图6可见,在通过人工气候箱模拟的中日照光周期环境下,对照组油茶幼苗叶片的净光合速率在光照开始后呈现先升、后降的趋势,光照持续2~4 h时净光合速率达到最大值。使用100 mg/L的GA溶液处理后,油茶幼苗叶片的净光合速率比对照组有显著升高,且仍保持先升、后降的趋势,光照持续6 h时净光合速率达到最大值,为7.38 μmol/(m2·s),相比对照组升高了19.09%。使用100 μg/L的ABA溶液处理后,油茶幼苗叶片的净光合速率比对照组有显著降低,从光照持续2 h时开始也呈现了先升、后降的趋势,光照持续4 h时净光合速率达到最大值,为5.91 μmol/(m2·s),相比对照组降低了7.32%。
2.4.2 对气孔导度的影响
外源激素处理下油茶叶片气孔导度的变化如图7所示。由图7可见,在通过人工气候箱模拟的中日照光周期环境下,对照组油茶幼苗叶片的气孔导度在光照持续0~6 h内无显著变化,光照持续8 h后开始下降。使用100 mg/L的GA溶液处理后,油茶幼苗叶片的气孔导度比对照组有显著升高,光照持续6 h后达到最大值,为0.079 mmol/(m2·s),相比对照组上升了34.91%。使用100 μg/L的ABA溶液处理后,油茶幼苗叶片的气孔导度较对照组有所下降,且在光照持续6 h时显著降低,为0.052 mmol/(m2·s),相比对照组下降了10.55%。

图7 外源激素处理下油茶叶片气孔导度的变化Fig.7 Stomatal conductance under exogenous hormones treatment in C.oleifera leaves
2.4.3 对胞间CO2摩尔分数的影响
外源激素处理下油茶叶片胞间CO2摩尔分数的变化如图8所示。由图8可见,在通过人工气候箱模拟的中日照光周期环境下,对照组油茶幼苗叶片的胞间CO2摩尔分数在光照开始后未表现出明显的变化趋势,在光照持续2~4 h内表现出不同程度的降低,然后恢复到光照开始时的水平。使用100 mg/L的GA溶液处理后,油茶幼苗叶片的胞间CO2摩尔分数在光照持续2~6 h内比对照组有显著升高,其中光照持续2 h时升高幅度最大,为231.22 μmol/mol,比对照组升高了32.64%,然后持续降低,在光照持续10 h时达到最小值,为184.19 μmol/mol。使用100 μg/L的ABA溶液处理后,油茶幼苗叶片的胞间CO2摩尔分数呈现出先降低、后升高的趋势,光照持续4 h时达到最小值,为185.71 μmol/mol,与对照组无显著差异,光照持续10 h时达到最大值,为243.33 μmol/mol,比对照组上升了12.60%。

图8 外源激素处理下油茶叶片胞间CO2摩尔分数的变化Fig.8 Intercellular CO2 mole fraction under exogenous hormones treatment in C.oleifera leaves
2.4.4 对蒸腾速率的影响
外源激素处理下油茶叶片蒸腾速率的变化如图9所示。
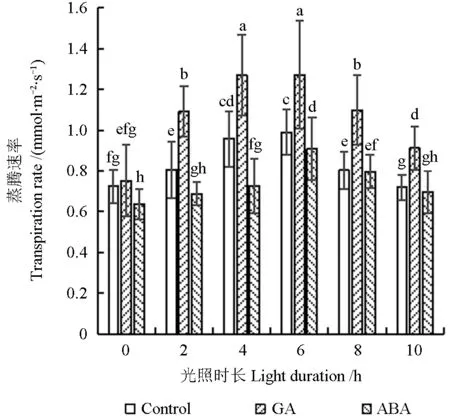
图9 外源激素处理下油茶叶片蒸腾速率的变化Fig.9 Transpiration rate under exogenous hormones treatment in C.oleifera leaves
由图9可见,在通过人工气候箱模拟的中日照光周期环境下,对照组油茶幼苗叶片的蒸腾速率在光照开始后呈现先升、后降的趋势,光照持续4~6 h时蒸腾速率达到最大值;使用100 mg/L的GA溶液处理后,油茶幼苗叶片的蒸腾速率比对照组有显著升高,且仍保持先升、后降的趋势,光照持续6 h时蒸腾速率达到最大值,为1.27 mmol/(m2·s),比对照组升高了28.75%。使用100 μg/L的ABA溶液处理后,油茶幼苗叶片的蒸腾速率比对照组有显著降低,光照持续2 h后也保持了先升、后降的趋势,光照持续6 h时蒸腾速率达到最大值,为0.91 mmol/(m2·s),比对照组降低了8.02%。
2.5 外源植物激素对油茶节律基因LHY表达的影响
在通过人工气候箱模拟的中日照光周期环境下,外源激素处理下油茶节律基因LHY表达水平的变化如图10所示。由图10可见,在不同处理下,油茶节律基因LHY的表达水平自光照开始呈现出持续上调的趋势,使用100 mg/L的GA溶液处理后上调幅度较大,使用100 μg/L的ABA溶液处理后上调幅度较小。光照持续10 h时,各处理组油茶节律基因LHY的表达水平均达到最大值,其中GA处理组比对照组上调152.75%,ABA处理组比对照组下调53.05%。

图10 外源激素处理下油茶叶片节律基因LHY表达水平的变化Fig.10 Relative expression of LHY gene under exogenous hormones treatment in C.oleifera leaves
3 结论与讨论
MYB家族转录因子LHY(late elongated hypocotyl)和CCA1(circadian clock associated 1)蛋白能够激活PRR9、PRR7和PRR5/NI(PSEUDORESPONSE REGULATORs 9, 7, 5/NIGHT INHIBITOR)等基因的表达;而PRR9、PRR7和PRR5/NI蛋白作为转录共调控因子,结合到LHY和CCA1等基因的启动子上,抑制这些基因的表达,由此构成的负反馈调节环被称为高等植物生物钟系统核心振荡器的日间循环[6]。本研究中采用RT-PCR技术获得了油茶LHY基因目的片段共2 565 bp,预测编码区序列为2 301 bp,编码766个氨基酸,相对分子质量约为83.88 kD。通过对油茶LHY基因编码氨基酸序列的分析,预测油茶LHY基因编码蛋白为具有亲水性的不稳定酸性蛋白质,其二级结构以无规则卷曲结构为主。经过对油茶LHY基因编码蛋白质的氨基酸序列同源性的比对和系统发育树分析,结果表明该基因编码蛋白质与茶树LHY基因编码蛋白质的氨基酸序列的同源性最高,相似性为91.06%。
油茶的净光合速率等光合作用指标在一天当中呈现先升、后降的“单峰”曲线[10],或受午间光抑制呈现“双峰”曲线[11],除光照、温度等环境因素对光合作用具有一定程度的影响外,植物本身的生物钟系统也是导致光合作用呈现周期性振荡的重要因子。基于生物钟系统揭示植物生长发育过程中优势形成的机制是一个全新的思路和尝试,关于拟南芥二倍体和异源四倍体杂交种的研究结果解释了杂交种的生长活力增强和生物量增加的机制:正确的生物钟节律增强了适应性和新陈代谢[13-14]。二倍体种间杂种和异源多倍体通过表观调控和自主调节协调了来自父母本的节律基因的同步性并增强其表达,大幅度地调控了下游靶基因的表达水平,如光合作用和糖代谢基因的表达幅度和代谢通量、抗逆相关基因的表达通量,从而获得生长优势。拟南芥的相关研究揭示了生物钟系统核心振荡器影响到生物钟的节奏、幅度、周期和输入/输出途径,至少包括光合作用与糖代谢在内的15%的基因及其90%的转录组受到生物钟的控制[13],维持节律调控促进了CO2固定和植物生长,反之则降低适应性[14]。此外,研究者从气孔活动和光合作用中发现生物钟系统对细胞水平生物过程的调控[15],白天拟南芥叶片的气孔导度高于晚上,在景天酸代谢的植物中则相反[16]。拟南芥中参与光合作用光捕获过程的相关基因表达水平受到生物钟系统的调控,番茄中参与光合作用的叶绿素a/b结合蛋白(chlorophyll a/b binding protein)和核酮糖1,5-二磷酸羧化酶/加氧酶激活酶(rubisco activase)的蛋白表达水平与mRNA表达水平也均受到生物钟系统的调控[17]。豆类和棉花的相关研究结果表明,光合色素的组成即使在持续的光照或黑暗中仍保持节律性振荡,说明光合色素的组成也处于昼夜节律调节之下[18]。除了参与光合作用的基因,一些参与光呼吸、糖代谢以及运输的基因同样受到生物钟系统的调控[19]。
植物生物钟系统核心振荡器日间元件LHY的编码基因通常在光照条件下表达水平较高。因此,本研究中通过人工施加外源植物激素对节律基因表达水平进行调控,分析日间光照环境下,外源植物激素处理下油茶节律基因LHY与光合作用间的关系。结果表明,施加一定浓度外源GA和ABA的信号均对油茶幼苗的光合作用生理指标和节律基因LHY表达有显著调控作用。100 mg/L的GA溶液处理在中日照光周期中能显著提高净光合速率、气孔导度和蒸腾速率,并在一定程度上促进LHY基因表达;100 μg/L的ABA溶液处理在中日照光周期中能显著抑制净光合速率和蒸腾速率,并在一定程度上抑制LHY基因表达。
GA和ABA均是重要的植物激素,其信号转导途径在植物整个生长发育过程中均能参与到许多生命过程的调控当中。有研究结果表明,GA和ABA含量均表现出随着昼夜节律而波动[20-21]。此外,还有报道表明,受GA和ABA诱导的基因随着生物钟基因节律性波动[21-22]。本研究中仅从基因表达水平分析了油茶节律基因LHY与光合作用直接的关系,为了解析油茶生物钟系统参与调控光合作用的内在机理,后续将对油茶节律基因LHY参与光合作用途径调控的直接作用机制以及调控靶基因开展深入研究。

