镉胁迫下桑树根际土壤微环境应激响应特征
胡桂萍,曹红妹,王亚威,叶 川,石旭平,蔡 翔,王礼献,张国彪
(江西省蚕桑茶叶研究所/江西省经济作物研究所,江西 南昌 330202)
【研究意义】2014 年,环境保护部和国土资源部发布了全国土壤污染状况调查公报,结果显示全国土壤点位超标率为16.1%,以无机型污染为主、其中镉(Cd)的点位超标率高达7.0%。土壤重金属污染严重危及农产品安全,已成为世界范围内最为严峻的环境问题之一,亟需治理与修复[1]。而多年研究和生产实践证实植物修复是重金属污染土壤修复的有效途径之一,其中生物量大、重金属耐/抗性强、环境适应性强、产品不进入人类食物链、可带来经济效益的收益型作物在重金属污染耕地修复推广中显示出巨大应用前景,筛选利用收益型经济作物及其修复增效措施的遴选和配置将是收益型作物重金属修复产业化推广应用的重要关键点。【前人研究进展】在植物修复体系中,根是土壤重金属进入植物体内的主要通道和屏障[2-4],与此相匹配的根际环境因子则是影响植物抗逆和调控重金属富集的关键。而且植物根际土壤化学因子、物理特征以及生物因子间非独立作用,而是交互关联和相互耦合,共同诱导根际土壤中氧化还原、金属络合等反应和发生特征,影响重金属离子存在形态及生物毒性,决定了重金属在土壤-植物中的迁移转化行为[5-7]。同时,也有研究人员研究发现植物修复通过协同物理、化学、生物等辅助措施[8-10],可有效调节修复植物根际环境酸碱度、土壤微生物群落结构等,从而提高土壤中重金属生物有效性,加速重金属的植物修复效率,这也是未来植物修复增效技术的重要方向。因此,深入解析修复植物重金属胁迫过程中的根际环境中物理、化学和生物等因子演变特征,可为进一步揭示重金属污染植物修复机制提供支撑,也为挖掘和开发重金属植物修复辅助提升技术和措施提供依据和思路。【本研究切入点】桑树为多年生木本植物,其生物量大、根系发达,具有抗旱和耐酸、碱、盐及重金属等能力,近几年大量研究和评价,发现桑树是一种具优异Cd 修复潜力的物种,已初步阐释了桑树Cd 胁迫下的生长和生理响应特征、Cd 在桑树体内的迁移和分布特征、Cd 在桑-蚕系统安全性、桑树修复后复垦土壤中Cd 形态特征与微生物特征[11-16]。但桑树重金属修复周期长,见效慢,如何快速提升桑树重金属修复效率是实现其产业化推广的关键。【拟解决的关键问题】基于此,本实验通过盆栽实验分析不同镉污染水平胁迫下桑树根际土壤环境特征应激演变特征,从而明晰桑树根区响应镉胁迫的土壤微环境特征,为寻找桑树原位修复镉污染增效措施提供参考。
1 材料与方法
1.1 桑树品种和供试土壤
桑树品种为粤桑11号,为耐Cd生态型品种,产地为广东,供试苗为2年生实生苗;供试土壤:试验所用土,采集于南昌县郊区农田,为红壤土,理化性质如下:pH 5.02、碱解氮108.50 mg/kg、有机质2.96 g/kg、速效磷0.003 2 g/kg、全钾68.57 g/kg,镉含量未检出,土壤质量达到国家三级标准(GB 15618—2018)。
1.2 实验设计和样品采集
采用盆栽试验,以国家土壤质量标准为参照,并模拟现实土壤Cd污染状况,分别设置重度、中度、轻度污染3种Cd浓度,其中重度Cd浓度为5 mg/kg、中度Cd浓度为3 mg/kg、轻度Cd浓度为2 mg/kg,且设置未污染土壤作为空白对照,分析不同Cd 浓度胁迫下,桑树雀口期(开一叶为准)、缓慢生长期(开三叶为准)、旺盛生长期(开八叶为准)根际微生态环境化学特征(Cd 含量、Cd 形态、pH 值、有机质、全碳、全氮、全磷)、生物学特征(微生物碳量、微生物氮量、土壤蔗糖酶、土壤脲酶、土壤氧化还原酶、土壤纤维分解强度、土壤呼吸强度)。盆栽花盆上下外口径为35 cm 和24 cm、高为32.5 cm,每个花盆所用土壤质量为18 kg,所用桑树长势均一致,均为2年生苗,生长环境采用人工培养箱统一控制,温度为(25±2)℃,光照强度为3 600 lx,光照时间为12 h,且土壤保持土壤湿度为70%,每个处理均栽植30 株。当桑树生长至雀口期、缓慢生长期、旺盛生长期时开始采集桑树根际土、根系和地上部分用于检测,采集方法参照徐宁等[14]加以修改,每个处理每次采集3株。
1.3 指标检测及检测方法
土壤pH测定采用玻璃电极法;土壤有机质用重铬酸钾容量法;土壤全氮用K2SO4-CuSO4-Se催化-凯氏定氮法;土壤全磷、全钾采用HF-HNO3-HClO4消化,分别用比色法、原子吸收光谱法测定;土壤有效磷用0.5 mol/L NaHCO3提取-比色法;有效钾用1 mol/L NH4OAc(pH 7.0)提取、原子吸收光谱法测定。
土壤和根系Cd含量采用消煮法、ICP-MS 测定。土壤中Cd形态分析重金属形态分布测定采用Tessier 提取法,分别提取土壤重金属的可交换态(EXC-Cd)、碳酸盐结合态(CAB-Cd)、Fe-Mn 氧化态(FMOCd)、有机态(OM-Cd)和残渣态(RES-Cd);土壤Cd 有效态采用0.005 mol/L DTPA 提取剂提取、电感耦合等离子体发射光谱仪(ICP-AES)测定。
土壤蔗糖酶用靛酚蓝比色法、脲酶活性用3,5-二硝基水杨酸比色法、碱性磷酸酶活性用磷酸苯二钠比色法、过氧化氢酶的酶活性用高锰酸钾滴定法;土壤呼吸强度采用静态碱液吸收法测定土壤CO2释放量;土壤硝化强度采用悬浮液培养法测定。
1.4 数据统计分析
数据采用Excel 2010和DPS 9.0统计分析,方差分析采用单因子方差分析(Fisher’s LSD test),柱状图采用origin9.0软件绘制,相关分析采用DPS9.0软件进行,主成分分析(PCA)采用Canoco 4.5 软件进行;以镉胁迫处理下的桑树根际土壤为样本,以土壤中各化学形态镉含量(全量(TOTAL-Cd)、可交换态(EXCCd)、碳酸盐结合态(CAB-Cd)、Fe-Mn 氧化物结合态(FMO-Cd)、有机物结合态(OM-Cd)、残渣态(RESCd))、土壤脱氢酶、土壤过氧化氢酶、土壤尿酶、土壤蛋白酶、土壤呼吸强度、土壤纤维分解强度、土壤微生物生物碳含量和土壤微生物生物氮含量为变量,构建镉胁迫下的桑树根际土壤微环境特征矩阵,分别进行Pearson相关分析和PCA分析。
2 结果与分析
2.1 桑树镉富集能力动态变化特征
桑树镉富集能力动态变化特征见图1。图中可知,在轻度Cd 污染浓度、中度Cd 污染浓度和重度Cd污染浓度胁迫下,富集到桑树根部Cd浓度随着桑树生长呈上升趋势,其中雀口期根部Cd浓度最低,分别为0.64、0.76、1.49 mg/kg,缓慢生长期根部Cd 浓度有所提高,分别为0.84、0.89、1.56 mg/kg,旺盛生长期根部Cd 浓度最高,分别为0.97、1.03、1.73 mg/kg;同期条件下,桑树茎部和叶部Cd 浓度则显著低于根部,85%的Cd存在于根部,表明桑树修复土壤Cd主要以根部富集为主。

图1 Cd胁迫浓度对桑树Cd富集和转移的影响Fig.1 The effect of Cd stress on the bioaccumulation and transfer of Cd in the plant of Mulberry
2.2 镉胁迫对桑树根际土壤化学因子响应特征
图2显示镉胁迫下,桑树根际中土壤中镉赋存形态的响应特征,结果显示以EXC-Cd含量最高,其次为FMO-Cd,接着为CAB-Cd 和RES-Cd,最低为OM-Cd;桑树根际土壤中这5 种赋存形态镉含量均随着镉胁迫浓度的升高而增加,且桑树根际土壤中这5 种镉赋存形态含量与桑树生长时期有关,以雀口期最高,其次为缓慢生长期,最低为旺盛生长期。

图2 Cd胁迫对桑树根际土壤中Cd形态的影响Fig.2 The effect of fractions of Cd in the rhizospheric soils of Mulberry
Cd 胁迫对桑树根区土壤化学因子指标影响见图3。轻度Cd 污染浓度、中度Cd 污染浓度和重度Cd污染浓度胁迫下,桑树3个生长时期(雀口期、缓慢生长期和旺盛生长期)下根际土壤pH值、有机质含量、碱解氮含量均低于对照;轻度和中度Cd 污染浓度胁迫下,桑树3 个生长时期的根际土壤速效磷、全钾和速效钾含量高于对照,而重度Cd污染胁迫的低于对照。

图3 镉胁迫对桑树根区土壤化学因子的影响Fig.3 The effect of Cd stress on the chemical factor of rhizosphere soil of mulberry
2.3 Cd胁迫下桑树根系土壤生物因子响应特征
镉胁迫对桑树根系土壤酶活的影响见图4。结果显示,各处理下,桑树根系土壤中微生物土壤脱氢酶、过氧化氢酶、脲酶、蛋白酶均随着桑树生长而呈现增长趋势;同期条件下,中度镉浓度和轻度镉浓度胁迫下的根系土壤脱氢酶、过氧化氢酶、脲酶、蛋白酶均显著高于对照,且中度镉浓度胁迫下的高于轻度镉胁迫,而重度镉浓度下的根际土壤根系土壤脱氢酶、过氧化氢酶、脲酶、蛋白酶浓度均显著低于对照。

图4 镉胁迫对桑树根系土壤酶活的影响Fig.4 The effect of Cd on the soil enzyme activities in rhizosphere of mulberry
镉胁迫对桑树根际土壤微生物生物量的影响见图5。4 个处理,桑树根际土壤微生物生物量碳和微生物生物量氮含量均呈现雀口期含量最低、缓慢生长期上升、旺盛生长期含量最高的特点;桑树同一生长时期下,4个处理中,桑树根际土壤微生物碳含量和生物氮含量以中度镉浓度胁迫下的为最高,其次为轻度镉浓度胁迫,再次为对照处理条件,最低的为重度镉浓度胁迫。
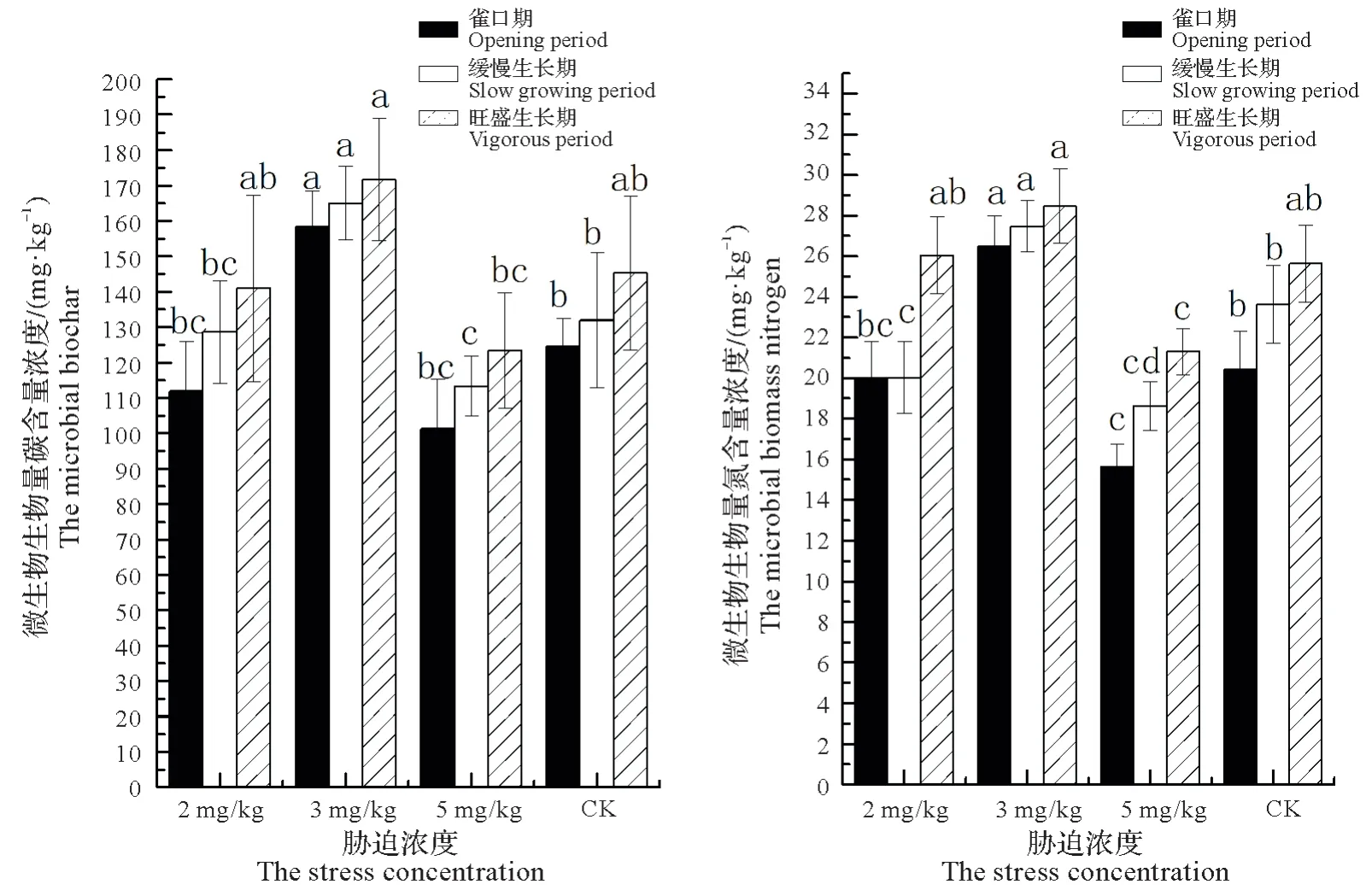
图5 镉胁迫对桑树根际土壤微生物生物量的影响Fig.5 The effect of Cd on the soil microbial biomass in rhizosphere of mulberry
镉胁迫对桑树根际土壤呼吸强度和土壤硝化作用强度的影响见图6。图6显示,轻度镉污染和中度镉污染胁迫下桑树3个时期根际土壤呼吸强度均显著高于对照,而重度镉污染胁迫下桑树3个时期根际土壤呼吸强度均低于对照,差异显著。与对照相比,轻度、中度镉污染胁迫下,桑树3 个时期根际土壤硝化作用强度均呈显著增强,且中度镉胁迫高于轻度镉胁迫;重度镉污染胁迫下,桑树3个时期根际土壤硝化作用强度均呈显著减弱。

图6 镉胁迫对桑树根际土壤呼吸强度和土壤纤维分解强度的影响Fig.6 The effect of Cd on the soil respiration intensity and fiber decomposition strength
2.4 镉胁迫下的桑树根际土壤环境因子间耦合响应
通过对土壤化学因子和生物因子Pearson 相关分析诠释镉胁迫下的桑树根际土壤环境因子间耦合响应,结果见表2。其中,土壤中全镉含量与土壤pH 和微生物生物量氮含量呈显著负相关,相关系数分别为-0.57 和-0.51,与土壤有机质、碱解氮和速效钾含量呈极显著负相关,相关系数分别为-0.75、-0.70 和-0.69,而与土壤脱氢酶和氧化还原酶呈极显著正相关和显著正相关,相关系数分别为0.73 和0.62;可交换态镉与有机质、碱解氮和微生物生物量氮含量呈显著负相关,相关系数分别为-0.56、-0.56 和-0.59,与速效钾含量呈极显著负相关,相关系数为-0.77,与土壤脱氢酶和氧化还原酶呈显著正相关,相关系数分别为0.66 和0.59;碳酸盐结合态镉与有机质、碱解氮、速效磷、速效钾呈显著负相关,相关系数分别为-0.56、-0.64、-0.56 和-0.67,与土壤脱氢酶呈显著正相关,相关系数为0.60;铁锰氧化物结合态镉与有机质、碱解氮、速效钾呈显著负相关,相关系数分别为-0.71、-0.68和-0.58,与土壤脱氢酶和氧化还原酶呈极显著正相关,相关系数分别为0.80 和0.73;有机结合态镉与pH 值、有机质和微生物生物量氮含量呈极显著负相关,相关系数分别为-0.86、-0.70 和-0.76;残渣态镉与速效钾、微生物生物量氮含量呈极显著负相关,相关系数分别为-0.75 和-0.82,与pH 值呈显著负相关,相关系数为-0.62。

表2 镉胁迫下桑树根际土壤镉赋存形态含量与环境因子之间的相关性Tab.2 The correlation between content of occurrence cadmium and micro-environmental factors in the soil stressed by Cd
同时对镉胁迫下桑树根际土壤环境因子进行PCA 分析(图7),也显示3种镉胁迫浓度作用下的桑树土壤环境特征均位于在PC1轴上得分均为负方向,CK位于PC1轴正方向,且不同镉污染浓度间的桑树土壤环境特征明显分离,代表各镉污染浓度胁迫下的土壤微环境特征指标相关的主成分1(PC1)、主成分2(PC2),可分别解释变量方差的73.6%和14.8%。从PC1轴的辅助因子组成来看,PC1主要反应了土壤理化性质和肥力指标,如pH 值、有机质、碱解氮、全钾、速效钾、速效磷,而PC2 主要代表了土壤酶活、各形态镉含量、微生物生物量碳含量和微生物生物量氮含量。

图7 镉胁迫下的桑树根际土壤微环境特征响应的主成分分析Fig.7 The principal component analysis(PCA)of rhizosphere soil micro-environmental feature stressed by Cd
3 结论与讨论
本研究中盆栽桑树在3 种镉浓度(2,3,5 mg/kg)胁迫下,桑树对Cd 富集能力与桑树生长情况有密切关联,其中桑树根部镉富集量随桑树生长呈上升趋势,以旺盛生长期最高、其次为缓慢生长期、最低为雀口期,这可能与桑树根系发育特征相关,桑树雀口期根系短少,而旺盛生长期根系深厚庞大[17];同期条件下,桑树茎部和叶部Cd 浓度则显著低于根部,85%的Cd 存在于根部,表明桑树修复土壤Cd 主要以根部富集为主,富集效率与植株生长时期和土壤中的镉污染水平有关,这与潘雨齐等[11]、Dai 等[18]的研究结果一致。本研究中桑树在与镉胁迫相互作用下,根际土壤Cd 以交换态EXC-Cd 含量最高,其随着镉胁迫浓度的升高而增加且也随着桑树生长而降低,表明桑树根系对于镉胁迫有激活土壤Cd 向生物有效性转化的应激作用,也进一步体现桑树富集Cd 的作用功能,这与其他重金属超富集作物上富集重金属的作用方式类似[19-22]。与对照相比,3 种镉浓度胁迫下桑树根际土壤中pH 值、有机质、碱解氮含量均低于对照,这也是镉污染会导致土壤酸化、有机质下降的现实影响因素。但速效磷、全钾和速效钾方面,本实验显示中轻度镉浓度胁迫高于对照,重度镉浓度胁迫低于对照,表明速效磷、全钾和速效钾与土壤中Cd 的浓度有密切关系,这与张水勤等[23],曾露苹等[24]和陈红纯等[25]结论相类似,但与依艳丽等[26]研究结论不一致。
一般而言,重金属进入土壤系统内,会显著影响微生物的生长繁殖,刺激或抑制土壤营养转化活性,导致土壤营养库、土壤呼吸强度和硝化作用强度[27-28]、土壤酶活性变化[29-32]。本研究中,轻度和中度Cd污染浓度胁迫可提高桑树根际微生物生物碳和生物氮、土壤呼吸强度、土壤硝化作用强度均高于对照,而重度Cd 污染胁迫下的低于对照,表明中低度镉胁迫可显著刺激桑树土壤化学因子和生物因子,实现Cd的有效修复,但是重度镉胁迫下,桑树土壤化学和生物因子受到抑制,Cd修复效率有待提高,这可能与土壤中Cd 污染水平有关,也可能与桑树根系分泌作用的结果有关。韩桂琪等[33]通过室内培养试验发现重金属Cd 污染对微生物生物量的影响与其浓度有关,在较低浓度时刺激微生物生物量的增加,而高浓度时则表现为抑制。赵辉等[34]研究也发现低浓度Cd(≤2.0 mg/kg),可增加土壤中微生物生物量碳含量。Cd对土壤中硝化细菌毒性很高,土壤氮矿化过程受到抑制[31,34],土壤外源镉含量的增加会使暗棕土壤的呼吸强度呈明显减弱趋势[35]。本研究中发现也发现轻度和中度Cd 污染浓度胁迫下,桑树3 个生长时期的根际土壤脱氢酶、过氧化氢酶、脲酶、蛋白酶较对照增加,而重度Cd污染胁迫下的低于对照,表明土壤微生物不同酶系对重金属污染水平的耐性和敏感程度不同[36-38],也有可能是桑树根系在可耐受Cd 浓度条件下桑树根系通过呼吸等代谢增强方式,促进相关种类微生物作用,提高土壤中的相关酶活。
根系是最先感受到重金属胁迫的器官,根际环境中生物、化学、物理等多种成分是相互关联和互相影响[39]。根系分泌物可使根际微生物的数量和种类发生改变,土壤酶的种类、活性与根系分泌物、土壤微生物的种类、数量相关,有机酸可以改变根际环境的pH和重金属形态[40]。笔者对镉胁迫下的桑树根际土壤微生态特征因子进行Pearson相关分析显示土壤中全量镉含量、可交换态镉与土壤脱氢酶和氧化还原酶呈显著正相关,碳酸盐结合态镉与土壤脱氢酶呈显著正相关,铁锰氧化物结合态镉与土壤脱氢酶和氧化还原酶呈极显著正相关,土壤中5种形态镉含量均与pH和微生物生物量氮含量呈显著负相关,与土壤有机质、碱解氮和速效钾含量呈负相关。也进一步说明受重金属污染的土壤,其理化性质明显恶化,营养元素(N、P、K)也缺乏,有机质偏低、物理结构和pH值均明显下降。这与镉胁迫下的桑树根际土壤微环境特征响应的主成分分析结果是相一致,3种镉浓度胁迫下桑树根际土壤样本组与对照样本组可有效区分。
根际作为植物-土壤-微生物间相互作用的特殊微域,不同于原位土体,该部位物质交换十分频繁,是各种养分物质循环的活跃区域,同样也是植物生长发育过程中养分吸收和代谢过程的重要场所[41]。根际环境的微域化、动态化、复杂化特征明显,尤其是根系分泌物酸碱反应[42]、氧化还原[43]、吸附解离[44]、络合反应[45]可改变重金属的生物有效性,直接影响根际圈生态质量,本文虽探讨了桑树根际土壤环境特征响应不同镉污染水平的演变特征,明确了镉胁迫下的桑树根际土壤化学和生物特征,但是与哪些根际分泌物有关,这些根际分泌物又是如何调控土壤中重金属化学形态和迁移特征,还有待进一步探讨。

