黄瓜丝氨酸羧肽酶类蛋白家族鉴定及表达分析
朱楚霞,肖铃娣,胡朝阳,曾黎明,刘世强,周 勇
(江西农业大学 生物科学与工程学院,江西 南昌 330045)
【研究意义】黄瓜(Cucumis sativusL.)是中国种植和消费最广泛的蔬菜作物之一。但是在黄瓜生长发育过程中经常会遭受高盐和干旱等非生物逆境、以及白粉病等生物逆境的胁迫,严重影响其产量与品质。因此,发掘黄瓜逆境胁迫相关的关键调控基因,不仅能揭示抗性的分子遗传机制,也能加快黄瓜抗性育种进程。【前人研究进展】丝氨酸羧肽酶类(serine carboxypeptidase-like,SCPL)蛋白是在Pfam 中以PF00450为代表结构域的一类蛋白质,广泛存在于高等植物,少量存在于低等植物、细菌、真菌中[1]。它们在结构和功能上与丝氨酸羧肽酶(serine carboxypeptidase,SCP)比较相似,且同属于SC羧肽酶中的S10家族,由具有独特催化中心、拓扑结构高度保守的α/β 水解酶三级结构组成[2-4]。在结构上,SCPL 蛋白与SCP差别不大,均含有1个细胞内分泌和转运的信号肽、4个底物结合位点、多个N-糖基化位点以及与催化作用相关的进化保守区域[5-6];而且这些区域一般处于SCPL/SCP 蛋白的中部,其氨基酸残基比较保守,但是它们的N 端和C 端氨基酸残基保守性较差。SCPL/SCP 蛋白含有2个特殊的结构:一是由丝氨酸(由保守的Gly-X-Ser-X-Gly 序列环绕,其中Gly代表甘氨酸,Ser代表丝氨酸,X代表任意氨基酸)、天冬氨酸(Asp)和组氨酸(His)组成保守催化三联体(Ser-Asp-His),能够结合底物,构成与底物结合的氢键网络并进行电荷的传递;二是具有氧离子洞,可以稳定底物-酶复合体的反应中间体[5,7-8]。在功能上,SCPL/SCP蛋白普遍具有肽酶活性;而一些SCPL 蛋白却有酰基转移酶活性,可以利用O 型葡萄糖酯酰基(1-O-βglucose ester)作为底物进行酰基化反应[3-4,9]。【本研究切入点】研究表明,SCPL 蛋白主要分布在植物的液泡、溶酶体等部位,在细胞伸长、种子发育等生长发育过程中发挥着重要的作用。如GS5(grain size 5)是水稻中一个控制籽粒大小和产量的正调控因子,其启动子区域的2个关键单核苷酸多态性(single nucleotide polymorphisms,SNPs)造成幼穗中GS5的差异表达,引起籽粒大小的差异[10-11]。提莫菲维小麦(Triticum timopheevi)中GS5的同源蛋白TtGS5-3A-G和TtGS5-3G-G可能通过与膜联蛋白Annexin D1互作,从而调控籽粒的大小[12]。已有研究表明,SCPL 蛋白还参与很多次生代谢产物的合成,如葡萄糖聚酯、花青素、单宁酸、芥子碱等[13-16],并在植物的生物与非生物逆境响应过程中发挥重要的作用。如水稻OsBISCPL1基因在水杨酸和茉莉酸诱导下表达,其转基因植株增强了对丁香假单胞假单胞杆菌(Pseudomonas syringae)和芸薹生链格孢菌(Alternaria brassicicola)的抗性,并表现出一定的抗氧化胁迫性[17]。【拟解决的关键问题】SCPL基因在调控植物生物发育以及逆境胁迫过程中发挥着重要作用,但是目前还未见黄瓜中有关SCPL基因的研究报道。在本研究中,笔者应用生物信息学方法,在黄瓜基因组数据中检索了SCPL基因,分析这些基因的染色体定位、序列特征、进化关系、组织和胁迫表达谱等,研究结果将为进一步深入阐明黄瓜SCPL蛋白的功能提供了理论依据。
1 材料和方法
1.1 黄瓜SCPL家族成员的鉴定
利用PFAM 数据库(http://pfam.xfam.org/)中登录号PF00450 下载SCPL基因的隐形马尔科夫模型(hidden markov model,HMM)文件,在HMMER v3.0 软件中利用SCPL家族的HMM 配置文件对黄瓜Chinese Long v2版本蛋白数据库(http://cucurbitgenomics.org/organism/2)进行扫描。同时以拟南芥SCPL蛋白作为查询序列,在黄瓜Chinese Long v2 基因组网站进行BLAST。整合HMMER 和BLAST 结果,去掉长度低于200 aa 的蛋白序列后,剩下的候选蛋白利用PFAM 和SMART 网站(http://smart.embl-heidelberg.de/)进行验证,最后具有PF00450特征结构域的蛋白序列被鉴定为黄瓜SCPL基因家族成员。
1.2 黄瓜SCPL蛋白理化性质分析
从黄瓜Chinese Long v2基因组数据库中下载黄瓜SCPL基因的编码蛋白序列,参考前人的文献[18],利用ExPASy 服务器中的ProtParam 工具(https://web.expasy.org/protparam/)预测每个黄瓜SCPL 蛋白的氨基酸(amino acid,aa)数目、分子量(molecular weight,MW)、等电点(isoelectric point,pI)以及亲疏水性均值(grand average of hydropathicity,GRAVY);并利用Plant-mPLoc 程序(http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/)对黄瓜SCPL蛋白进行亚细胞定位预测。
1.3 黄瓜SCPL家族成员系统发育及基因结构分析
基于前人的文献[19],在TAIR(the arabidopsis information resource)数据库(http://www.arabidopsis.org/)中下载拟南芥SCPL基因家族成员的蛋白序列。将拟南芥和黄瓜SCPL 蛋白序列在MAFFT 网站(https://www.ebi.ac.uk/Tools/msa/mafft/)进行比对后,导入MEGA 7.0 中,采用邻接法(neighbor-joining,NJ)对SCPL 蛋白构建系统发育树,校验参数Bootstrap 值设置为1 000。从黄瓜基因组数据库中下载黄瓜SCPL基因的CDS 及gDNA 序列,利用Gene Structure Display Server(GSDS)软件(http://gsds.gao-lab.org/)对SCPL基因结构进行可视化分析。
1.4 基于转录组的黄瓜SCPL基因表达分析
参考前人的文献[20],从NCBI 的SRA 数据库(https://www.ncbi.nlm.nih.gov/sra/?term=sra046916,登录号:PRJNA80169)中下载黄瓜根、茎、叶、花、子房和卷须等组织的RNA-seq 数据,分析SCPL基因的组织表达模式。从NCBI 数据库中下载黄瓜叶和根的盐胁迫基因表达数据,分析黄瓜SCPL基因在盐胁迫下的表达谱,登录号分别为GSE116265 和PRJNA511946[21-22]。从NCBI 数据库中下载SSL508-28(高抗白粉病且能稳定遗传的片段代换系)和D8(高感白粉病受体亲本)在接种白粉病菌48 h 后的转录组数据(登录号:GSE81234)[23],分析黄瓜SCPL基因在接种白粉病菌后的表达模式。参考笔者之前的方法,将基因表达数据统一标准化为TPM(transcripts per kilobase million)值[24]。若TPM 值<1.0,则认为基因表达丰度太低。所有CsaSCPL基因表达数据均以log2(TPM+1)值显示,利用TBtools 软件绘制基因表达热图[25]。
2 结果与分析
2.1 黄瓜SCPL家族的鉴定及蛋白理化性质分析
通过HMMER 软件筛选及功能域验证,从黄瓜基因组中鉴定出27 个SCPL家族基因,根据它们在染色体上的位置信息,将它们命名为CsaSCPL1~CsaSCPL27(表1)。这些基因分布在黄瓜所有7 条染色体上。其中,1 号和3 号染色体上含有数量最多的CsaSCPL基因(各6 个),4 号染色体上分布着5 个基因,7 号染色体上分布着4 个基因,而2 号、5 号和6 号染色体含有数量最少的CsaSCPL基因(各2 个)。
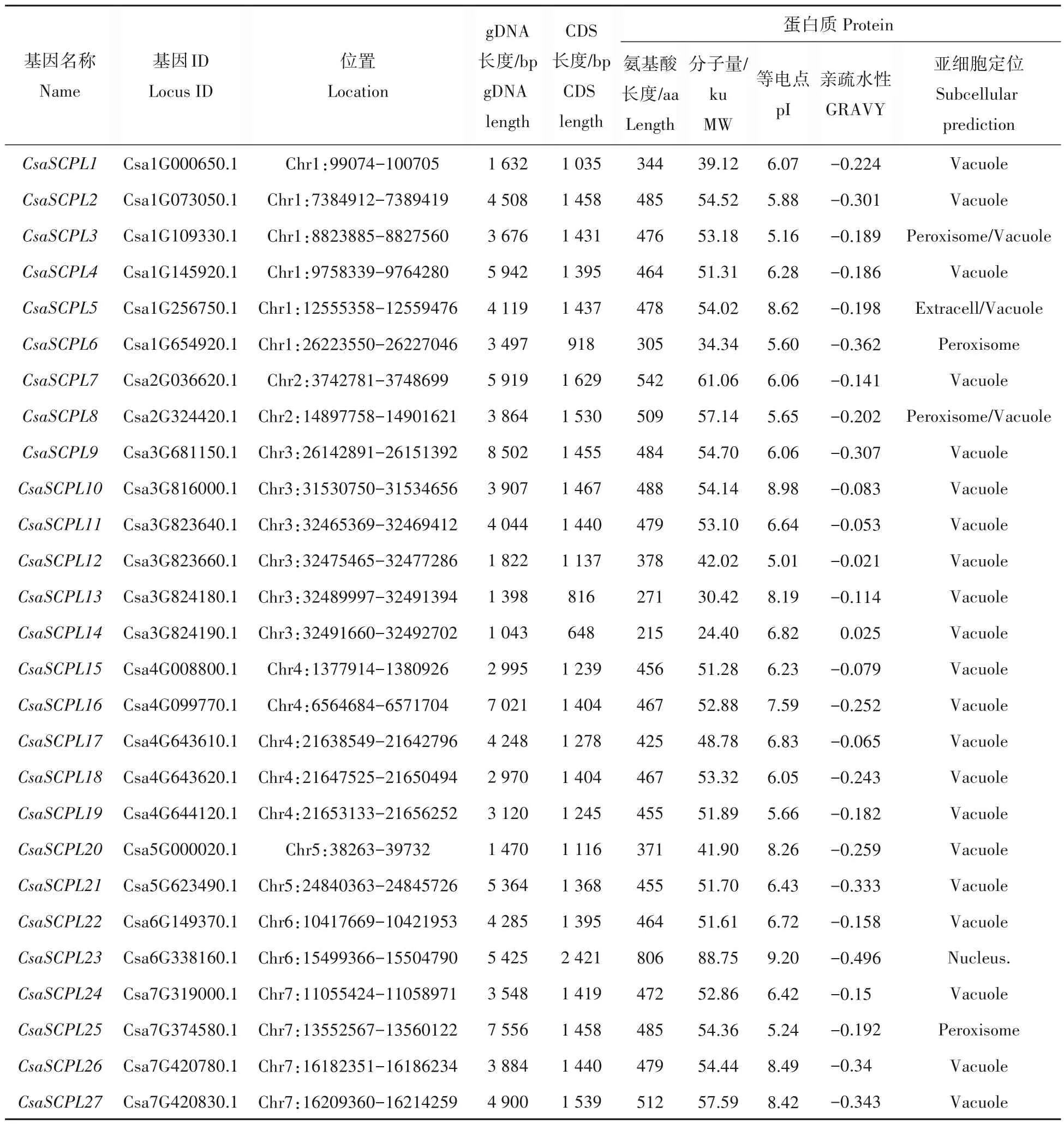
表1 黄瓜SCPL家族成员基本信息Tab.1 Basic information of the SCPL gene family in cucumber
通过对蛋白的理化性质分析发现,黄瓜SCPL 蛋白分子量在24.40 ku(CsaSCPL14)~88.75 ku(CsaSCPL23)不等,等电点pI在5.01(CsaSCPL12)~9.20(CsaSCPL23)范围内分布。GRAVY值预测结果表明黄瓜SCPL蛋白几乎全部为亲水性蛋白(CsaSCPL14除外)。亚细胞定位预测结果显示CsaSCPL 蛋白大多定位于液泡,少量定位于过氧化物酶体和胞外。
2.2 黄瓜SCPL家族成员系统进化分析
为揭示黄瓜SCPL基因的系统进化关系,选取拟南芥和黄瓜的全部SCPL 蛋白质序列构建系统进化树,结果如图1 所示。根据进化树的分支,CsaSCPL 和AtSCPL 家族成员在系统发育上可以分为3 组:SCPL-I、SCPL-II、SCPL-III。其中黄瓜CsaSCPL 成员在SCPL-I 中数量最多,有17 个;在SCPL-II 和SCPLIII中成员数量较少,各有5个。

图1 黄瓜与拟南芥SCPL家族成员系统进化分析Fig.1 Phylogenetic analysis of SCPL family members from cucumber and Arabidopsis
2.3 黄瓜SCPL蛋白保守基序分析
利用MEME在线软件构建了黄瓜保守基序的结构特征图(图2),结果表明CsaSCPL 蛋白均含有典型的保守基序Motif 1。其中,绝大多数SCPL-I 中的CsaSCPL 蛋白都含有Motif 1-10(CsaSCPL1、CsaSCPL12、CsaSCPL13、CsaSCPL14除外),且Motif的相对位置也较为保守。与SCPL-I相比,SCPL-II与SCPLIII 中的大部分CsaSCPL 蛋白都含有种类较少的保守基序。如CsaSCPL6 缺少Motif 1~4,CsaSCPL17 缺少Motif 2、Motif 9、Motif 10。结合进化树可以发现,CsaSCPL 蛋白的保守基序特征与进化树基本保持一致。另外值得注意的是,CsaSCPL21(SCPL-I)和CsaSCPL18(SCPL-II)分别出现了Motif 6和Motif 8的复制,且复制均出现在其对应蛋白的N端(图2)。

图2 黄瓜SCPL家族成员系统进化及蛋白质保守基序分析Fig.2 Phylogenetic relationship and conserved motif analysis of SCPL family members in cucumber
2.4 黄瓜SCPL基因外显子-内含子结构分析
本研究分析了CsaSCPL基因外显子-内含子的结构,结果如图3 所示。除CsaSCPL20以外,其它CsaSCPL基因都含有3~13个数量不等的内含子。结合进化树,SCPL-II组和SCPL-III组中的CsaSCPL成员(CsaSCPL20除外)普遍含有数量较多的内含子(8~13 个),而SCPL-I 组中的CsaSCPL成员含有内含子的数量为3~9个。此外,亲缘关系近的CsaSCPL基因普遍具有相似的外显子-内含子结构,只是内含子的长度有一些变化。这些结果进一步支持了CsaSCPL基因的分类。

图3 黄瓜SCPL家族成员系统进化及基因结构分析Fig.3 Phylogenetic relationship and gene structure analysis of SCPL family members in cucumber
2.5 黄瓜SCPL基因在不同组织中的表达模式
在NCBI数据库中下载CsaSCPL各成员在不同组织中的表达情况,利用TBtools软件热图工具展示结果并取对数,结果如图4所示。CsaSCPL1和CsaSCPL10分别在叶和根中特异表达,表明它们在叶和根的发育过程中具有重要的作用。此外,CsaSCPL2、CsaSCPL4、CsaSCPL5、CsaSCPL9、CsaSCPL15、CsaSCPL16、CsaSCPL18、CsaSCPL22和CsaSCPL26在雌花和雄花上的表达差异显著,暗示它们可能参与花的发育。此外,CsaSCPL2、CsaSCPL4、CsaSCPL5、CsaSCPL11、CsaSCPL19、CsaSCPL26和CsaSCPL27在子房发育的不同阶段有明显的差异,表明它们可能参与黄瓜子房的发育。
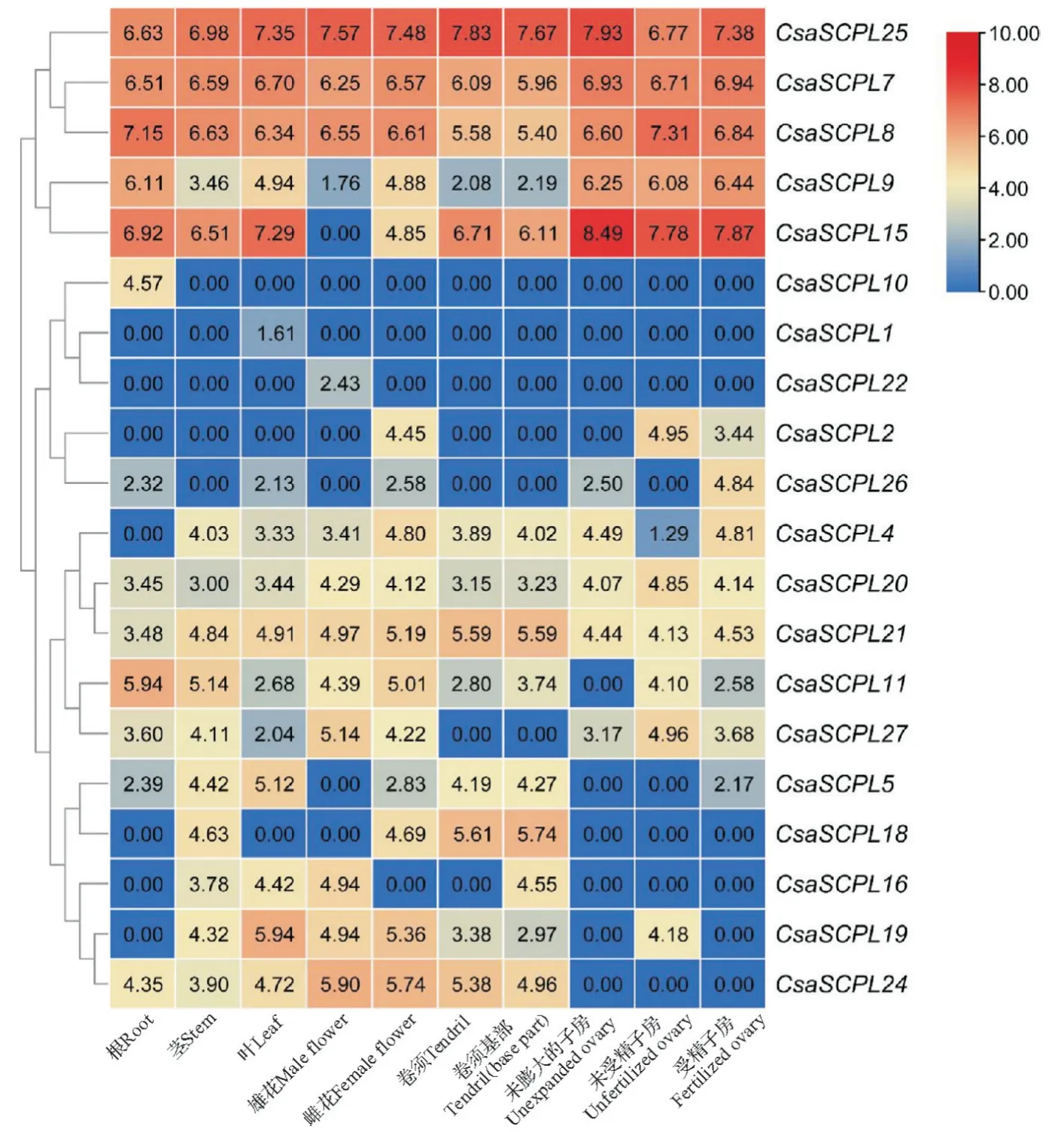
图4 黄瓜CsaSCPL基因组织表达谱Fig.4 Tissue expression profiles of cucumber CsaSCPL genes
2.6 黄瓜SCPL基因在盐胁迫下的表达模式
结合前人的盐胁迫表达转录组测序数据[21-22],获得了黄瓜SCPL基因在盐胁迫下的表达量数据(图5)。结果显示,在盐胁迫处理的叶片中,CsaSCPL2、CsaSCPL11和CsaSCPL19的表达量明显上升,而CsaSCPL1的表达量则明显下降,其余基因的表达量没有明显的差异。在盐胁迫处理的根中,CsaSCPL11的表达量明显上升,而CsaSCPL2、CsaSCPL16和CsaSCPL18的表达量明显下降。这些结果表明这些CsaSCPL基因可能参与黄瓜盐胁迫响应。
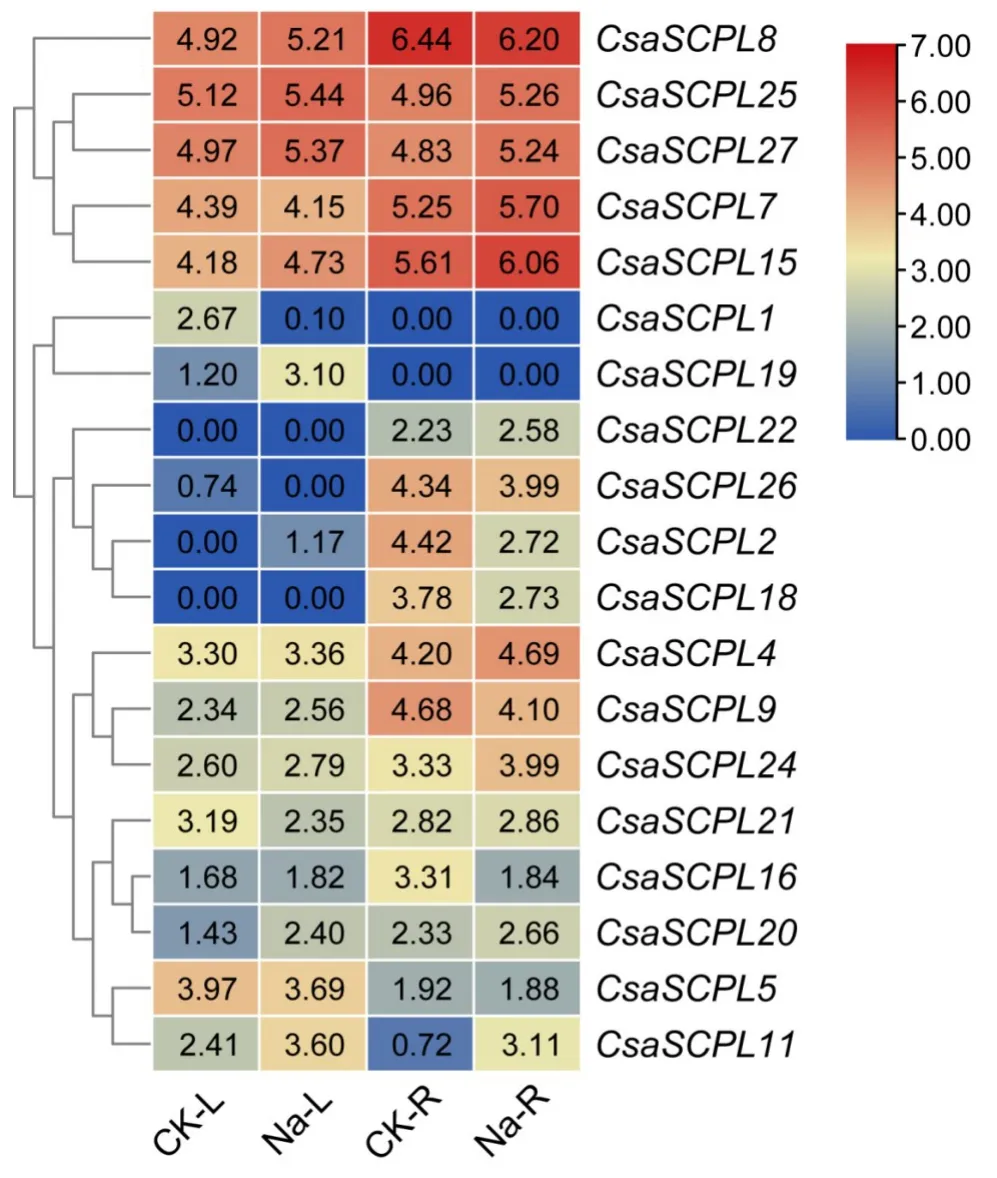
图5 黄瓜SCPL家族基因在盐胁迫下的表达模式Fig.5 Expression profiles of cucumber CsaSCPL genes under salt stress
2.7 黄瓜SCPL基因在白粉病胁迫下的表达分析
为了揭示CsaSCPL基因在黄瓜抗白粉病中的功能,本研究利用高通量转录组测序数据分析了黄瓜SCPL家族基因在D8和SSL508-28接种白粉病菌前后的表达模式。结果显示,在D8(高感白粉病受体亲本)接种白粉病菌后,CsaSCPL2、CsaSCPL4、CsaSCPL9、CsaSCPL11、CsaSCPL15、CsaSCPL24、CsaSCPL27的表达量明显上升,而CsaSCPL1的表达量则明显下降(图6)。而在SSL508-28(高抗白粉病且能稳定遗传的片段代换系)接种白粉病菌后,CsaSCPL15的表达量明显上升,其余基因表达量没有明显的变化(图6)。
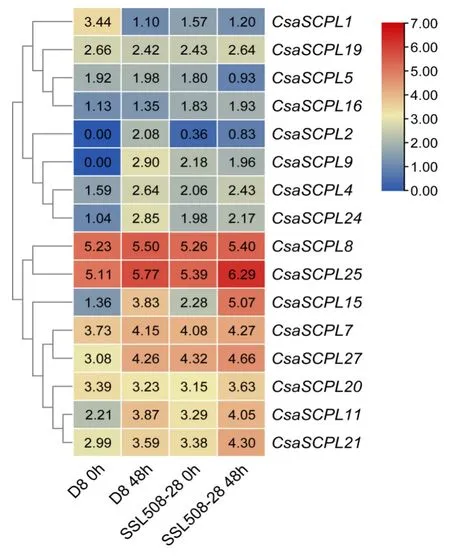
图6 黄瓜SCPL家族基因在D8和SSL508-28中白粉病菌响应分析Fig.6 Expression profiles of cucumber CsaSCPL genes in response to powdery mildew infection in D8 and SSL508-28
3 结论与讨论
SCPL 蛋白是一类大的蛋白质水解酶家族,目前已从多个物种中分离到SCPL基因及其蛋白,发现它们在种子萌发、细胞程序性死亡、次生代谢产物的合成以及抵抗逆境胁迫等过程中发挥重要作用。本研究利用生物信息学的方法,在全基因组水平上对黄瓜SCPL基因家族进行了鉴定,一共得到27 个CsaSCPL基因,它们不均等地分布在黄瓜的7 条染色体上(表1)。SCPL基因在不同物种内包含的家族成员数目差异较大,如拟南芥[19]、水稻[26]、杨树[8]、茶树[27]、小麦[28]中分别鉴定到54、71、57、47、210 个SCPL基因,而且这些物种中SCPL基因的数量并不取决于其基因组的大小。因此,SCPL基因数量的变化可能主要与基因复制事件有关。本研究中黄瓜具有相对数目明显偏少的CsaSCPL基因,这可能是由于黄瓜在进化过程中发生了相对较少的染色体复制事件[29-30]。之前在黄瓜GRAS[31]、IQD/SUN[32]等基因家族中的研究也表明较少的染色体复制事件是导致这些家族成员偏少的主要原因。理化性质分析结果表明CsaSCPL 蛋白的酸碱性差异明显,有19 个CsaSCPL 蛋白的pI 值呈酸性,占比70%(表1)。之前的研究结果也表明:在杨树、茶树、小麦等物种中酸性SCPL蛋白的占比分别为73%[8]、77%[27]、80%[28]。因此,与其它物种一样,大部分的CsaSCPL蛋白也需要在酸性条件下才能激活催化三联体(Ser-Asp-His)从而发挥水解功能。此外,亚细胞定位结果表明,CsaSCPL蛋白主要定位于液泡,少量定位于过氧化物酶体和胞外,表明CsaSCPL蛋白主要在液泡中发挥作用。但是之前的研究表明茶树的大多数SCPL 蛋白定位于细胞膜与溶酶体[27],表明黄瓜与茶树的SCPL蛋白可能存在功能上的差异。笔者同时对黄瓜和拟南芥中的SCPL蛋白进行系统进化发育分析,结果表明它们在系统发育上可以分为3组,分别为SCPL-I、SCPL-II和SCPL-III(图1),其中SCPL-I 的成员数量明显多于SCPL-II 和SCPL-III,而且亲缘关系接近的CsaSCPL 成员的保守基序分布和基因结构也非常相似(图2、3),这与先前对其它物种SCPL 家族的报道一致,如拟南芥[19]、杨树[8]、茶树[27]、小麦[28]等。
之前的研究表明,一些植物SCPL家族基因的表达具有明显的组织特异性。如拟南芥At2g23000、At1g33540、At5g42230和At1g43780分别仅在衰老的叶片、根、花和幼苗中表达;而At1g73310、At3g10450、At2g23010、At2g22970、At4g12910虽然在根、茎、叶、花以及角果等组织中都有表达,但是它们分别在根、衰老的叶片、幼苗、花、角果中具有最高的表达量[33]。茶树CsSCPL2-IA、CsSCPL3-IA、CsSCPL22-IA、CsSCPL23-IA只在顶芽、幼叶和茎中表达[27]。水稻GS5基因在绿色组织中的表达量高于茎秆、根、幼穗、胚乳等非绿色组织;而在非绿色组织中,GS5的表达量在长度为1-11 cm的幼穗中最高[10]。本研究检测了黄瓜SCPL基因的组织表达模式,发现CsaSCPL基因的表达量也具有组织特异性。如分析CsaSCPL基因在花中的表达模式发现CsaSCPL16和CsaSCPL22仅在雄花中表达,而CsaSCPL2、CsaSCPL5、CsaSCPL15、CsaSCPL18和CsaSCPL26仅在雌花中表达(图4),表明它们在黄瓜花发育过程中具有重要的作用。之前的研究表明:相比野生型植株,过表达NtSCP1的转基因烟草植株中花的长度变短了18%~28%[34]。一些CsaSCPL基因则在不同发育时期的子房中有明显的差异表达(图4),表明它们可能参与了黄瓜果实发育过程。之前的结果也表明水稻GS5及其同源基因TtGS5-3A-G和TtGS5-3G-G均参与籽粒大小的调控[10-12]。过表达玉米ZmGS5可增加转基因拟南芥植株的千粒重,表明ZmGS5也可能在籽粒发育过程中具有重要作用[35]。此外,一些亲缘关系接近的CsaSCPL基因也表现出明显不同的组织表达模式。如CsaSCPL1/15、CsaSCPL10/11、CsaSCPL18/19这些基因对在亲缘关系上具有较高同源性(图1),但是它们的组织表达模式却具有很大的差别(图4)。类似的结果也在其它物种中检测到。如杨树PtSCPL02/33、PtSCPL03/34、PtSCPL15/51、PtSCPL25/53、PtSCPL42/46等基因对均表现出明显不同的组织表达模式,但是它们却拥有相同的保守基序分布和基因结构,表明它们在杨树不同组织中发挥相同或相似的功能[8]。
为了解黄瓜SCPL基因家族对逆境的胁迫反应,笔者借助转录组测序结果分析了CsaSCPL基因在盐胁迫和白粉病菌侵染条件下表达量的变化。结果表明一些CsaSCPL基因的表达量在盐胁迫处理下发生明显的变化(图5),表明它们可能调控黄瓜植株的耐盐性。最近的研究也表明,在盐和旱处理条件下小麦TaSCPL184-6D和TaSCPL68-3A的表达量明显上升,而TaSCPL63-3A和TaSCPL7-1A的表达量则明显下降;同时在拟南芥中过表达小麦TaSCPL184-6D基因显著提升了转基因植株的抗旱和耐盐能力[28]。此外,有8 个CsaSCPL基因的表达量在白粉病菌侵染条件下发生明显变化(图6)。值得注意的是,CsaSCPL15的表达量在D8 和SSL508-28 接种白粉病菌后均明显上升,而且其在抗性株系SSL508-28中的表达量明显高于敏感株系D8(图6),表明CsaSCPL15在黄瓜抵御白粉病侵染过程中发挥重要功能。

