脊髓型颈椎病患者大脑内在活动的改变和基于fMRI的分类研究
葛志超,吴佳佳,孙 浩,赵 庆
(1.上海中医药大学附属岳阳中西医结合医院骨伤科,上海 200437;2.上海中医药大学附属岳阳中西医结合医院康复科,上海 200437)
脊髓型颈椎病(cervical spondylotic myelopathy, CSM)亦称瘫痪型颈椎病,此型较多见,症状严重,椎间盘退变导致肢体功能障碍、感觉丧失和疼痛[1]。CSM是颈椎病中最为严重的类型,常需手术治疗。因CSM的发病与椎体的退化、椎间盘的退变、韧带的增生肥厚直接相关,故以往的治疗思路均局限于改善椎体、间盘、韧带三者与脊髓之间的位置关系。即使手术解除了压迫,仍有部分CSM患者肢体运动感觉功能恢复不佳[2]。随着神经功能影像学技术的发展,越来越多的研究关注到脊髓受压的同时大脑因长时间去感觉输入和运动输出刺激,将导致脑功能的重塑。基于各种神经影像学技术的各个模态的脑功能和结构成像研究结果,从局部脑活动、脑区间功能连接、各个尺度脑网络拓扑属性、灰质和白质的结构改变、脑血流量,代谢产物等均证实了CSM可引起脑功能的改变[3-6]。但在这些研究中CSM患者和正常人之间的脑活动差异并不一致,并且机制仍不清楚。
近年来,多元模式分析方法(multivariate pattern analysis, MVPA)已广泛应用于神经影像数据分析,以提取模式和个体的观测值的分类[7]。大量研究已经证实MVPA模型可用于从被试大脑图像中解码信息,这些研究也为临床工作提供了一个非常好的方法。根据既往的文献,本研究假设CSM的患者在自发性大脑活动中表现出显著变化,可用于将其与健康对照进行分类。因此,本研究旨在研究CSM对大脑内在活动的影响,探讨CSM患者肢体功能障碍的神经机制。从CSM患者和健康对照被试中采集静息态的fMRI数据,分析并计算低频振荡振幅(amplitude of low frequency fluctuation, ALFF),使用MVPA中常用的支持向量机(SVM)方法,将组间具有显著差异的影像特征值应用于分类,并进行临床功能评估与分类决策值之间的相关性分析。
1 资料与方法
1.1 一般资料
2020年9—12月,选取12名需进行手术治疗的右利手CSM术前患者(年龄30~75岁)和18名健康对照者(年龄30~75岁)为研究对象。所有CSM患者都有明显的颈髓压迫影像证据,包括黄韧带肥厚、后纵韧带骨化和颈椎间盘突出,并伴有与影像证据相符的临床症状,包括四肢的运动、感觉功能障碍,躯干感觉功能障碍,膀胱功能障碍(包括尿潴留、尿失禁)。本研究的排除标准如下:(1)30岁以下或75岁以上;(2)不需要手术治疗本研究中的CSM患者都是需要手术治疗的患者,需要说明本研究是在手术之前还是手术之后,另外,手术前后患者脑功能是否有变化;(3)合并严重的心脑血管、造血系统等系统性疾病;(4)抑郁、焦虑、药物滥用或其他精神疾病的病史;(5)MRI发现脑部异常(肿瘤、出血或梗死);(6)磁共振扫描相关禁忌。本研究通过上海中医药大学附属岳阳中西医结合医院伦理委员会的批准(KYSKSB2020-141)。所有参与研究的被试者均签署知情同意书。
1.2 方法
1.2.1 临床功能评估 对所有受试者进行MRI扫描之前均进行JOA问卷评分以评估神经功能,JOA评估包括上下肢运动、感觉功能评估,膀胱功能评估。得分越高表示脊髓压迫造成的神经功能影响越小、临床症状越轻。
1.2.2 fMRI扫描 所有磁共振图像均使用西门子Magnetom Verio 3.0 T磁共振仪进行扫描。静息态fMRI数据采用单激发平面回波序列(echo planar imaging, EPI)扫描获得。扫描参数如下:隔层扫描,层数43,翻转角=90°,矩阵=64×64,TR=3 000 ms,层厚=3.0 mm,FOV=230 mm×230 mm,gap=0(体素大小3.6 mm×3.6 mm×3.0 mm)。采用加权快速衰减梯度回波(FSPGR)序列进行T1WI结构扫描。扫描参数如下:TR/TI/TE=1 900/900/2.93 ms,翻转角=9°,FOV=256 mm×256 mm,层厚=1.0 mm,矩阵=256×256,平均数=1。
1.2.3 fMRI数据预处理 在Matlab环境下进行。首先去除前10个时间点数据,然后采用SPM12软件包(http:∥www.fil.ion.ucl.ac.uk/spm/)进行时间校正、头动校正、空间标准化、平滑。
1.2.4 ALFF计算 采用REST 1.9软件(北京师范大学,http:∥www.restfmri.net)先进行线性漂移,然后计算每个体素在低频(0.01~0.1 Hz)的信号振荡振幅值,获得ALFF图像。最后,将每个个体的ALFF值进行Z变换用于进一步统计分析。
1.2.5 特征选择 并不是所有的特征都是有效的和相关的分类,筛选出具有很强识别力的特征来进行分类,适当减少特征的数量可以提高分类器的性能[8-10]。本研究提取CSM患者与健康对照的ALFF有显著差异的脑区作为模板进行SVM分类。采用REST1.9软件对Z值变换后的ALFF进行双样本t检验来比较组间差异,体素水平P<0.01未校正和团块水平Alphasim校正P<0.05为差异有统计学意义。
1.2.6 支持向量机对受试者的分类 采用Matlab环境下的PRONTO 2.0工具箱(Pattern Recognition for Neuroimaging Toolbox software 2.0,http:∥www.mlnl.cs.ucl.ac.uk/pronto/)进行分类。提取上述ALFF有显著组间差异的区域作为模板。将此模板应用于每一个个体zALFF图像,以此作为分类建模的特征。本研究所建立的分类器是基于二分类的支持向量机。采用留一交叉验证(leave one out cross validation, LOOCV)的方式来估计分类器的泛化能力。即将其中一个被试的zALFF作为验证集,其余被试的数据作为训练集。对每一个被试重复这一过程,记录分类器作出正确预测的次数,计算灵敏度和特异度。采用置换检验(1 000次)评估SVM分类器的性能。并提取患者组的分类决策值进行下一步统计分析。
1.3 研究流程
将符合入排标准的被试分为CSM患者组和对照组,两组被试均进行JOA评分及fMRI扫描;以fMRI扫描得出的ALFF值作为特征集,以ALFF有显著组间差异脑区为模板,以组别为标签;使用SVM分类算法训练,将上一步得出的分类决策值与JOA评分进行相关性分析。
1.4 统计学处理
使用SPSS 22.0将患者组的分类决策值与JOA运动和感觉评分分别进行斯皮尔曼相关性分析,P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料
CSM患者和健康对照组的一般资料和临床评估结果见表1。CSM患者与健康对照在年龄、性别差异无统计学意义(P>0.05)。

表1 CSM患者和健康对照组一般资料比较
2.2 ALFF组间差异
经Alphasim校正后最小的团块大小为118个体素,对应校正后的P值为0.05。结果显示CSM患者的大脑内在自发活动性较健康对照升高,主要在左侧小脑、左侧中央前回、左侧辅助运动区、右侧前扣带回,见图1、表2。

图1 CSM患者与健康对照的ALFF组间比较结果

表2 CSM患者与健康对照的ALFF组间比较结果
2.3 SVM分类
选择在ALFF分析中显示CSM患者与健康对照有显著差异的脑区作为判别分析的模板,包括左侧小脑、左侧中央前回、左侧辅助运动区和右侧前扣带回。SVM分类的准确率为86.67%(P=0.001)。该算法的总体分类准确性衡量了其将个体正确分类为CSM患者或对照的能力。敏感性为75.00%,特异性为94.44%,见图2。
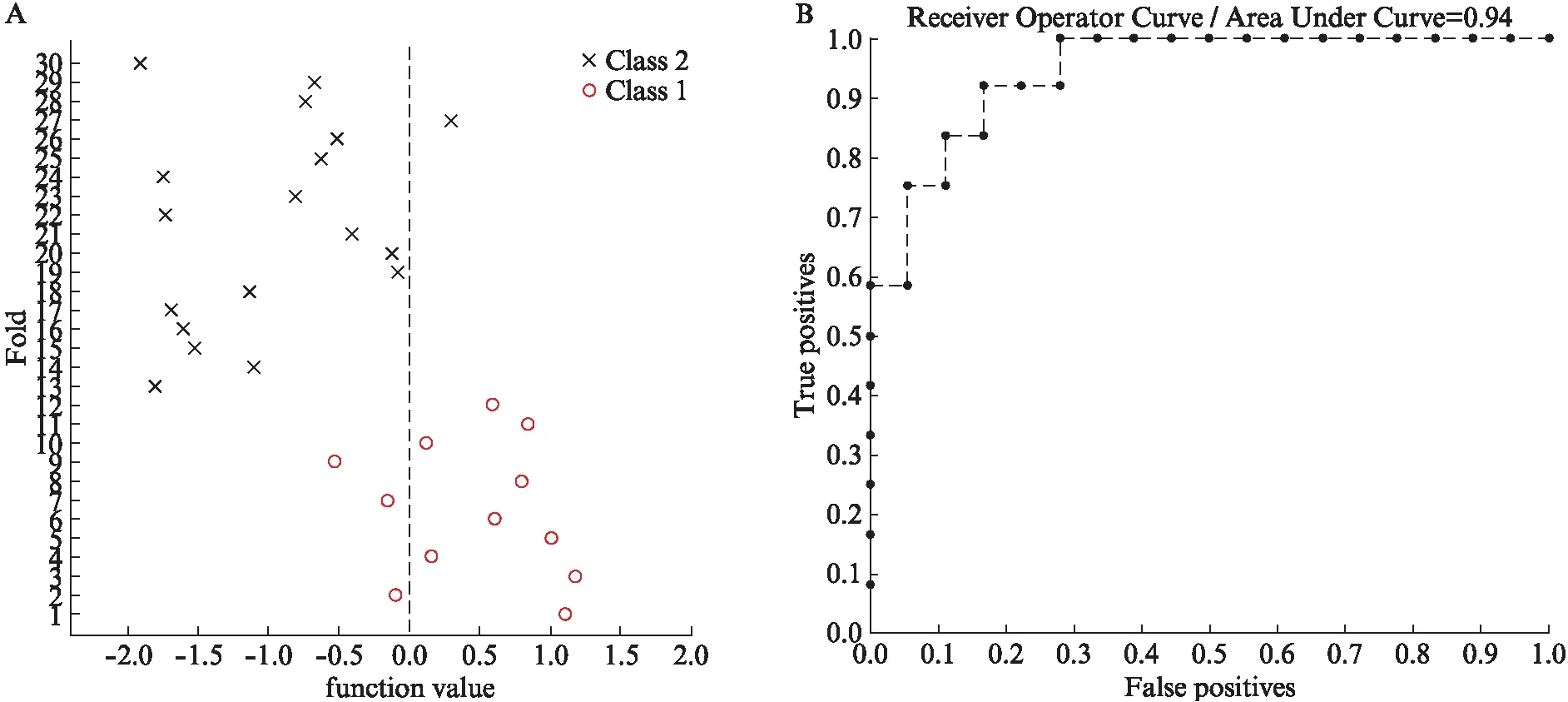
图2 CSM患者和健康对照的SVM分类图(A)及特征(ROC)曲线(B)
2.4 相关性分析
CSM患者的JOA功能评估与SVM分类决策值之间的相关分析结果显示,分类决策值与JOA运动功能评分显著负相关(r=-0.761 5,P=0.004),与JOA感觉功能评分无显著相关性(r=-0.070 5,P=0.828),见图3。
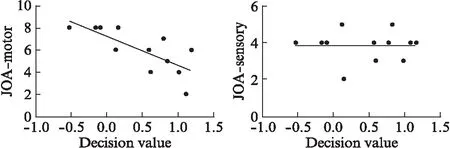
图3 CSM患者的分类决策值与JOA运动功能评分(A)及感觉功能评分(B)之间的相关性分析结果
3 讨 论
本研究将静息态fMRI和机器学习方法相结合,探讨CSM患者的大脑神经元自发活动的异常。结果发现与健康对照相比,CSM患者组在左侧小脑、左侧中央前回、左侧辅助运动区和右侧前扣带回的ALFF显著升高。进一步将有显著差异的脑区作为判别分析的模板,使用SVM进行机器学习分类的结果显示,CSM患者和健康受试者可以通过这些区域的ALFF来分类,并且CSM患者的分类决策值与JOA运动功能评分显著负相关。这些结果可能对理解脑重塑改变和该疾病的临床特征具有重要意义。
SVM是一类按监督学习(supervised learning)方式对数据进行二元分类的广义线性分类器(generalized linear classifier),其决策边界是对学习样本求解的最大边距超平面。简单而言,SVM算法的目标是找到一个超平面分割不同类别的数据点,并且使得数据点与超平面的最小距离最大。该算法在脑功能成像[11]、输血预测模型[12]、临床数据识别[13]等临床领域广为应用。大脑可塑性变化是分散的,而非聚焦于某一点,SVM这种多元模式分析方法对于识别这些改变更加敏感,且基于个体水平的预测模型也是提供更具价值的神经影像学标志物的关键,定位影响功能预后的关键脑区,可根据脑影像特征与康复的这种个体水平的关联性制定针对性的临床康复策略。
神经损伤会引起神经元可塑性改变,从而导致大脑功能和结构的改变。突触可塑性已被证实在许多神经系统疾病中出现,包括多发性硬化、脑卒中、脊髓损伤等[14-15]。既往已有多项研究表明脊髓损伤患者存在脑重塑改变,包括结构和功能重塑[16]。CSM是一种慢性脊髓损伤,提供了一个独特的脊髓损伤的研究模型。已有大量功能影像研究报告CSM患者显示出大脑运动感觉系统的重塑改变,基于任务态fMRI研究发现,CSM患者术前、术后中央前回及运动相关脑区激活体积较健康受试者有明显改变,并且感觉运动脑区激活的变化与JOA上肢评分的改善相关[17]。
近年来ALFF已引起越来越多的关注。研究已将ALFF与脑血流量和任务诱发的大脑激活关联起来[18]。ALFF的一个优点是它可以专注于关键脑区的神经活动,而不是脑区之间的相关性。此外,ALFF在静息态fMRI指标中的可靠性和可重复性之间达到最佳平衡[19]。本研究发现,CSM患者主要以左侧的运动中枢和运动调控脑区的ALFF较健康被试显著升高,提示CSM患者在优势半球的运动相关脑区存在显著重塑变化。中央前回是第一运动区,是负责计划、控制、运动执行的大脑皮质区[20]。小脑直接参与运动协调和相关运动学习,是感觉运动处理神经环路的关键脑区,可主动参与感觉及运动信息的整合[21]。运动辅助区的功能与运动计划有关,主要参与自身产生和控制的运动,而不是在外界刺激下所产生的运动[22]。前扣带回接受来自额叶背侧、眶额皮质、岛叶和丘脑的传入,并有广泛传出至运动前区、眶额皮质、辅助运动区(SMA)、前岛叶皮质、杏仁核和脑干,涉及情绪、认知、运动、内脏运动、疼痛等多种功能[23]。这些运动相关的脑区为主的ALFF增高,提示CSM患者可能需要调动更多的运动中枢和运动调控脑区参与功能代偿,且以优势半球为主。Takenaka等[24]也已分析CSM患者的ALFF改变,结果发现双侧初级感觉运动皮层和左侧视觉皮层的ALFF值增高,双侧缘上回后部ALFF值降低,CSM患者的术前ALFF值可能是术后JOA评分改善水平的生物标志物。临床实践中需要对患者进行个体水平的分类或评估,而常规统计方法不允许在个体水平评估分析结果。本研究采用MVPA方法从被试大脑图像中解码信息,以显著差异脑区的ALFF为特征进行SVM分类,并将分类决策值与临床功能评分进行相关性分析,结果发现CSM患者和健康受试者可以通过这些区域的ALFF来分类,且分类决策值与JOA运动功能评分显著负相关。进一步提示fMRI可作为一种标志物以用于探索CSM患者功能障碍的神经机制。
本研究采用MVPA方法研究CSM患者大脑内在活动的变化,结果发现CSM患者主要在优势半球运动相关脑区的自发性大脑活动增加。SVM分类表明这些差异脑区的自发活动可以在个体水平准确区分CSM患者和健康对照,且分类决策值与临床运动功能评分显著负相关,因本研究纳入的CSM患者均为右利手,且右利手大多数是左侧半球优势[25],故结果结果提示CSM患者可能需要调动更多的运动中枢和运动调控脑区参与功能代偿,且以优势半球为主。本研究结论与目前相关研究结论[26-27]相似,但目前尚无相关文献明确提出优势半球在CSM患者的功能代偿中的意义。这些结果可能对解释CSM患者功能障碍的潜在的神经机制和理解功能障碍与大脑不良重塑之间的相互作用具有重要意义。在CSM的临床诊疗中,除了对受压迫的相应脊髓节段的精准减压治疗外,还应当关注由CSM引发的脑功能改变,并合理的进行脑功能层面的治疗,这对提升短期疗效以及CSM的远期康复疗效可能具有重要意义。尽管如此,仍需要进行更多的研究,包括多模态指标的综合研究以帮助进一步研究CSM的脑重塑机制。

