染色体缩合调控子2对食管癌小鼠细胞增殖的影响及其机制研究*
陈民彪,黄明芳,廖绪强,蔡仁中
(海南省人民医院 胸外科,海南 海口570311)
随着人们生活方式和饮食习惯的变化,食管癌发病率呈逐渐升高的趋势[1]。食管癌是一种起源于食管鳞状上皮和柱状上皮的恶性肿瘤,其发生与遗传、环境等多种因素有关[2],具体病因尚未完全明确。细胞周期失控及异常增殖是肿瘤发生的重要机制之一。染色体缩合调节因子2(regulator of chromosome condensation 2, RCC2)是染色体乘客复合体的重要组成部分,与多种增殖及凋亡抑制基因共同作用,参与细胞增殖过程[3]。有研究发现,RCC2 靶向调节性别决定区Y 框蛋白2(sex determining region Y-box 2, SOX2)参与胃癌细胞的增殖和转移,但该通路在食管癌中的作用报道较少[4]。SOX2 是一种可调节胚胎和组织发育的干细胞转录因子,多项研究发现其在食管癌中表达上调[5-6],但是否受到RCC2 的调控尚不明确。本研究探讨RCC2 在食管癌小鼠细胞中的表达,并分析其是否能靶向调控SOX2,影响食管癌细胞的增殖,以期为临床治疗提供新靶点和思路。
1 材料与方法
1.1 实验动物
选取6~8 周龄雄性SPF 级C57BL/6J 小鼠30 只,购自湖南省动物实验中心,实验动物生产许可证号:SCXK(湘)2017-0008 号,实验动物使用许可证号:SYXK(湘)2017-0167。体质量180~200 g,饲养温度22~24℃,每日给予充足动物饲料及饮水。本研究经医院动物伦理委员会审核通过。
1.2 主要试剂及仪器
RCC2 mimics、RCC2 inhibitor 及对应阴性对照质粒购自中国科学院上海细胞库,RPMI 1640 培养基及胎牛血清(美国Gibco 公司),青链霉素(美国Invirogen 公司),胰酶(福建基诺生物科技有限公司),RIPA 裂解液(上海碧云天生物技术有限公司),Lipofectamine 2000 转染试剂盒(美国Thermo Fisher Scientific 公司),RNA 提取试剂盒(美国Merck & Co Inc),PCR 试剂盒(日本TaKaRa 公司),鼠抗人RCC2、SOX2、PCNA、Snail 单克隆抗体及兔抗鼠二抗购自美国Sigma 公司,CCK-8 试剂盒(武汉默沙克生物有限公司)。Transwell 小室(北京优尼康生物科技有限公司),酶标仪(美国迈瑞MR-96A 型),T100 型PCR 扩增仪(美国Bio-Rad 公司),371 型二氧化碳CO2培养箱(美国Thermo Fisher Scientific 公司)。
1.3 方法
1.3.1 食管癌小鼠模型的复制及细胞提取 小鼠每日饮用100 g/L 4-硝基喹啉-1-氧化物(4-nitroquinoline-1-oxide, 4-NQO)灭菌水(配制方法:将4-NQO溶解于1,2-丙二醇,配制成为5 g/L 质量浓度的溶液,再加入高压灭菌水进一步稀释成100 g/L 质量浓度的溶液),连续喂养10 周后改饮用灭菌水喂养至18 周,观察小鼠进食、饮水情况及毛色变化,并监测小鼠体质量。第18 周时采用颈椎脱臼法处死小鼠,打开胸腔取出食管组织。剪碎食管组织,37℃水浴条件下加入胰酶消化10 min,反复操作3 次,细胞混合液3 000 r/min 离心5 min,取上层细胞悬液,PBS 洗涤,在含10%胎牛血清的DMEM/F12 中重悬,接种在培养皿,CO2培养箱中培养。在显微镜下观察到上皮样形态,鉴定为食管癌细胞后,在培养箱中进一步培养、传代,采用第3 代细胞进行转染。
1.3.2 细胞转染及培养 将提取的食管癌细胞在含10%胎牛血清和1%青链霉素的1640 培养液中培养,取对数生长期细胞进行转染,采用Lipofectamine 2000 转染试剂将RCC2 mimics、RCC2 inhibitor 或mimics-NC、inhibitor-NC 对照序列转染入细胞中,并分别作为RCC2 mimics 组、RCC2 inhibitor组、mimics-NC 组、inhibitor-NC 组。另选未处理的食管癌细胞作为对照组,转染后继续孵育48 h。
1.3.3 CCK-8检测细胞增殖 细胞培养24 h、48 h、72 h 时,各组分别加入10 μl CCK-8 试剂,37℃避光孵育2 h,以空白孔调零,加入150 μl DMSO 溶解,测定450 nm 处吸光度值,以OD 值反映细胞增殖能力。每组重复操作3 次,取平均值。
1.3.4 逆转录聚合酶链反应(reverse transcription polymerase chain reaction, RT-PCR)检 测RCC2、SOX2、PCNA、Snail mRNA 相对表达量 采用Trizol试剂盒提取细胞总RNA,并测定样品浓度,确定合格后逆转录成cDNA。PCR 反应条件:95℃预变性30 s,95℃变性5 s,60℃退火30 s,74℃延伸30 s,共40 个循环,记录每个基因的Ct 值,目的基因相对表达量以2-△△Ct表示。引物序列由上海生工生物工程有限公司提供,引物序列见表1。

表1 RT-PCR引物序列
1.3.5 Western blotting 检测RCC2、SOX2、PCNA、Snail 蛋白相对表达量 细胞培养48 h 后去除培养液,PBS 洗涤,加入细胞裂解液,3 000 r/min 离心5 min,取上清液。采用SDA-PAGE 检测细胞目的蛋白相对表达量,配置胶体,制备蛋白样品,上样(蛋白样品和Maker),电泳,转膜,封闭,分别加一抗、二抗孵育,洗膜,显影,标记获得的蛋白条带,采用Image Lab 软件测定蛋白条带灰度值,并计算目的蛋白相对表达量。
1.3.6 荧光素酶实验 按照荧光素酶试剂盒说明书进行操作,将细胞按2×105个/孔的密度接种到12 孔板中,共转染RCC2、SOX2。将SOX2 野生型、突变型质粒分别与RCC2 mimics、mimics-NC 共转染至细胞(分别作为RCC2 和野生型SOX2-wt 共转染组、突变型SOX2-mut 共转染组),培养48 h,去除培养液后PBS 洗涤,加入细胞裂解液,在4℃条件下 震 荡10 min,40℃、1 000 r/min 离心3 min,取上清液进行发光检测。
1.4 统计学方法
数据分析采用SPSS 22.0 统计软件。计量资料以均数±标准差(±s)表示,比较用t检验或单因素方差分析或重复测量设计的方差分析,进一步两两比较用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 实验组和对照组RCC2的表达
实验组和对照组RCC2 mRNA 相对表达量分别为(1.48±0.35)和(1.06±0.22),经t检验,差异有统计学意义(t=1.254,P=0.029),实验组高于对照组。
2.2 各组细胞增殖情况
RCC2 mimics 组、mimics-NC 组、RCC2 inhibitor组、inhibitor-NC 组、对照组细胞培养0 h、24 h、48 h、72 h 时增殖情况比较,采用重复测量设计的方差分析,结果显示:①不同时间点细胞增殖有差异(F=103.803,P=0.000);②各组细胞增殖有差异(F=13.012,P=0.000);③各组细胞增殖变化趋势有差异(F=56.475,P=0.000)。0 h、24 h 时各组细胞增殖无明显差异(P>0.05)。48 h、72 h 时,与对照组比较,RCC2 inhibitor 组细胞增殖减少(P<0.05),其余各组增加(P<0.05);与对应阴性对照组比较,RCC2 mimic 组细胞增殖增加(P<0.05),RCC2 inhibitor 组细胞增殖减少(P<0.05)。见表2。
表2 各组不同时间点细胞增殖比较 (n=6,±s)
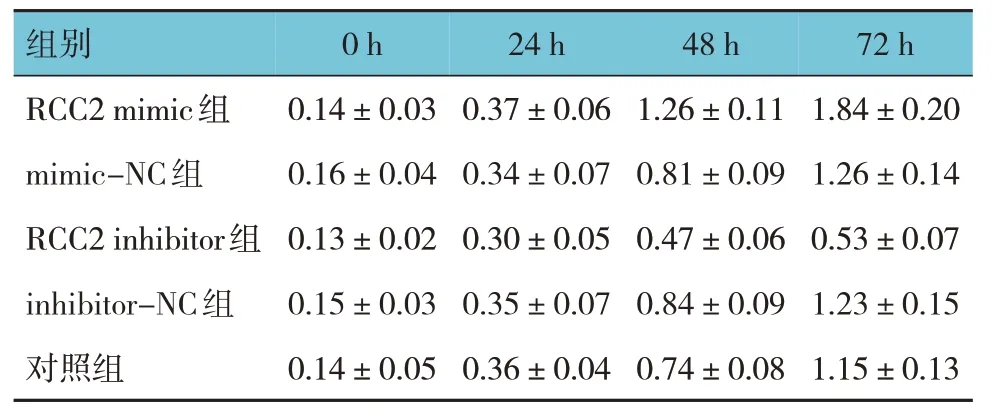
表2 各组不同时间点细胞增殖比较 (n=6,±s)
组别RCC2 mimic组mimic-NC组RCC2 inhibitor组inhibitor-NC组对照组0 h 0.14±0.03 0.16±0.04 0.13±0.02 0.15±0.03 0.14±0.05 24 h 0.37±0.06 0.34±0.07 0.30±0.05 0.35±0.07 0.36±0.04 48 h 1.26±0.11 0.81±0.09 0.47±0.06 0.84±0.09 0.74±0.08 72 h 1.84±0.20 1.26±0.14 0.53±0.07 1.23±0.15 1.15±0.13
2.3 各组细胞RCC2、SOX2、PCNA、Snail mRNA相对表达量
RCC2 mimics 组、mimics-NC 组、RCC2 inhibitor组、inhibitor-NC 组、对照组细胞RCC2、SOX2、PCNA、Snail mRNA 相对表达量比较,经单因素方差分析,差异有统计学意义(P<0.05)。进一步两两比较结果:对照组低于RCC2 mimics 组、mimics-NC 组、inhibitor-NC 组(P<0.05);与对应阴性对照组 比 较,RCC2 mimic 组升高(P<0.05),RCC2 inhibitor 组降低(P<0.05)。见表3 和图1。
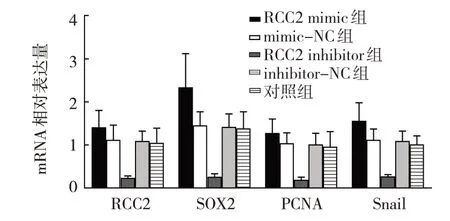
图1 各组细胞RCC2、SOX2、PCNA、Snail mRNA相对表达量比较 (n=6,±s)
表3 各组细胞RCC2、SOX2、PCNA、Snail mRNA相对表达量比较 (n=6,±s)
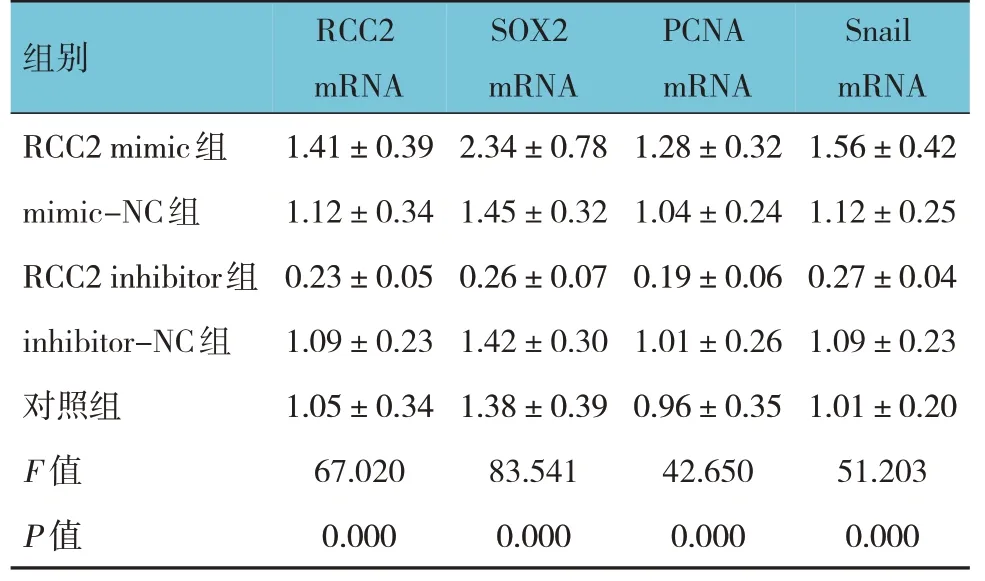
表3 各组细胞RCC2、SOX2、PCNA、Snail mRNA相对表达量比较 (n=6,±s)
组别RCC2 mimic组mimic-NC组RCC2 inhibitor组inhibitor-NC组对照组F 值P 值RCC2 mRNA 1.41±0.39 1.12±0.34 0.23±0.05 1.09±0.23 1.05±0.34 67.020 0.000 SOX2 mRNA 2.34±0.78 1.45±0.32 0.26±0.07 1.42±0.30 1.38±0.39 83.541 0.000 PCNA mRNA 1.28±0.32 1.04±0.24 0.19±0.06 1.01±0.26 0.96±0.35 42.650 0.000 Snail mRNA 1.56±0.42 1.12±0.25 0.27±0.04 1.09±0.23 1.01±0.20 51.203 0.000
2.4 各组细胞RCC2、SOX2、PCNA、Snail 蛋白相对表达量
RCC2 mimics 组、mimics-NC 组、RCC2 inhibitor组、inhibitor-NC 组、对照组细胞RCC2、SOX2、PCNA、Snail 蛋白相对表达量比较,经单因素方差分析,差异有统计学意义(P<0.05)。进一步两两比较结果:对照组低于RCC2 mimics 组、 mimics-NC 组、inhibitor-NC 组(P<0.05);与对应阴性对照组比较,RCC2 mimic 组升高(P<0.05),RCC2 inhibitor 组降低(P<0.05)。见表4 和图2、3。
表4 各组细胞RCC2、SOX2、PCNA、Snail蛋白相对表达量比较 (n=6,±s)
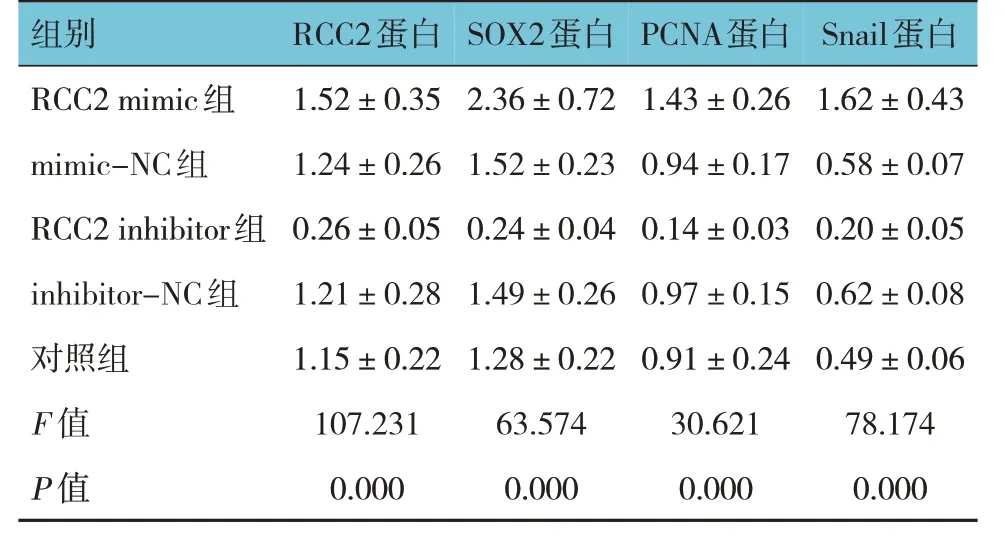
表4 各组细胞RCC2、SOX2、PCNA、Snail蛋白相对表达量比较 (n=6,±s)
组别RCC2 mimic组mimic-NC组RCC2 inhibitor组inhibitor-NC组对照组F 值P 值RCC2蛋白1.52±0.35 1.24±0.26 0.26±0.05 1.21±0.28 1.15±0.22 107.231 0.000 SOX2蛋白2.36±0.72 1.52±0.23 0.24±0.04 1.49±0.26 1.28±0.22 63.574 0.000 PCNA蛋白1.43±0.26 0.94±0.17 0.14±0.03 0.97±0.15 0.91±0.24 30.621 0.000 Snail蛋白1.62±0.43 0.58±0.07 0.20±0.05 0.62±0.08 0.49±0.06 78.174 0.000
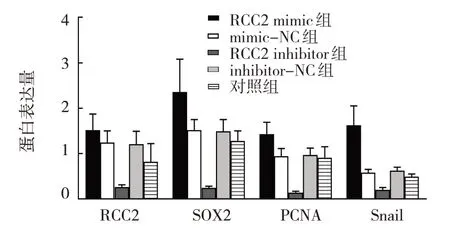
图2 各组细胞RCC2、SOX2、PCNA、Snail蛋白相对表达量比较 (n=6,±s)
图3 各组细胞RCC2、SOX2、PCNA、Snail蛋白的表达
2.5 各组细胞荧光素酶活性比较
荧光素酶实验结果显示,mimics-NC 组、RCC2和野生型SOX2-wt 共转染组、突变型SOX2-mut 共转染组的荧光素酶活性分别为(0.98±0.13)、(1.27±0.24)和(0.91±0.17),经单因素方差分析,差异有统计学意义(F=32.610,P=0.000)。进一步两两比较结果:与mimics-NC 组比较,RCC2 和野生型SOX2-wt 共转染组荧光素酶活性升高(t=5.819,P=0.000);而mimics-NC 组与突变型SOX2-mut 共转染组荧光素酶活性比较,差异无统计学意义(t=1.792,P=0.078)。
3 讨论
食管癌是多因素、多基因共同作用的结果,病因和发病机制复杂。近年来,细胞周期及相关信号通路调节蛋白在癌症方面的研究逐渐成为热点。大量研究显示,细胞周期调节因子的功能缺陷在食管癌发生、发展过程中起到重要作用[7]。RCC2 是一种通过相关信号通路参与细胞周期调控的蛋白,目前发现其在多种肿瘤细胞生物学行为中发挥作用,如沉默RCC2 表达后,胃癌细胞增殖能力受到抑制[8]。RCC2 可通过MAPK/JNK 信号通路,诱导肺癌细胞迁移,参与结肠癌细胞的上皮间质化(epithelial mesenchymal transition, EMT) 过程[9]。还有研究发现,RCC2 在乳腺癌细胞中表达上调,且能作用于整联蛋白黏附复合物参与细胞迁移,提示RCC2 在细胞增殖和信号传导过程中起到一定作用[10]。本研究结果表明,食管癌小鼠食管组织中RCC2 表达高于正常小鼠,提示RCC2 在食管癌中表达上调。过表达RCC2 后细胞增殖增加,抑制RCC2 表达后细胞增殖减少,提示RCC2 可能通过调控细胞周期,参与食管癌细胞增殖。
SOX2 是转录因子SOX 家族的成员,与靶基因HMG结构域结合,参与调控胚胎发育、维持细胞的干性和自我更新等过程[11]。上皮来源的恶性肿瘤,如食管癌、肺癌、口腔癌、皮肤癌等,均可见SOX2 表达上调,提示SOX2 可能与肿瘤EMT 过程有关[12]。还有研究发现,SOX2 通过调控胃癌细胞周期,阻滞细胞凋亡,从而影响胃上皮细胞的生长,并与胃癌临床预后不良有关[13],提示SOX2可能通过调控肿瘤细胞周期,参与肿瘤进展。目前发现SOX2 的启动子区与PCNA、Snail 存在多个结合位点,其中PCNA 是一种DNA 聚合酶的辅助蛋白,在细胞DNA 复制过程不可或缺,其在细胞静止期表达水平较低,G1 期开始增加,S 期达到峰值,随后G2 期明显下降,因此其表达水平能有效评价肿瘤细胞DNA 合成状态和细胞增殖动力水平[14]。MO 等[15]研究发现,SOX2 能通过调控同样为转录因子的Snail,参与食管鳞癌的恶化。还有研究发现,抑制SOX2 表达后,胃癌细胞增殖能力受限,PCNA 蛋白表达水平明显下降[16]。与SOX2 相同的是,Snail 也是一种转录因子,是最早发现的Snail 超家族成员,在食管癌、胃癌、结肠癌等多种恶性肿瘤中表达上调[17]。Snail 是肿瘤细胞EMT过程的标志物之一,与肿瘤复发、转移密切相关。相关研究发现,SOX2 能分别靶向作用PCNA、Snail,增强小鼠成瘤能力,促进食管癌细胞的增殖和自我更新[18]。本研究结果表明,RCC2 与SOX2 具有靶向调控作用。过表达RCC2 后,细胞中SOX2及SOX2 靶基因PCNA、Snail 相对表达量均明显升高,反之降低,提示RCC2 可靶向调控SOX2 及其靶基因,从而促进食管癌细胞增殖。相关研究发现,胃癌细胞中RCC2 过表达可抑制SOX2 泛素化过程,促进SOX2 与其靶基因启动子区结合,增强SOX2 转录活性[19]。还有研究认为,在RCC2 沉默的肺癌细胞中过表达SOX2 能正向调控细胞存活,拮抗RCC2 沉默对细胞增殖的抑制作用[20],这可能是RCC2 通过调控SOX2 的表达,促进肿瘤细胞增殖的原因之一。
综上所述,RCC2、SOX2 在食管癌细胞中均呈高表达,且RCC2 能通过上调SOX2 及其靶基因的表达,提高食管癌小鼠细胞增殖能力,进一步对食管癌的进展产生影响。但RCC2 调节信号通路众多,可能有多种信号通路参与食管癌细胞增殖过程,且目前尚不清楚SOX2 与RCC2 靶基因启动子区结合的作用机制。

