内镜下经鼻蝶切除垂体腺瘤术后并发尿崩症相关因素分析
吴世忠 魏 德 林 堃 郑鹏锋
福建省立医院南院神经外科,福建福州 350010
垂体腺瘤好发于青壮年,于颅内肿瘤中发病率仅次于脑膜瘤和神经胶质瘤[1-2]。临床工作中可根据个体化需要选择外科手术、药物治疗、放射治疗多种方式联合治疗的方案,其中外科手术是治疗的重要手段[3]。在经鼻蝶入路垂体腺瘤手术中神经内镜能更加清晰、完整地探查显露病灶及周围组织结构,大大提高了手术切除率,但中枢性尿崩症发生率始终居高不下,本研究选取相关文献中出现频率最高的可能因素纳入研究[4-8],以期为将来临床工作提供理论依据。
1 资料与方法
1.1 一般资料
回顾性分析2015年6月至2018年9月福建省立医院南院收治的97 例垂体腺瘤患者的临床资料。纳入标准:①术后病理证实为垂体腺瘤;②采用内镜下经鼻蝶垂体腺瘤切除术; ③可随访6~12 个月且病例资料完整。排除标准:①非首次手术或术前接受放化疗的患者;②采用经鼻蝶显微镜手术或传统开颅手术的患者;③术前即已表现为多尿或尿崩患者;④病历资料缺失、失访患者。本研究经医院医学伦理委员会审核批准,患者及家属对本研究知情同意。
1.2 方法
常规全麻手术,采用单鼻孔/双鼻孔入路,向蝶筛隐窝方向塞入含有0.01%肾上腺素脑棉片,逐渐扩张手术通道,收缩鼻黏膜,内镜下磨钻沿蝶窦开口磨除蝶窦前壁、暴露鞍底,磨开鞍底骨质,根据肿瘤大小,开放直径约1~1.5 cm 骨窗,用穿刺针穿刺鞍内,抽吸排除动脉瘤后,用直镰状刀 “十” 字形或放射状切开硬膜,先用取瘤镊取部分肿瘤组织做病理检查,用环形刮匙和吸引器分块切除肿瘤,在内镜下探查瘤腔,直视下切除残余肿瘤,注意观察保护周围正常解剖结构,同时观察有无脑脊液漏。如出现高流量脑脊液漏,留取大腿外侧脂肪组织和干燥人工脑膜填塞鞍内瘤腔、重建鞍底,鼻黏膜瓣翻转覆盖鞍底,双侧鼻腔填塞膨胀海绵[9]。术后平卧或床头少许抬高,监测术后1~3 d 每小时尿量,术后4~7 d 的24 h 尿量及血生化情况,及时纠正水钠等电解质紊乱。
1.3 观察指标
尿崩症的诊断标准[13]:①排除术后过度补液、高血糖、脱水利尿剂引起多尿;②临床表现烦渴多饮;③尿量大于液体入量,尿量>250 ml/h,且连续2 h 以上,或尿量>4000 ml/24 h;④尿比重<1.005 或尿渗透压<300 mmol/L。
观察分析指标包括性别、年龄、肿瘤大小、肿瘤功能性、肿瘤侵袭性、肿瘤生长类型(是否突破鞍膈)、肿瘤切除程度、手术时长。
参考《中国垂体腺瘤外科治疗专家共识(2015)》[10]垂体腺瘤分类标准,微腺瘤(直径≤10.0 mm);大腺瘤(10.0 mm<直径≤30.0 mm);巨大腺瘤(直径>30.0 mm)。根据术前激素水平和术后的组织学和免疫组化特征,将肿瘤分为功能性腺瘤与无功能性腺瘤[9-10]。
采用国际上广泛使用的Knosp 分级系统[11]对垂体腺瘤进行影像学上侵袭性分级,依据术前磁共振冠状位影像上肿瘤侵犯海绵窦的程度,将垂体腺瘤分为Knosp 0~4 级,其中Knosp 0~2 级定义为局限性,Knosp 3~4 级为侵袭性。此外还较常根据影像学上垂体腺瘤有无鞍上生长来诊断垂体腺瘤侵袭性,但对于肿瘤向鞍上生长是否代表肿瘤具有侵袭性一直有争议,本研究根据核磁共振影像肿瘤是否突破鞍膈,将所纳入病例分为鞍上生长型和鞍下生长型腺瘤。
肿瘤切除率=(术前肿瘤体积-术后残余体积)/术前肿瘤体积×100%。参考Hoffman 分级[12]:肿瘤切除率达到100%为全切除,90%~99%为近全切除,70%~89.9%为次全切除,70%以下为部分切除。
1.4 统计学方法
采用SPSS 19.0 统计学软件进行数据分析,计量资料用均数±标准差(±s)表示,两组间比较采用t 检验;计数资料用率表示,组间比较采用χ2检验;单因素分析中,差异有统计学意义的变量,纳入多因素logistic 回归分析,以P<0.05 为差异有统计学意义。
2 结果
2.1 基本资料
97 例患者中,术后50 例发生尿崩。男44 例,女53 例;年龄19~74 岁,平均(54.96±10.75)岁;无功能性腺瘤35 例,功能性腺瘤62 例;微腺瘤21 例,大腺瘤者58 例,18 例巨大腺瘤;局限型腺瘤77 例,侵袭型腺瘤20 例;鞍上生长型腺瘤26 例,局限于鞍下生长型腺瘤71 例;手术时间66~212 min,平均(114±26.57)min;肿瘤全切除56 例,达到近全切除33 例,次全切除6 例,部分切除2 例。
2.2 垂体腺瘤术后尿崩症的单因素分析
单因素分析显示,两组的肿瘤生长类型、手术时间比较,差异有统计学意义(P<0.05),而性别、年龄、肿瘤功能性、肿瘤大小、肿瘤侵袭性和肿瘤切除率比较,差异无统计学意义(P>0.05)(表1)。
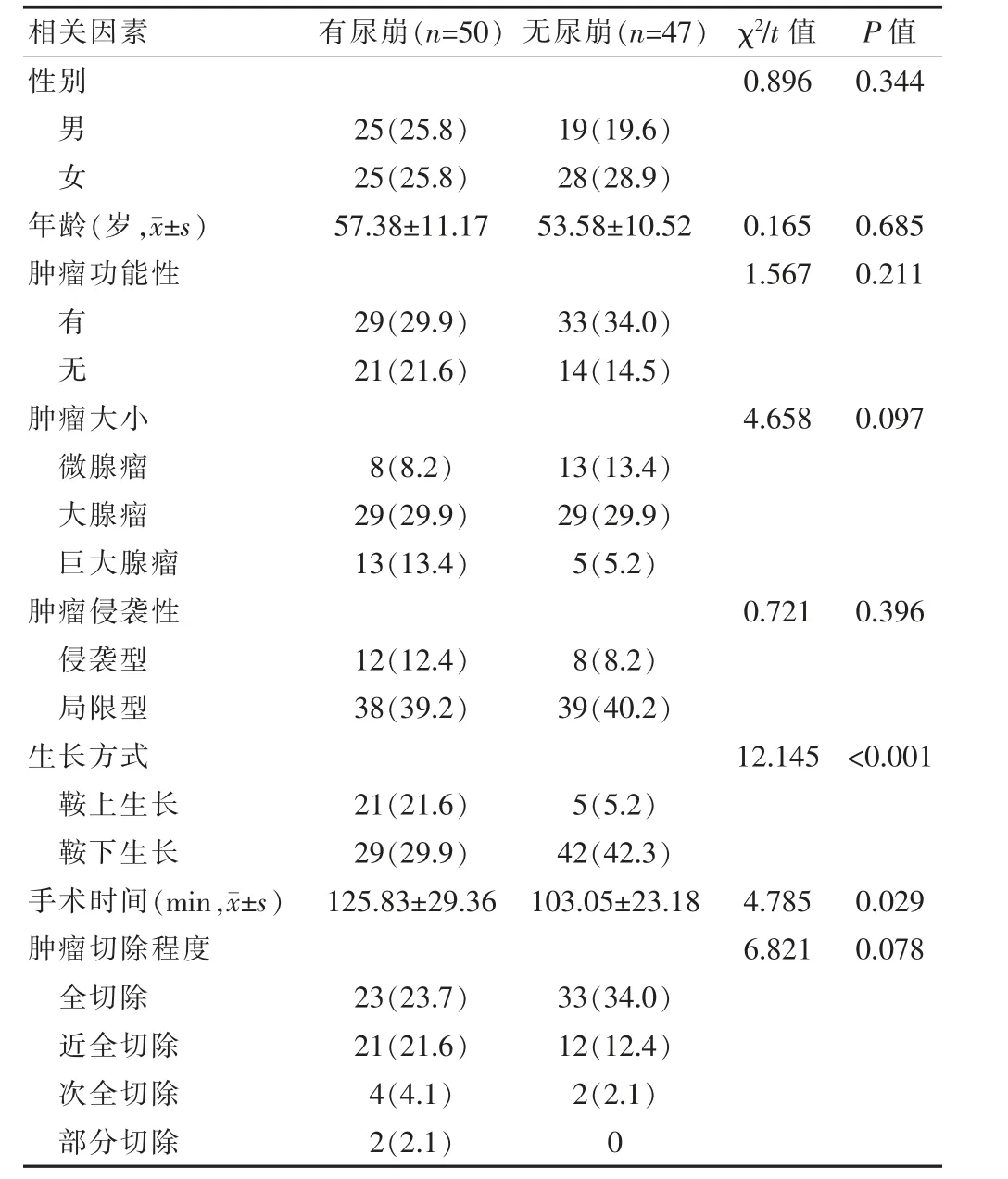
表1 垂体腺瘤术后尿崩症的单因素分析[n(%)]
2.3 垂体腺瘤术后尿崩症的多因素logistic 回归分析
将肿瘤生长类型、手术时间予以赋值(表2),纳入多因素logistic 回归分析,结果显示,肿瘤生长类型是内镜下经鼻蝶入路切除垂体腺瘤术后发生尿崩症的独立影响因素(P<0.05),鞍上生长型垂体腺瘤术后更易发生尿崩(表3)。

表2 术后尿崩症相关因素赋值情况
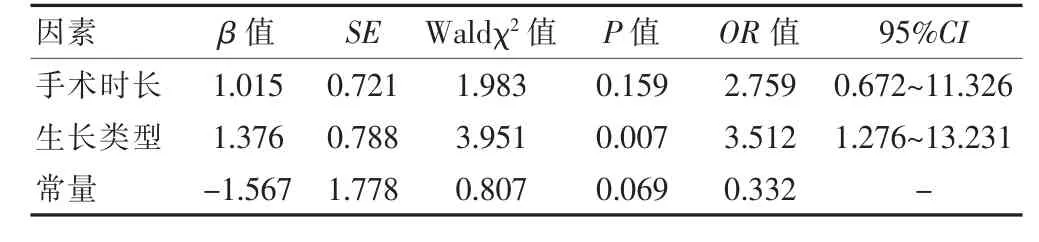
表3 垂体腺瘤术后尿崩症的多因素logistic 回归分析
3 讨论
神经内镜技术凭借其照明良好、视野清晰、操作灵活的特点,广泛应用于经鼻蝶入路垂体腺瘤的手术治疗中[14-15],然而因鞍区周围毗邻重要血管神经,术后常出现尿崩症、低钠血症、低钾血症、颅内感染、颈内动脉损伤、脑脊液鼻漏等多种并发症,其中术后中枢性尿崩症发生率远高于其他并发症[16-17]。
本组研究所纳入97 例患者中50 例术后发生中枢性尿崩,经统计分析,肿瘤生长类型(是否突破鞍膈)(P<0.05),表明鞍上生长型的垂体腺瘤术后出现尿崩症的风险高,考虑系因医源性损伤导致抗利尿激素(antidiuretic hormone,ADH)的合成、转运和释放过程中任意环节出现异常,血液中ADH 不足,肾小管重吸收功能障碍,最终导致中枢性尿崩症[18]。首先,垂体腺瘤向鞍上生长,手术操作需鞍上扩展,必将增加垂体柄及下丘脑损伤的风险;其次,鞍上生长型垂体腺瘤往往体积较大,与周围正常组织结构关系紧密,手术剥离更易损伤,且由于垂体后叶、垂体柄和丘脑下部长期受压,相应血管及神经功能受损,组织的代偿功能差,轻微损伤即可造成ADH 合成、分泌不足;第三,神经内镜须通过在小范围区域内使用高度集中的光源长时间照射,会对正常的垂体及周围组织造成热损伤[19],而增加术后尿崩症发生的概率。
要预防和减少术后尿崩症的发生,首先术前需认真评估影像资料,对于微小腺瘤,应明确位置,减少手术操作;对于体积较大的腺瘤,明确其与垂体后叶、垂体柄、丘脑下部的关系,手术过程不可盲目追求肿瘤完全切除,避免过多损伤。其次,术中应仔细辨别正常垂体与病变组织,同时注意保护垂体柄及丘脑下部血管,避免损伤。第三,避免鞍内过快减压牵拉造成丘脑下部减压性损伤。第四,术中操作应尽量减少使用电凝,避免损伤正常血管,同时应注意间断术区冲水降温,减轻电凝及长时间光源照射所致的热辐射损伤丘脑下部。
综上所述,肿瘤生长类型与内镜下经鼻蝶入路切除垂体腺瘤术后发生尿崩症相关,突破鞍膈鞍上生长型垂体腺瘤术后更易并发中枢性尿崩,临床工作中术前应充分评估影像资料,术中谨慎操作降低尿崩症的发生率。

