经皮内镜下椎板间入路椎间盘切除术隐性失血的危险因素分析
张 钰,胡 满,张 亮,蔡同川,王俊武,赵文杰,朱 磊,刘 鑫
(扬州大学临床医学院脊柱外科,江苏扬州225001)
经皮内镜下腰椎间盘切除术(percutaneous endoscopic lumbar discectomy,PELD)是治疗腰椎间盘突出症的常用微创手术之一,具有手术创伤小、住院时间短、恢复快及临床效果明显等优点[1-4]。PELD通常包括经皮内镜下椎间孔入路椎间盘切除术(percutaneous endoscopic transforaminal discectomy,PETD)和经皮内镜下椎板间入路椎间盘切除术(percutaneous endoscopic interlaminar discectomy,PEID)[5-6]。目 前 对L5-S1节段的手术以PEID方式更为多见。PEID手术中实际观察到的出血量较少,大多数脊柱外科医生并不明确PEID手术的实际失血量。SEHAT等[7]于2000年对全膝关节置换术研究发现,术中显性失血与手术前后计算得出的失血量有显着差异,由此定义了术中隐性失血(hidden blood loss,HBL)的存在。近年来,随着对HBL研究的不断深入,既往一般认为脊柱微创手术围手术期HBL很少,但在经皮椎体后凸成形术(percutaneous vertebroplasty,PKP)、经皮椎体成形术(percutaneous vertebroplasty,PVP)及颈椎前路椎间盘切除融合术(anterior cervical discectomy and fusion,ACDF)中均发现HBL明显高于围手术期显性失血,且在总失血量中占较大比例[8-10]。阐明HBL能更准确地评估PEID所致的总失血量,对患者围手术期的安全性具有重要意义。而目前未见PEID围手术期HBL的相关报道。本研究对113例进行PEID的患者进行回顾性分析,计算HBL并分析其相关危险因素。
1 资料与方法
1.1 研究对象及纳入标准与排除标准
选择2018年1月至2020年8月在扬州大学附属苏北人民医院脊柱外科进行PEID且临床资料完整的113例L5-S1节段腰椎间盘突出症患者,其中男67例,女46例,年龄21~71岁。纳入标准:①腰腿痛明显和下肢感觉异常(刺痛感、烧灼感及麻木感),并伴有或不伴有神经功能障碍,阳性的神经根张力征(直腿抬高试验阳性),保守治疗无效者;②相应的神经功能缺损征象(不对称的肌腱反射、皮肤分布的感觉受损及肌力下降);③影像学检查(CT及MRI)提示L5-S1节段腰椎间盘突出压迫神经根[11];④手术方案由同一科室专家组参与制订;⑤初次腰椎手术者。排除标准:①腰腿痛与其他疾病相关,包括代谢性疾病及其他相关系统疾病;②脊柱感染、肿瘤、椎间盘炎及脊柱结核;③腰椎不稳或腰椎滑脱超过两个节段;④复发性腰椎间盘突出症;⑤手术前后服用抗凝药物;⑥术前凝血功能异常者;⑦病例资料不全;⑧围手术期使用增加血红蛋白水平的药物(如促红细胞生成素等)。
1.2 临床数据的收集
患者一般指标包括年龄、体质指数(body mass index,BMI)及性别。基础疾病包括高血压病及糖尿病。实验室检查包括凝血酶原时间、活化部分凝血活酶时间、纤维蛋白原、术前及术后第2天的红细胞压积(hematocrit,Hct)及血红蛋白水平。手术相关情况包括术中显性失血量及手术时间。
1.3 影像学指标
根据腰椎MRI(T2WI)进行Pfirrmann椎间盘退变的标准分级。椎板间入路软组织厚度测量以MRI在轴位上测量皮肤至腰椎间盘突出侧椎板中点的距离(图1A)。椎板间隙高度测量以上位椎板下缘最高点和下位椎板上缘最低点(C、D两点)与椎板间隙最宽处(E点)连线,再分别取其中点(f、h两点),两中点连线的距离即为椎板间隙高度(图1B)。
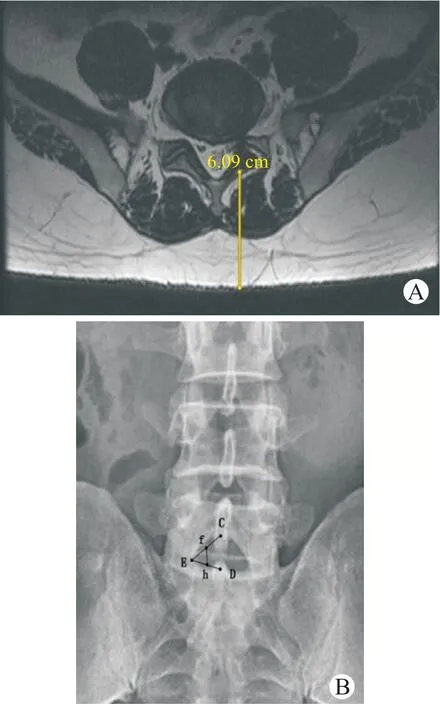
图1 典型病例腰椎间盘突出症的影像学数据测量Fig.1 MRI measurement of soft tissue thickness of interlaminar disc herniation
1.4 术中显性失血量的计算
采用血红蛋白质量浓度测定法计算术中出血量[12-13]:术中出血量=冲洗液标本血红蛋白质量浓度(g/L)×冲洗液总体积(mL)/术前血红蛋白质量浓度(g/L)。由于本研究PELD术后未放置引流管,因此认为显性出血量=术中出血量。
1.5 HBL的计算
根据Nadler公式[14]计算血容量,血容量=k1×身高3(m)+k2×体质量(kg)+k3。其中男性的k1、k2及k3分 别 为0.136 69、0.103 22及0.160 41,女 性 的k1、k2及k3分别为0.135 61、0.103 31及0.118 33。
通过手术前后Hct的变化,根据Gross公式计算围术期总出血量[15]:总出血量=人体血液总量×(Hct术前-Hct术后)/Hct平均。
HBL=总出血量-显性出血量。
1.6 统计学分析
采用SPSS 25.0统计软件进行统计分析,计量资料以均数±标准差(±s)表示。对计量资料进行正态性和方差齐性检验,单因素分析采用t检验和单因素方差分析。以皮尔逊相关分析评价手术时间、年龄、BMI、凝血酶原时间、活化部分凝血活酶时间、纤维蛋白原、术前血红蛋白水平、椎板间隙高度以及椎板间入路软组织厚度与隐性失血的相关性。分析结果中满足线性、独立、正态分布、齐性且有重要临床意义和统计学意义的数据纳入多变量线性回归分析中。正系数表示对因变量HBL的正影响,而负系数表示对因变量为负影响。以P<0.05为结果有统计学意义。
2 结 果
2.1 患者的一般资料以及失血量情况
纳入113例患者的平均年龄(47.75±13.04)岁,平 均BMI(23.81±2.72),平 均 手 术 时 间(81.02±23.15)min,平均显性出血量(59.55±14.96)mL,平均HBL(337.09±124.98)mL,平均总出血量(394.85±130.50)mL,隐性失血量占总出血量的85.4%。
2.2 实验室相关指标的变化
手术前后血红蛋白丢失量(13.17±6.76)g/L,手术 前 后Hct丢 失 量(3.75±1.24),凝 血 酶 原 时 间(12.00±0.94)s,活化部分凝血活酶时间(32.22±6.22)s,纤维蛋白原(2.90±0.66)mg/dL。
2.3 HBL危险因素的单因素分析
椎间盘退变分级(P=0.017)与HBL有相关性,性别(P=0.199)、高血压病(P=0.908)及糖尿病(P=0.721)与HBL无明显相关性(表1)。

表1 隐性失血危险因素的单因素分析Tab.1 Univariate analysis of risk factors of hidden blood loss(HBL)
2.4 HBL的Pearson相 关 分 析
手术时间(P<0.001)与HBL有相关性,年龄(P=0.089)、BMI(P=0.657)、术前血红蛋白水平(P=0.555)、凝血酶原时间(P=0.301)、活化部分凝血活酶时间(P=0.743)、纤维蛋白原(P=0.494)、椎板间隙高度(P=0.959)及椎板间入路软组织厚度(P=0.731)与HBL无明显相关性(表2)。
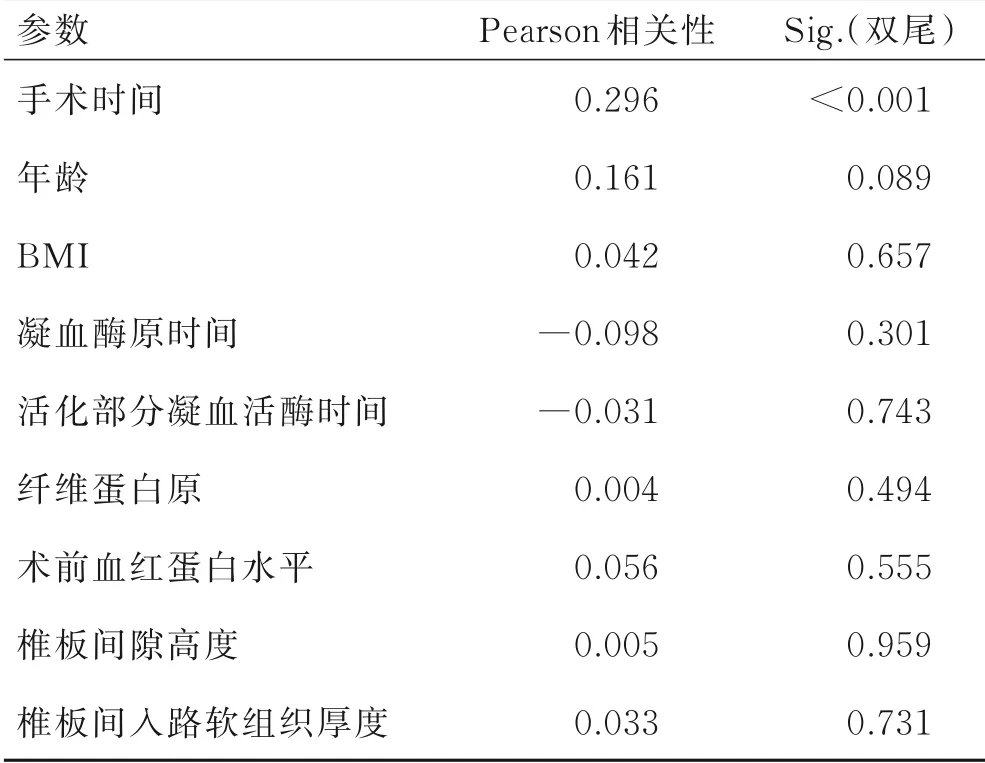
表2 隐性失血危险因素的Pearson相关分析Tab.2 Pearson correlation analysis of risk factors of hidden blood loss(HBL)
2.5 多变量线性回归分析
经单因素和Pearson相关分析,发现手术时间和椎间盘退变分级与HBL有显著相关性;同时将年龄和BMI作为主要影响因素,一并纳入回归分析,结果发现,手术时间(P<0.001)和椎间盘退变分级(P=0.020)是HBL的独立危险因素(表3)。
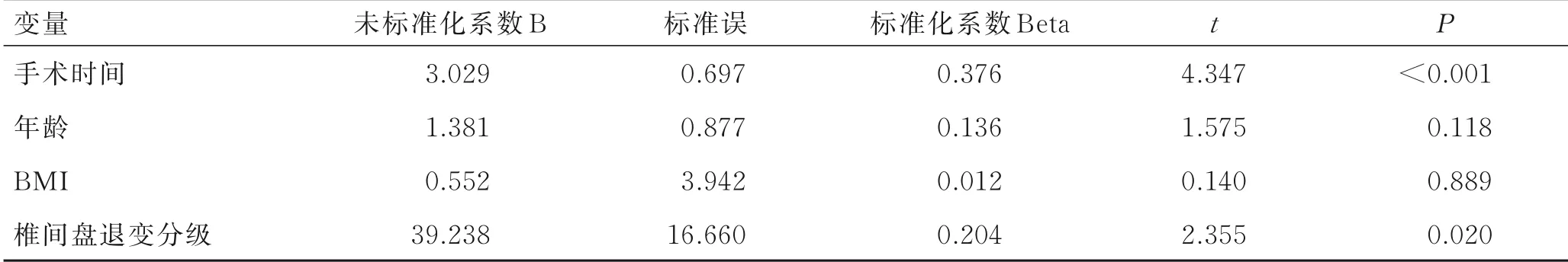
表3 隐性失血的多变量线性回归分析Tab.3 Multivariate linear regression analysis of hidden blood loss
3 讨 论
腰椎间盘突出症是引起腰痛、下肢放射性疼痛及麻木的常见原因。目前PELD已成为腰椎间盘突出症的首选治疗方案之一[1-4]。既往一般认为PELD为微创手术,手术切口小及手术时间短,术中失血量几乎可以忽略不计,因此,其围手术期失血常被脊柱外科医生忽略。近年来研究发现,小切口微创手术围手术期也存在明显HBL。在脊柱微创手术中,主要集中在PKP、PVP及ACDF手术[8-10],但很少有报道PEID围手术期隐性失血的相关研究。WU等[8]报道PKP围手术期HBL为282 mL,本研究组前期研究发现PVP围手术期HBL为215 mL[9],WEN等[10]则报道ACDF围手术期HBL为261 mL。本研究同样发现,在PEID中平均HBL高达337 mL,明显多于显性失血量,约占总失血量的85.4%。因此,在PEID围手术期需要重视评估HBL,尤其对于高龄体弱及术前存在贫血的老年患者。
文献报道,PKP的手术时间、椎体高度丢失百分比及椎体高度恢复百分比对围手术期HBL有重要影响[8]。在ACDF手术中,性别和ASA分级对围手术期HBL有重要影响[10]。本研究组前期对PVP治疗老年骨质疏松性椎体压缩骨折手术中HBL危险因素的分析发现,新鲜骨折、多节段椎体骨折、手术时间延长及骨水泥渗漏等对围手术期HBL有重要影响[9]。虽然PEID手 术 与ACDF、PKP及PVP手 术 均 为 微 创 手术,但手术方式有不同之处,因此,研究PEID手术围手术期HBL的危险因素尤为重要。
WEN等[10]研究发现手术时间是ACDF围手术期HBL的独立影响因素,同时CAO等[16]研究也发现手术时间是PKP围手术期HBL的独立影响因素。本研究同样发现手术时间越长可能有更多的HBL,其原因可能与冲洗时间长、创面磨损时间长及炎症反应更剧烈引起的溶血增加有关。另外,本研究发现,椎间盘退变分级也是PEID围手术期HBL的独立危险因素。分析可能是椎间盘退变严重者,术中不易完全取出椎间盘,因此需扩大手术范围以获得更加清晰的手术视野,增加椎间隙的操作空间,从而可能导致更多的红细胞渗入组织间,导致HBL增加。另外,在扩大减压范围需切除更多椎板的同时,也可能引起椎板骨面出现骨折间隙,从而引起更多的血液流入死腔。
本研究发现,HBL与性别、年龄、BMI、高血压病、糖尿病及术前凝血功能等因素无关。但在如腰椎后路融合手术、腰椎骨折切开复位内固定术及颈椎后路单开门等手术中,相关研究结论则不尽相同,例如在腰椎后路融合手术中,纤维蛋白原水平对围手术期HBL影响较大[17];在腰椎骨折切开复位内固定术手术中,术前活化部分凝血活酶时间也会增加HBL[18]。在颈椎后路单开门椎管扩大成形术中,性别是围手术期HBL的独立影响因素[19]。不同手术中的危险因素不一,分析其原因可能与手术方式有关,相对于其他微创手术,PEID手术创面更小,软组织暴露更少。
因此,在PEID术中应尽可能控制可变因素(手术时间),从而尽可能减少HBL。对于围手术期不可变危险因素(椎间盘退变分级),需要提高围手术期HBL的认识,加强围手术期监测,尤其对于高龄及术前存在贫血的老年患者。
由于本研究是回顾性研究,存在一定的局限性;因患者住院时间短,仅记录到术后第2天的观察结果,未进行长期随访;患者数量相对较少,存在假阳性及偏倚可能,尚需大样本的前瞻性研究进一步验证研究结果;此外,不能排除种族差异对本研究结果的影响。
综上所述,PEID围手术期存在明显的HBL,应重视HBL的存在以确保患者安全。手术时间和椎间盘退变分级是PEID手术围手术期HBL增加的危险因素。

