骨形态发生蛋白2信号对肿瘤组织中调节性T细胞分化和浸润的作用
黄 菲,王 海,陈尧清,吴 贵
福建医科大学附属第一医院 1中心实验室 2骨科,福建福州 350005
骨形态发生蛋白(bone morphogenetic protein,BMP)2是转化生长因子β(transforming growth factor β,TGF-β)家族的一员[1]。人BMP2作为一种BMP分子,具有很强的诱导成骨潜能,在肌肉组织中也能诱导骨形成[2]。此外,有报道表明BMP2在肿瘤的发生发展中具有作用[3]。然而,BMP2信号在癌症发展中的作用尚存争议。有报道表明BMP2/4信号的活化可以抑制结肠癌干细胞的自我更新,但增强癌干细胞的分化,并进一步提高结肠癌细胞对化疗的敏感性[4-5]。然而,BMP还可诱导结肠癌细胞的上皮细胞间充质转化,从而促进癌细胞的生长和转移[6-7]。此外,BMP信号在乳腺癌、前列腺癌和胰腺癌中高表达可能与这些肿瘤的恶性进展密切相关[8-9]。有研究表明BMP2信号的活化可通过激活髓样抑制性细胞(myeloid-derived suppressor cells,MDSC)促进肝癌的生长[10]。调节性T淋巴细胞(regulatory T lymphocyte,Treg)具有免疫抑制功能。在肿瘤恶性进展过程中,肿瘤组织中Treg细胞的活化可促进肿瘤细胞逃逸机体的免疫监视,从而促进肿瘤的生长[11]。转化生长因子TGF-β在诱导Treg的分化中具有重要作用[12]。本研究旨在明确BMP2信号是否通过增强MDSC分泌TGF-β诱导肿瘤组织Treg的分化和浸润,以促进肿瘤的发生和进展。
材料和方法
材料抗体:抗-CD4-异硫氰酸荧光素(fluorescein isothiocyanate isomer,FITC)(Biolegend公司,货号100405);抗CD25-别藻蓝蛋白(allophycocyanin,APC)(Biolegend公司,货号101909);抗叉头转录因子(forkhead box P3,Foxp3)-藻红蛋白(phycoerythrin,PE)(Biolegend公司,货号126403);抗-CD8-FITC(Biolegend公司,货号100705);抗CD11b-FITC(Biolegend公司,货号101205);抗Ly6G-PE(Biolegend公司,货号127607);抗Foxp3-APC(联科生物公司,货号70-AM0F05- 100);抗CD- 3(Biolegend公司,货号145- 2C11)。生长因子:小鼠粒巨噬细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor,GMCSF)(R&D公司,货号415-ML- 005),纯度大于97%,其诱导小鼠淋巴瘤细胞增殖的半数有效剂量为5~30 pg/ml;人源重组骨形态发生蛋白2(recombined human bone morphogenetic protein 2,rhBMP2)(R&D公司,货号355-BM- 010),纯度大于95%,每微克包含BMP2活性分子781 U,其诱导软骨细胞向成骨细胞分化的半数有效剂量为40~200 ng/ml,人BMP2与小鼠BMP2具有很高的同源性,其氨基酸序列同源性高达95.7%,蛋白C端关键区域同源均为100%,完全保守,前期已经有大量的研究在小鼠体内验证rhBMP2的生物学功能,并取得了理想的生物学效应[13-15]。rhBMP2能够成功地活化小鼠细胞的BMP2受体,并活化经典的BMP信号传导通路而发挥生物学效应[16]。因此,本文使用重组人BMP2研究小鼠的细胞及肿瘤,该方案具有合理性;白介素(interleukin,IL)- 2(派普泰克生物科技公司,货号200- 02),纯度大于98%,每毫克包含IL- 2活性分子1×107U,其诱导小鼠CTLL细胞活化的半数有效剂量<0.1 ng/ml。小鼠TGF-β酶联免疫吸附检测试剂盒购自eBiosciences公司,货号85-BMS608- 4 。大鼠尾胶原蛋白Ⅰ购自Cornin公司,货号356236。Tris-HCl、NaCl和其他化学试剂购自Sigma公司。
流式细胞术
MDSC细胞的分选:将ICR小鼠骨髓样品重悬于含2%胎牛血清(fetal bovine serum,FBS)的磷酸盐缓冲盐溶液(phosphate buffered saline,PBS)中,在4 ℃下用抗体将表面分子CD11b和Ly6G染色30 min后使用BD公司的BD FACS Aria Ⅲ流式分选仪进行分选,获得MDSC细胞。将细胞样品重悬于含2%FBS的PBS中。
T淋巴细胞的分选:将ICR小鼠脾脏和淋巴结匀浆后重悬于含2%FBS的PBS中,裂解红细胞,在4 ℃下用抗体将表面分子CD3染色30 min后使用BD公司的BD FACS Aria Ⅲ流式细胞分选仪进行分选,获得T淋巴细胞。
Treg细胞的检测:在4 ℃下用抗体将表面分子CD4和CD25染色30 min。然后将细胞在室温下用4%多聚甲醛固定20 min。Foxp3在通透缓冲液(PBS中0.2%皂苷和2%FBS)中于4 ℃染色1 h。使用BD公司的BD FACS C6流式细胞分析仪进行流式细胞术分析,结果通过软件FlowJo 7.6.1进行分析。
细胞培养
MDSCs的体外培养和激活:收获ICR小鼠骨髓细胞,用上述流式细胞术分选MDSC细胞。 按组添加10 ng/ml GMCSF(R&D公司,货号415-ML- 005)[17]和20 ng/ml rhBMP2(R&D公司,355-BM- 100),BMP2的有效浓度为10~300 ng/ml[18-20],培养72 h。
Treg细胞的诱导:收集小鼠脾脏和淋巴结,在含5%FBS的RPMI- 1640培养液中研磨,制成单细胞悬液。用上述流式细胞术分选T淋巴细胞。在具有20 U/ml IL- 2和5 μg/ml抗CD3的完全RPMI- 1640培养液中培养[21],并按照实验分组加入MDSC细胞条件培养基,培养72 h。
rhBMP2胶原凝胶的制备将rhBMP2溶解在PBS中以获得1 mg/ml的浓度。对于每种rhBMP2胶原凝胶,将7.5 μl rhBMP2溶液添加到150 μl鼠尾Ⅰ型胶原溶液(质量/浓度:3%)中并均匀混合;对照组仅添加7.5 μl PBS。之后,再向上述鼠尾Ⅰ型胶原溶液中加入3 μl 1 mol/L NaOH,将pH值调节至7.0。含或不含rhBMP2的胶原蛋白溶液在37 ℃下保存2 h,形成胶原蛋白凝胶。
小鼠ICR小鼠50只,雌性,鼠龄4~8周,来源于吴氏实验动物公司,在福建医科大学特定的无病原体动物设施中饲养。观察终末断颈处死小鼠收取实验标本。所有动物实验均经福建医科大学动物伦理委员会批准(2018- 039)。
小鼠皮下成瘤模型将5×105个H22细胞皮下注射到每只ICR小鼠的腹部,以建立小鼠皮下成瘤模型。待7 d后肿瘤长出,将实验小鼠分为两组,每组8只,一组为rhBMP2局部植入模型组,将rhBMP2胶原凝胶冻干后,制成rhBMP2胶原材料,埋植小鼠的臀部肌袋内;一组为对照组,植入空白胶原凝胶。
实时荧光定量PCR用TRIzol(英维杰公司)分离细胞总RNA,并用Revertra Ace试剂盒(普罗麦格公司)合成cDNA。 使用ABI公司的荧光实时定量PCR仪ABI QuantStudio 5系统进行实时PCR。 使用比较性循环数(Ct法)测量基因的mRNA表达水平。以内参基因β-肌动蛋白表达为基准值,将目标基因的表达值标准化为相对mRNA表达水平。引物序列为:β-肌动蛋白:正向:5’-ACCAACTGGGACGATATGGAGAAGA- 3’;反向:5’-TACGACCAGAGGCATACAGGGACAA- 3’。TGF-β:正向:5’-GGCGGTGCTCGCTTTGTA- 3’;反向:5’-TTTCT-CATAGATGGCGTTGTT- 3’。
酶联免疫吸附测定肿瘤组织和血清标本的标准化:用胶原蛋白凝胶包载rhBMP2。给ICR小鼠接种H22癌细胞。在第7天,将小鼠随机分成两组。然后,将rhBMP2胶原蛋白凝胶植入小鼠的臀部肌袋中,而对照组仅植入空胶原蛋白凝胶。手术后14 d处死荷瘤小鼠,收获外周血和肿瘤组织标本。收获小鼠肿瘤组织,将肿瘤组织置于PBS中匀浆,获得组织悬液。采用EDTA- 3K抗凝,收获小鼠外周血,12 000 r/min于室温离心5 min(转子半径10 cm),收获小鼠血清。通过BCA测定将所有源自肿瘤和血清的样品定量至蛋白浓度为10 mg/ml。 BCA试剂盒来自碧云天公司,货号P0009。将来自肿瘤或小鼠的血清样本进行TGF-β酶联免疫吸附实验分析。
组织免疫荧光检测将组织包埋在石蜡中,切成3 μm的组织切片,组织切片用二甲苯脱蜡。 然后将切片用100%- 95%- 75%酒精梯度重新水化。在0.01 mol/L柠檬酸盐缓冲液(pH=6.0)中于95 ℃抗原修复15 min后,将切片用CD8-FITC抗体和Foxp3-APC抗体在4 ℃染色过夜。然后加入抗荧光淬灭剂(碧云天公司,货号P0128)封片观察。图像由奥林巴斯显微镜BX53拍摄。
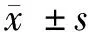
结 果
BMP2对MDSC分泌TGF-β的作用首先分选MDSC细胞(图1),并用GMCSF和GMCSF+BMP2诱导MDSC的活化,结果显示GMCSF+BMP2诱导MDSC的活化组的TGF-β mRNA表达水平为GMCSF活化组的(1.409±0.237)倍,在GMCSF诱导活化的MDSC中加入BMP2可以促进MDSC的TGF-β mRNA表达升高(t=3.165,P=0.0435)。GMCSF诱导MDSC活化组培养上清TGF-β蛋白水平为(46.91±3.65)pg/ml,而GMCSF+BMP2诱导MDSC活化组培养上清TGF-β蛋白水平为(141.62±13.99)pg/ml,GMCSF+BMP2组与GMCSF组比较差异有统计学意义(t=11.360,P=0.0002)。

MDSC:髓源抑制性细胞;FITC:异硫氰酸荧光素;PE:藻红蛋白
BMP2增强MDSC分泌TGF-β对Treg细胞分化的调节作用TGF-β处理可以显著促进Treg细胞的分化[对照组比TGF-β组:(6.34±0.36)%比(30.63±1.21)%,q=6.973,P=0.0027]。组间比较结果显示GMCSF+BMP2诱导MDSC分泌的细胞培养上清相较于GMCSF单独诱导MDSC分泌的细胞培养上清诱导Treg细胞的分化明显增加[GMCSF组比GMCSF-BMP2 条件培养基组:(20.13±3.03)%比(34.50±1.56)%,q=4.929,P=0.0413]。 TGF-β信号通路受体抑制剂SB505124处理T细胞,能抑制GMCSF+BMP2诱导MDSC分泌的细胞培养上清增强Treg细胞的分化[GMCSF-BMP2条件培养基组比 GMCSF-BMP2条件培养基-TGF-β抑制剂组:(34.50±1.56)%比(16.43±4.23)%,q=6.198,P=0.0076;GMCSF-BMP2 条件培养基-BMP2抑制剂组比 GMCSF-BMP2 条件培养基-TGF-β抑制剂-BMP2抑制剂组:(33.20±2.58)%比(15.27±4.02)%,q=6.153,P=0.0081];但是BMP2信号通路受体抑制剂LDN193189处理则无此作用[GMCSF-BMP2 条件培养基组比GMCSF-BMP2 条件培养基-BMP2抑制剂组:(34.50±1.56)%比(33.20±2.58)%,q=0.4460,P=0.9999](图2)。
载BMP2材料对荷肝癌小鼠外周血和肿瘤组织TGF-β表达水平的作用植入BMP2材料的荷肝癌小鼠外周血中TGF-β浓度为(11.33±0.97)ng/ml,而对照组荷肝癌小鼠外周血中TGF-β浓度为(6.37±2.11)ng/ml,rhBMP2胶原蛋白凝胶植入荷瘤小鼠体内可增加小鼠外周血TGF-β水平(t=2.355,P=0.0326)。肿瘤组织中载BMP2材料植入的荷肝癌小鼠肿瘤组织TGF-β浓度为(21.40±4.90)ng/ml,而对照组荷肝癌小鼠肿瘤组织TGF-β浓度为(7.70±2.84)ng/ml,rhBMP2胶原蛋白凝胶植入荷瘤小鼠体内可增加小鼠肿瘤组织中TGF-β水平(t=2.584,P=0.0246)。
载BMP2材料对荷肝癌小鼠肿瘤组织中Treg细胞的浸润作用rhBMP2胶原蛋白凝胶植入荷瘤小鼠体内可以促进肝癌的生长,载BMP2材料组肿瘤组织的平均质量为(0.81±0.17)g,而对照组肿瘤组织的平均质量为(0.20±0.06)g,差异具有统计学意义(t=3.436,P=0.0032)。载BMP2材料植入组肿瘤组织中抗肿瘤的CD8+阳性的T细胞的浸润百分率较对照组显著减少[(19.31±10.08)%比(0.37±0.51)%,t=3.213,P=0.0126],而载BMP2材料植入组肿瘤组织中Foxp3+的Treg细胞的浸润百分率较对照组显著增加[(0.59±0.51)%比(2.67±0.57)%,t=5.210,P=0.0032](图3)。
讨 论
rhBMP2具有强大的骨诱导性,载rhBMP2成骨材料已被广泛应用于临床骨缺损的治疗。尽管有报道rhBMP2在诱导新的骨再生方面令人满意的结果,但rhBMP2应用后产生的一些并发症,如术后神经根炎、异位骨形成、水肿,尤其是致癌作用等[2],引起了人们对其安全性问题的关注。2010年,美国食品药品监督管理局报告,rhBMP2的应用可显著增加患者癌症的发生率[2]。既往有报道载rhBMP2成骨材料可促进肝癌的进展,并提出rhBMP2是通过诱导MDSC细胞分化的方式促进肝癌细胞的生长[10]。本研究进一步深入讨论rhBMP2成骨材料促进肝癌进展的机制,发现rhBMP2可诱导MDSC细胞分泌TGF-β,进一步诱导Treg细胞的分化。本研究不仅从免疫学角度深入探讨了rhBMP2促进肝癌进展的机制,也为肿瘤患者慎重使用载rhBMP2成骨材料提供了依据。
有研究显示循环中的BMP2可以促进外周血MDSC的扩增以及肿瘤中MDSC的浸润,从而促进肝癌的生长[10]。MDSC是肿瘤微环境的主要组成部分之一。MDSC有两种不同类型:多形核MDSC和单核MDSC。它们在骨髓中产生并迁移到肿瘤中以调节癌症的免疫反应[22]。它们具有免疫抑制活性可以导致肿瘤进展[23]。有报道MDSC通过产生活性氧[24]、IL- 10[25]、TGF-β[26]诱导癌症中的T细胞功能障碍。还有研究报道MDSC通过IL- 6增强肿瘤进展[27-28],活化的MDSC可以通过分泌IL- 6、IL- 8和IL- 10促进癌症的进展[29-30]。既往研究显示,BMP2信号激活了MDSC分泌IL- 6,从而进一步增强肝癌细胞的增殖[10]。本研究进一步发现BMP2信号激活了MDSC分泌TGF-β,并促进Treg细胞的分化。由于Treg细胞具有免疫抑制作用,其活化能够促进肿瘤的发生和生长[31]。因此,本研究在既往研究的基础上,进一步完善了BMP2信号通路可能通过诱导MDSC活化促进肿瘤发生和生长的机制。

BMP2:骨形态发生蛋白2;Treg:调节性T淋巴细胞;Foxp3:抗叉头转录因子;TGF-β:转化生长因子β;GMCSF:小鼠粒巨噬细胞集落刺激因子

A.NS;B.BMP2
转化生长因子TGF-β在诱导Treg的分化中具有重要作用[12]。TGF-β是诱导Treg细胞活化的经典细胞因子,TGF-β信号通路的活化在Treg细胞形成早期即可发挥关键性的作用。TGF-β信号通路既可以通过关键转录因子Foxp3调节Treg细胞的活化,也可以独立于Foxp3发挥调节作用[32]。既往研究表明TGF-β可以通过活化Treg促进肝癌细胞的生长[33]。阻断TGF-β信号活化可以通过抑制Treg细胞的功能起到抗肿瘤的作用[34]。此外,Moo-Young等[35]研究表明,肿瘤微环境中Treg细胞膜表达的TGF-β受体可以受到胰腺癌细胞分泌的肿瘤源性TGF-β的刺激,从而调节肿瘤的免疫耐受。然而,BMP2作为TGF-β超家族的一员,既往研究表明BMP2不能直接诱导Treg细胞分化,然而它可以协同TGF-β诱导Treg细胞分化[36]。本研究表明GMCSF+BMP2处理的MDSC细胞培养上清可以促进Treg细胞分化,并且该促进作用可以被TGF-β抑制剂阻断,而BMP2阻断剂对此作用无影响,表明BMP2信号可以单独活化MDSC并分泌TGF-β,从而间接促进Treg细胞的分化。本研究验证了BMP2调控Treg细胞活化以促进肿瘤生长的机制,对完善BMP2信号通路的免疫调节机制以及BMP2信号通路在肿瘤微环境中的作用具有一定的意义。BMP2信号通路有望成为抗肿瘤治疗的药物靶点。同时,由于载BMP2植骨材料在骨缺损治疗中的应用[2],揭示BMP2促进肿瘤生长的机制,对于载BMP2植骨材料的安全性评价具有警示作用。

