人Runt相关转录因子3、zeste基因增强子同源物2蛋白表达与局部进展期直肠癌新辅助化疗敏感性的关系
袁泽龙,武雪亮,屈 明,薛 军,韩 磊,孙光源
河北北方学院附属第一医院 1介入科 2普通外科,河北张家口 075000
Runt相关转录因子3(runt-related transcription factor 3,RUNX3)是一种抑癌基因,属于转录因子runt域家族,在主要发育通路中作为基因表达的主调控因子,定位在人染色体lp36.1上,由6个外显子、2个启动子以及1个开放阅读框构成,在细胞的生长、发育、生物学效应、信号转导以及凋亡等方面发挥着重要作用,由Bangsow等[1]首先发现。近年研究显示,RUNX3基因直肠癌中存在异常表达,且其低表达常与肿瘤的恶行生物学行为及不良预后有关[2]。果蝇zeste基因增强子人类同源物2基因(enhancer of zeste homolog 2,EZH2)是多梳基因家族中的核心成员。EZH2基因定位于人染色体7q35上,覆盖近40 kb,包含20个外显子、19个内含子,外显子长度为41~323 bp,内含子长度为0.15~17.7 kb,在细胞增殖、分化及肿瘤形成方面均有重要作用[3]。有研究表明直肠癌中RUNX3的沉默与EZH2有关[4],接受新辅助化疗后患者癌组织中的RUNX3表达下降[5]。因此,本研究旨在探讨RUNX3和EZH2在直肠癌中表达的相关性及其与新辅助化疗敏感性的关系,为局部进展期直肠癌患者治疗方案的决策提供参考。
资料和方法
病例资料1收集2019年1月至2020年1月河北北方学院附属第一医院收治的术前未经抗肿瘤治疗的直肠癌手术患者共31例,取患者手术切除标本肿瘤中心组织和肿瘤远端距肿瘤大于5 cm的正常肠组织,分别定义为癌组和癌旁组。
入组标准:(1)经本院活检病理或病理会诊诊断为直肠癌,病理类型为腺癌;(2)术前经电子肠镜确认肿瘤为单发,经盆腔核磁共振成像及胸+腹部+盆腔增强CT等辅助检查明确无远处转移;(3)术前未经抗肿瘤治疗;(4)行开腹或腹腔镜直肠癌全系膜切除术(total mesorectal excision,TME),术程顺利。
排除标准:(1)存在远处转移;(2)合并多原发癌或其他恶性肿瘤史;(3)既往接受过肿瘤相关治疗;(4)患者拒绝手术或因各种原因更改手术方案;(5)拒绝参与研究者。
病例资料2选取2018年9月至2020年6月河北北方学院附属第一医院收治的术前经新辅助化疗的中低位进展期直肠癌患者29例,取患者新辅助治疗前活检蜡块和手术后病理蜡块,分别定义为治疗前组和治疗后组。
入组标准:(1)接受新辅助治疗前1个月内经本院病理活检确诊为直肠腺癌;(2)术前经电子肠镜确认肿瘤为单发,经盆腔核磁共振成像及胸+腹部+盆腔增强CT检查明确无远处转移;(3)新辅助治疗前活检病理切片及蜡块等病理资料完整;(4)根据2016年美国癌症联合委员会肿瘤分期第八版标准,经术前影像学评价肿瘤临床分期为T3~T4和/或N阳性[6];(5)完成3周期新辅助化疗:XELOX方案(奥沙利铂130 mg/m2,1 d;卡培他滨2000 mg/m2,1~14 d,3周为1周期);(6)新辅助化疗结束3~4周后行TME手术。
排除标准:(1)存在远处转移;(2)合并多原发癌或其他恶性肿瘤史;(3)既往接受过抗肿瘤治疗;(4)因各种原因未完成新辅助化疗、化疗后更改治疗方案或至其他医院接受手术;(5)拒绝参与研究者。
所有入组患者均知情同意,本课题经河北北方学院附属第一医院伦理委员会审核通过。
主要试剂微量总RNA提取试剂盒(TR150- 50)购于北京天漠科技开发有限公司;反转录试剂盒(RX20402)购于武汉爱博泰克生物科技有限公司;qPCR试剂盒(RX21203)购于武汉爱博泰克生物科技有限公司;兔抗人RUNX3单克隆抗体(EPR20687)购于英国Abcam公司;兔抗人EZH2单克隆抗体(EPR9307- 2)购于英国Abcam公司;二步法SP通用试剂盒(SP- 9001)购于北京中杉金桥生物技术有限公司;DAB显色试剂盒(ZLI- 9018)购于北京中杉金桥生物技术有限公司;苏木素染液(BA- 4025- 1)购于珠海贝素生物技术有限公司。
新辅助化疗治疗前组和治疗后组患者接受术前全身化疗共3个周期,采用XELOX方案,具体为:奥沙利铂130 mg/m2,首日静脉输注;卡培他滨2000 mg/m2,1~14 日口服,14~21日间歇,每3周为1周期,3周期化疗完成后间隔3~4周行手术治疗[7]。
手术方式及标本采集各组患者均由同一手术团队行TME手术,具体术式根据患者肿瘤距肛缘位置选择Dixon手术或Miles手术;癌组及癌旁组在手术标本离体30 min内,取癌灶中心非坏死区域及距离肿瘤5 cm以上正常肠组织各200 mg于液氮中保存,用于实时荧光定量PCR,取材后手术标本由组织固定液浸泡并送至病理科由同一病理医师进行标准病理取材和蜡块制备;治疗前组及治疗后组手术方式及手术团队与上述相同,手术标本离体后立即由组织固定液浸泡并送至病理科进行蜡块制备。
实时荧光定量PCR法检测癌组、癌旁组RUNX3和EZH2 mRNA的表达取直肠癌及癌旁组织各5 mg,彻底匀浆,提取总RNA,测定RNA浓度,逆转录合成模板DNA;引物设计RUNX3上游引物:5’-TCAACG- ACCTTCGCTTCGTG- 3’,下游引物5’-CACGGTCACCT-TGATGGCTC- 3’;EZH2上游引物:5’-AGCGGATAAA-GACCCCACCAAAAC- 3’,下游引物:5’-TCCCTGCTTCC-CTACCACTGTCTG- 3’;GAPDH上游引物:5’-CGGAT-TTGGTCGTATTGGG- 3’,下游引物:5’-CTGGAAGATG-GTGATGGGATT- 3’;20 μl反应体系:实时荧光定量PCR预混液10 μl、模板DNA 2 μl、上、下游引物各0.4 μl及无RNA酶水7.2 μl;反应程序:95 ℃预变性1 min,95 ℃ 5 s并60 ℃ 30 s预循环5次,95 ℃ 5 s并60 ℃ 30 s末读荧光循环40次;每组织取3个样本,每样本设置3个复孔重复实验,溶解曲线为单峰,存在典型S型扩增曲线为循环阈值(cycle threshold,Ct)有意义;采用ΔΔCt相对定量法分析结果,mRNA相对表达量用2-ΔΔCt表示。
免疫组织化学检测癌组、癌旁组、治疗前组和治疗后组RUNX3和EZH2蛋白的表达各组石蜡标本依次进行4 μm切片、脱蜡及水化,磷酸盐缓冲液(phosphate buffer saline,PBS)冲洗3 min×3次,细胞通透后PBS冲洗3 min×3次,内源性过氧化物酶封闭,PBS冲洗3 min×3次,抗原修复冷却至室温,血清封闭37 ℃孵育10 min,滴加一抗4 ℃孵育12 h,PBS冲洗3 min×3次,滴加二抗37 ℃孵育30 min,PBS冲洗3 min×3次,滴加辣根过氧化物酶室温孵育10 min,PBS冲洗3 min×3次,DAB显色室温孵育(RUNX3 3.5 min,EZH2 5 min),苏木素复染,盐酸-乙醇分化,脱水,透明,封片,观察。
RUNX3和EZH2均定位于细胞核中,二者阳性表达为棕黄色或棕褐色,所有切片均由河北北方学院附属第一医院病理科相同两名副高级职称以上医师阅片:两位观察者在高倍镜下共同随机选取5个视野同时观察,分别评估染色程度与染色细胞比例,具体标准如下:染色程度:不染色为0分,淡黄色为1分,棕黄色为2分,深棕色为3分;染色细胞比例:≤5%为0分,>5%且≤25%为1分,>25%且≤50%为2分,>50%为3分。上述二项得分相乘,≤3分为阴性,>3分为阳性。
肿瘤缩退学评估由两位具有副高级以上职称的病理科医师进行病理评估,两位医师事先对患者一般资料一无所知。肿瘤消退反应根据美国癌症联合委员会肿瘤退化分级(tumor regression grade,TRG)系统[6]评估,具体如下:TRG0级:完全反应,肿瘤完全消退,无癌细胞残留;TRG1级:肿瘤中度消退,仅剩少量镜下癌灶;TRG2级:肿瘤轻度消退,可见残留癌细胞,但仍以纤维化为主要改变;TRG3级:肿瘤消退不良,残留大量肿瘤细胞伴极少或无纤维化,以TRG0~TRG2为新辅助化疗疗效好。
统计学处理所有统计分析均采用SPSS 25.0软件进行。计量资料采用均数±标准差表示,正态性检验采用夏皮洛-威尔克检验(Shapiro-Wilk test),对不符合正态分布的数据组间比较采用非参数检验(Wilcoxon符号秩检验)分析;计数资料采用百分率表示,组间比较n>40采用卡方检验,n≤40采用Fisher确切概率法;多因素Logistic回归分析影响新辅助化疗疗效的因素,相关性采用斯皮尔曼(Spearman)相关系数法分析。检验水准α=0.05,P<0.05为差异有统计学意义。
结 果
RUNX3和EZH2 mRNA在癌组和癌旁组中的表达癌组RUNX3 mRNA的平均相对表达量为3.04±1.12,癌旁组中为7.78±2.11;癌组中EZH2 mRNA的平均相对表达量为1.70±0.56,癌旁组中为1.27±0.52,各组数据均不符合正态分布(W=0.928,P=0.039),癌组和癌旁组相比,RUNX3和EZH2 的mRNA相对表达量差异均有统计学意义(P<0.001)。将癌组RUNX3和EZH2 mRNA相对表达量绘制散点图,可见二者呈负相关(r=-0.599,P=0.000)(图1)。
RUNX3和EZH2蛋白在癌组和癌旁组中的表达免疫组织化学染色法检测RUNX3和EZH2的表达,癌旁组肠腺细胞结构清晰,大小均匀,排列规则,癌组腺癌细胞大小不一,排列混乱,失去了正常的结构,RUNX3和EZH2蛋白染色均定位于细胞核上(图2)。RUNX3 蛋白在癌组阳性表达率为35.48%(11/31),低于癌旁组77.42%(24/31)(χ2=11.088,P=0.001);EZH2蛋白在癌组阳性表达率为67.74%(21/31),高于癌旁组38.71%(12/31)(χ2=5.284,P=0.022)。
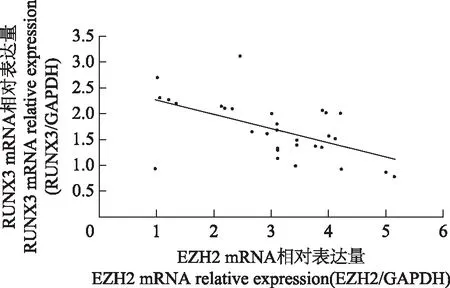
RUNX3:Runt相关转录因子3;EZH2:zeste基因增强子同源物2
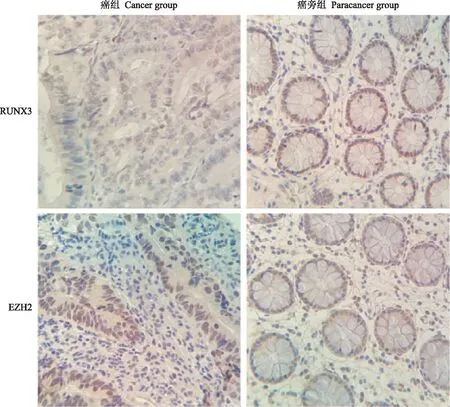
图2 癌组和癌旁组中RUNX3和EZH2蛋白的表达(×400)
XELOX方案新辅助化疗疗效29例入组患者中,1例患者未完成3周期新辅助化疗,1例患者新辅助化疗完成后放弃进一步治疗,另有1例患者3周期新辅助化疗完成后转至其他医院继续治疗,故上述3例患者排除出组,最终共26例患者完成新辅助化疗并接受TME手术。26例患者中,46.15%(12/26)的患者疗效良好,其中TRG0级1例、TRG1级1例、TRG2级10例,其余患者TRG分级均≥3(图3)。
RUNX3和EZH2蛋白在治疗前组和治疗后组中的表达免疫组织化学染色法检测RUNX3和EZH2在治疗前组和治疗后组中的表达:新辅助治疗前,1例入组患者的肿瘤活检显示RUNX3为阴性、EZH2为阳性,而新辅助治疗后,肿瘤组织中RUNX3表达转为阳性,同时EZH2转为阴性(图4)。RUNX3蛋白在治疗前组中阳性表达率为46.15%(12/26),在治疗后组中阳性表达率为65.38%(17/26)(χ2=1.949,P=0.163),两组表达差异无统计学意义;EZH2蛋白在治疗前组中阳性表达率为65.38%(17/26),在治疗后组中阳性表达率为42.31%(11/26)(χ2=2.178,P=0.095),两组表达差异无统计学意义;治疗前组RUNX3阳性表达的患者中,新辅助化疗有效率为75.00%(9/12),阴性表达的患者新辅助化疗有效率为21.43%(3/14)(P=0.036),差异有统计学意义;治疗前组EZH2阳性表达的患者新辅助化疗有效率为29.41%(5/17),阴性表达的患者新辅助化疗有效率为77.78%(7/9)(P=0.038),差异有统计学意义;RUNX3+/EZH2-的患者新辅助化疗有效率为100%(7/7),高于RUNX3+/EZH2+、RUNX3-/EZH2-和RUNX3-/EZH2+患者的新辅助化疗有效率(P=0.019);以新辅助化疗疗效为因变量,RUNX3和EZH2蛋白的表达情况为自变量赋值带入多因素Logistic回归逐步回归法分析,显示RUNX3蛋白表达情况是影响患者新辅助化疗疗效的影响因素。
TRG:肿瘤缩退学分级;箭头指向为新辅助治疗后
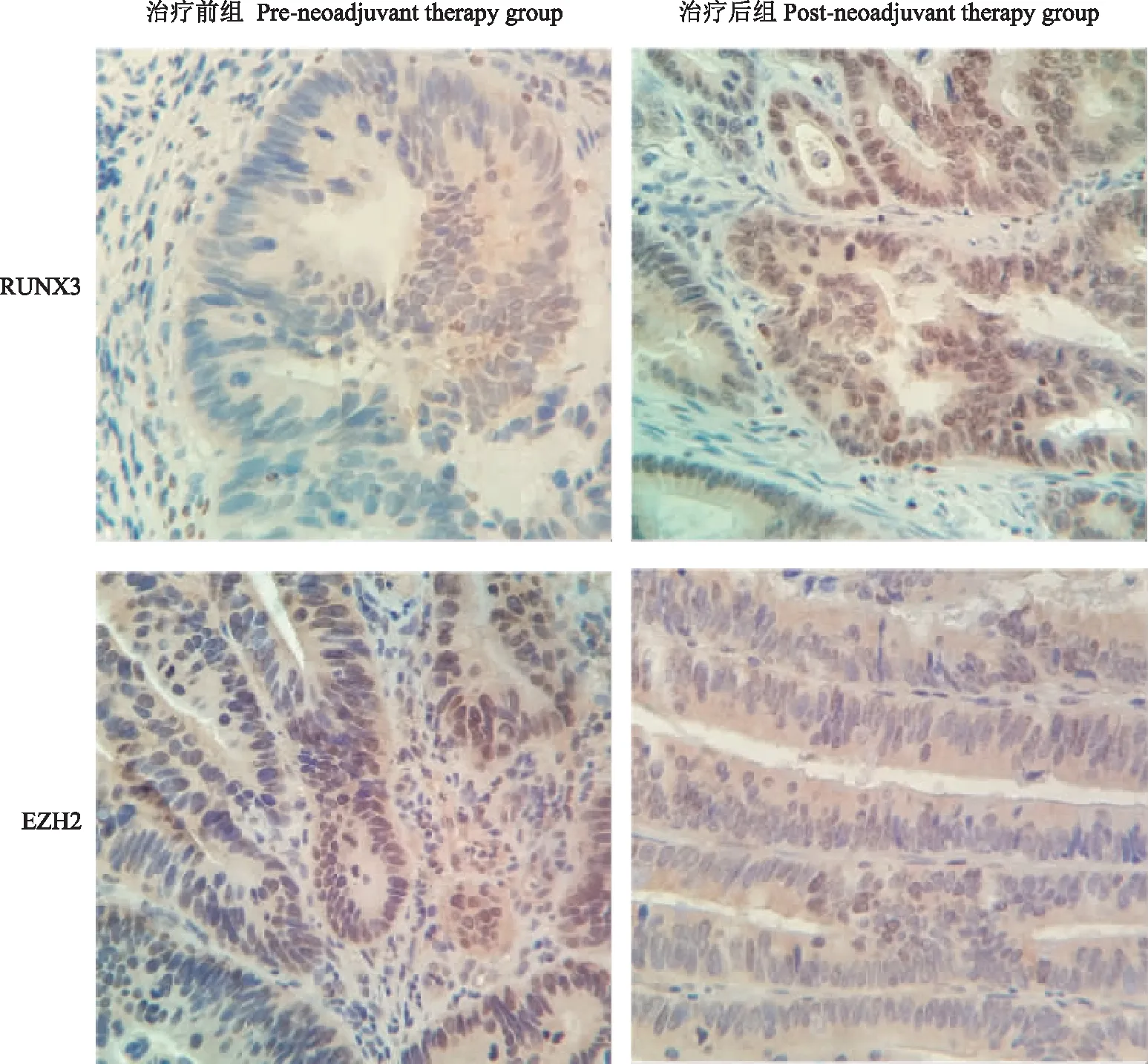
图4 治疗前组和治疗后组中RUNX3和EZH2蛋白的表达(×400)
讨 论
研究表明在多种恶性肿瘤中RUNX3可以抑制肿瘤的细胞生长[8- 10]。这种作用主要通过调控转录生长因子β(transforming growth factor-β,TGF-β)和Wnt信号传导通路实现。RUNX3是TGF-β信号传导通路下游的一个重要的转录因子,其所含的结构域负责结合靶DNA。TGF-β激活后与TGF-β受体 Ⅰ 和 Ⅱ 相结合,产生异四聚体复合物,触发细胞内信号通路。TGF-β信号传导主要通过激活Smad蛋白实现,TGF-β信号传导通路的配体、受体和胞内信号传导分子Smad蛋白组成一个抑制肿瘤信号的通路。Smad蛋白需在RUNX蛋白(包括RUNX3蛋白)的指导下,才能从细胞质内转入特定的靶位点,与RUNX蛋白共同转录激活靶基因,从而对细胞分化、细胞周期调控、凋亡和恶性转化起作用。RUNX3可以与Wnt信号通路的关键效应器T细胞因子4和β-连环蛋白形成复合物,抑制T细胞因子4/β-连环蛋白结合物与靶DNA的结合,从而减弱目标基因的转录,调控Wnt信号通路,从而抑制肿瘤细胞的形成。本团队前期研究证实,直肠癌的发生发展过程中,RUNX3基因的失活发挥重要作用,RUNX3在直肠癌组织中的表达低于癌旁组织[11- 14]。He等[15]亦报道了类似结果,本研究与之前研究结果一致。
EZH2基因主要参与转录抑制,导致包括抑癌基因在内的一系列靶基因高度失活[16- 17]。EZH2有4个结构域,即同源结构域 Ⅰ(H1 区)、同源结构域 Ⅱ(H2区)、半胱氨酸富含区和赖氨酸甲基转移酶催化基序,其赖氨酸甲基转移酶催化基序结构域可以对H3组蛋白的第27位赖氨酸(H3K27)进行甲基化修饰发挥沉默靶基因的作用,这是EZH2基因调节肿瘤细胞的增殖、分化,促进肿瘤发生和转移的主要途径。甲基化是导致RUNX3基因在多种恶性肿瘤中低表达的重要原因[18- 19],研究显示在神经胶质瘤中,EZH2可通过诱导RUNX3的H3K27发生甲基化,使其发生表观遗传学沉默[20]。本研究显示在直肠癌中,EZH2呈高表达状态,这与于立刚等[21]和Tan等[22]的结果一致,同时,本研究显示EZH2和RUNX3在直肠癌中的表达呈负相关,可能在直肠癌中EZH2同样可通过诱导H3K27发生甲基化的方式沉默RUNX3基因,后续可进一步探究EZH2是否可在直肠癌中下调RUNX3的表达。
新辅助治疗是在术前对患者进行单一放疗、化疗或同步放化疗的方法,期望肿瘤回缩、降期,进而提高手术治疗的成功率[23]。对于距肛门<12 cm的直肠癌,我国指南推荐T3+期和/或N+的可切除直肠癌患者,可行以氟尿嘧啶类药物为基础的新辅助放化疗或单纯新辅助化疗[7]。XELOX方案已被证实是一种安全可行的新辅助化疗方案[24],能够提高肿瘤完全性切除率、改善患者的生存率。高树全等[25]研究报道,术前两疗程FOLFOX4方案化疗联合36~40 Gy术前短程放疗可以提高肿瘤组织中RUNX3的阳性表达率,本研究结果显示在新辅助化疗前后,肿瘤组织中RUNX3的阳性表达率上升与上述研究结果趋势相同,但差异无统计学意义,同时本研究显示,新辅助治疗后EZH2在肿瘤组织中的阳性表达率有上升的趋势,但差异无统计学意义,目前关于EZH2在直肠癌新辅助治疗前后表达变化的研究报道较少。笔者分析出现基因表达趋势较明显但差异无统计学意义的结果可能有以下几个原因:第一,本研究与前述研究的新辅助治疗方案不同,本研究采用单纯XELOX方案化疗,可能是导致目标基因在新辅助治疗前后表达差异无统计学意义的原因;第二,高树全等[25]的研究病例数为50,本研究入组患者仅26例,样本量小可能也是导致该结果的原因,后续可继续扩大样本量深入研究。
本研究结果与其他实体瘤的研究成果基本一致,食管鳞癌中,EZH2高表达的肿瘤侵袭性更强,对放化疗敏感性更差[26]。化疗的敏感性是非常复杂的问题,由一系列内在的和外部因素调控,包括细胞周期阻滞、细胞凋亡和DNA损伤修复[27]。pRb/E2F/EZH2途径可能是影响肿瘤对化疗敏感性的重要机制,EZH2是pRb/E2F通路重要的下游靶目标,能够调节E2F的功能进而实现对细胞周期的调控[28]。凋亡是多种抗肿瘤药物发挥作用的一个共同途径,肿瘤细胞能耐受抗癌药物诱导凋亡是肿瘤对化疗药物耐药的重要原因[29]。RUNX3的沉默可导致TGF-β信号通路的阻断,提高细胞的抗凋亡能力[8],本研究显示低表达RUNX3的患者新辅助化疗的有效率明显低于RUNX3高表达的患者。本研究入组患者中,新辅助治疗前阳性表达RUNX3蛋白同时阴性表达EZH2蛋白的患者共7例,新辅助化疗疗效好的概率为100%,高于其他蛋白表达类型的患者,但Logistic回归仅发现RUNX3蛋白的表达情况是新辅助化疗疗效的影响因素,笔者分析可能由于样本量较小导致EZH2蛋白的表达情况在Logistic回归分析中无统计学意义,而在本研究样本中,联合检测RUNX3和EZH2蛋白的表达对患者新辅助化疗疗效的预测作用优于单纯检测RUNX3蛋白或EZH2蛋白,后续应继续扩大样本研究进一步证实该结论。
综上,本研究显示,对于局部进展期直肠癌的患者,术前联合检测RUNX3和EZH2蛋白在肿瘤组织中的表达情况,可筛选出对XELOX方案新辅助化疗获益概率较大的人群,进而帮助临床医师对相应患者治疗方案的决策,使患者受益。

