[3+2]环化反应合成含1,2,3-三氮唑结构的黄酮衍生物
尹民海 庞 杰 庞婷婷 刘志平 黄燕敏 展军颜
(南宁师范大学化学与材料学院,广西南宁,530001)
1,2,3-三氮唑是一类含三个氮原子的五元杂环,在医药及化工中间体中具有重要应用价值[1,2]。德国化学家Rolf Husigen利用端炔和叠氮化物的1,3-偶极环加成反应建立了1,2,3-三氮唑类化合物的便捷合成方法。此后,利用Husigen反应合成具有1,2,3-三氮唑结构[3,4]的活性物质成为众多科研工作者的热点研究之一,如抗癌药carboxyamidotriazole[5]和cefatrizine[6]均含有1,2,3-三氮唑的骨架(图1)。
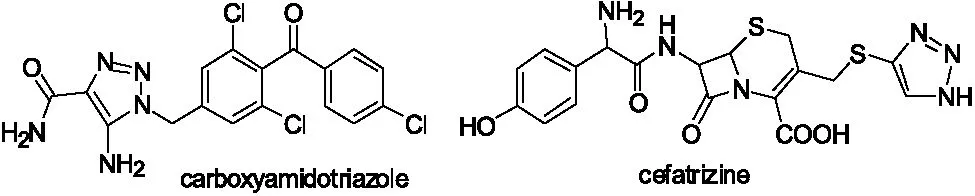
图1 carboxyamidotriazole和cefatrizine化学结构式
2021年Mansour Znati[7]在黄酮醇3-位羟基上通过引入溴丙炔,然后与不同结构叠氮化合物环化,合成了21个含三氮唑结构的衍生物(图2),体外抗肿瘤活性显示对人结肠癌细胞系HCT-116、人乳腺癌MCF-7及人卵巢癌OVCAR-3均能显著抑制活性,部分化合物的半抑制浓度(IC50)小于3.0 μM,显示出较好的潜在应用价值。黄酮醇属于黄酮类化合物的一种,若将1,2,3-三氮唑拼接到其他天然黄酮母体中,是否也会产生类似的活性?为此,本文选择了两种活性天然黄酮类化合物(白杨素属于黄酮、橙皮素属于二氢黄酮)为原料,通过7位酚羟基与溴丙炔醚化,然后分别与苄基叠氮化物或乙酸乙酯叠氮化物通过Husigen[3+2]环化反应,合成了8个含1,2,3-三氮唑结构的黄酮衍生物。合成路线如Scheme 1:

图2 含三氮唑黄酮醇结构
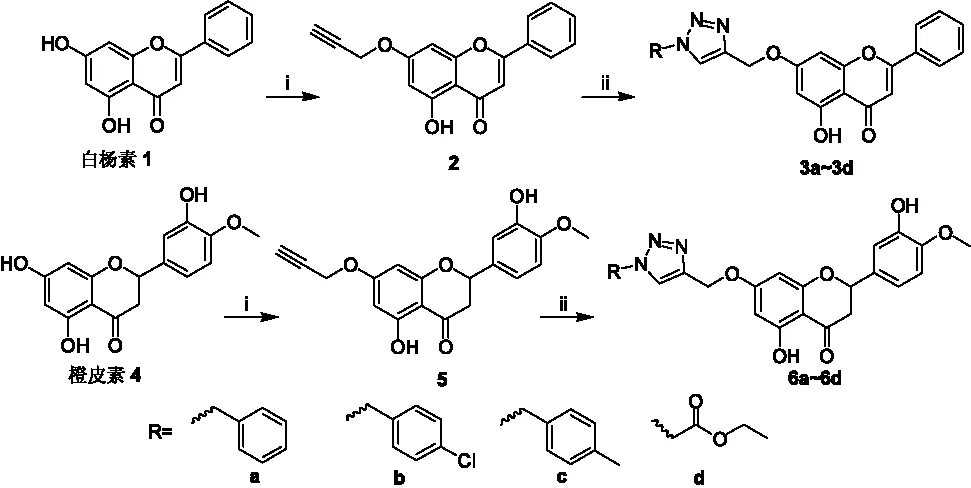
Reagents and conditions:(i) propargyl bromide + K2CO3/Atetone, 60℃;(ii) RCH2N3+CuSO4·5H2O+ sodium ascorbate /DMF, 90℃Scheme 1 含1,2,3-三氮唑结构黄酮衍生物的合成路线
1 实验部分
1.1 仪器与试剂
仪器:Bruker Avance-300型核磁共振波谱仪(TMS为内标,瑞士布鲁克公司生产);X-4显微熔点测定仪(巩义市予华仪器有限责任公司生产),温度计未经校正;BS200S电子天平(盐城市思锐电子仪器有限公司)。
试剂:白杨素和橙皮素购自陕西锦泰生物工程有限公司;其他实验试剂均为分析纯,购自百灵威科技有限公司;溶剂由天津大茂化学试剂厂生产。
1.2 实验方法
1.2.1 7-O-炔丙基白杨素(2)的制备
取白杨素0.153 g(0.6 mmol)、碳酸钾0.126 g(0.9 mmol),溶解于15 mL丙酮中,在室温下搅拌0.5 h后滴入3-溴丙炔58 uL(0.7mmol),升温到60℃反应2 h。旋干溶剂加10 mL水并用乙酸乙酯萃取3次(3×10 mL),有机层无水硫酸钠干燥,用硅胶柱层析分离(石油醚:乙酸乙酯=3∶1),得淡黄色固体2,产率90%。1H NMR (300 MHz, DMSO-D6): δ 2.59(1H, s, ≡CH), 4.94 (2H, s, -OCH2), 6.44(1H, d, J =2.4, 6-CH), 6.82(1H, d, J =2.4, 8-CH), 7.01(1H, s, 3-CH), 7.56~7.59(3H, m, 3′,4′, 5′-CH), 8.05(2H, d, J=8.1, 2′, 6′-CH), 12.81(1H, s, 5-OH);13C-NMR (75 MHz, DMSO-D6): δ 182.5, 164.0, 163.6, 161.6, 157.6, 132.6, 131.0, 130.0, 130.0, 126.9, 126.9 ,105.8, 105.7, 99.1, 94.2, 79.5, 78.8, 56.7。
1.2.2 7-O-(1,2,3-三氮唑-4-甲氧基)白杨素(3a~3d)的制备
取NaN30.052 g (0.8 mmol)溶解于DMF (15 mL)圆底烧瓶中,依次加入抗坏血酸钠0.067 g (0.34 mmol),CuSO4·5H2O 0.042 g(0.2 mmol)及化合物2 0.146 g (0.5 mmol),于90 ℃下搅拌反应6h。冷却后加15 mL水、乙酸乙酯萃取3次(3×10 mL),有机相无水硫酸钠干燥,减压去除溶剂,柱层析分离(石油醚:乙酸乙酯=3:1)得化合物3a~3d,产率69%~75%。
化合物3a:产率75%,m.p.182~184℃。1H NMR (300 MHz, DMSO-D6): δ 5.29 (2H, s, NCH2), 5.64 (2H, s, OCH2), 6.49(1H, s, 6-H), 6.94(1H, s, 8-H), 7.04(1H, s, 3-H), 7.34~7.46 (4H, m, Ph-H), 7.59~7.62(3H, m, Ph-H), 8.10(2H, d, J=7.8Hz, Ar-H), 8.36 (1H, s, Ar-H), 12.81(1H, s, 5-OH)·13C NMR (75 MHz, DMSO-D6): δ 182.5, 164.5, 164.0, 161.7, 157.8, 1426, 135.4, 133.4, 132.7, 131.1, 131.1, 130.4, 129.6,129.6, 129.2, 126.9, 125.6, 105.9, 105.6, 99.2, 94.1, 62.3, 52.6。
化合物3b:产率70%, m.p.190~191℃。1H NMR (300 MHz, CDCl3): δ 5.25 (2H, s, NCH2), 5.51(2H, s, OCH2), 6.41(1H, d, J =2.1, 6-CH), 6.61(1H, d, J=2.4, 8-CH), 6.66(1H, s, 3-CH), 7.18~7.22 (4H, m, Ph-H), 7.54~7.58(3H, m, Ph-H), 7.58 (1H, s, CH),7.88 (2H, d, J=8.1Hz, 2′, 6′-CH), 12.71 (1H, s, 5-OH);13CNMR (75 MHz, CDCl3): δ=182.6, 164.5, 164.0 , 161.7, 157.8, 142.6, 132.4, 133.4, 132.7, 131.1 , 130.4, 129.6, 129.2, 129.2, 126.9, 125.6, 125.6, 105.9, 105.6, 99.2, 94.1, 62.3, 52.6。
化合物3c:产率72%, m.p.198 ~ 199℃。1H NMR (300 MHz, CDCl3): δ 2.36 (3H,s, CH3), 5.25 (2H, s, NCH2), 5.51 (2H, s, OCH2), 6.41 (1H, s, 6-CH), 6.61 (1H, s, 8-CH), 6.66 (1H, s, 3-CH), 7.20(4H, s, Ar-H), 7.54-7.57 (3H, m, 3′,4′, 5′-CH), 7.88 (2H, d, J =5.4Hz, 2′, 6′-H), 12.71 (1H, s, 5-OH)·13C NMR (75 MHz, CDCl3): δ 182.5, 164.1, 164.1,162.1, 157.8, 143.0, 138.9, 131.2,131.1, 129.9, 129.9, 129.1,129.1, 128.2, 128.2, 126.3, 126.3, 122.8, 106.0, 105.8, 99.1, 93.3, 62.4, 54.2, 21.2。
化合物3d:产率69%,m.p.188~189℃。1H NMR (300 MHz, DMSO-D6): δ1.21(3H, t, J=7.2Hz, CH3), 4.19 (2H, q, J=7.2Hz, CH2), 5.32 (2H, s, NCH2), 5.44 (2H, s, OCH2), 6.49 (1H, d, J=2.1Hz, 6-H), 6.94 (1H, d, J =2.1Hz, 8-CH), 7.01 (1H, s, 3-CH), 7.58-7.62 (3H, m, J=3′,4′, 5′-CH), 8.07 (2H, dd, J = 2.4Hz, 8.1, 2′, 6′-H), 8.31(1H, s, CH), 12.80 (1H, s, 5-OH)·13CNMR (75 MHz, DMSO-D6): δ 182.5, 167.7, 164.5, 164.0, 161.7, 157.7, 142.3, 132.6, 131.0, 129.6, 126.9, 108.8, 105.6, 99.2(8-C), 94.0, 62.0, 60.2, 50.9, 14.5。
1.2.3 7-O-炔丙基橙皮素(5)的制备
7-O-炔丙基橙皮素5的合成方法与化合物2合成方法相同,将橙皮素替换白杨素,得白色固体5,产率68%,1H NMR (CDCl3, 300 MHz): δ 2.80 (1H, dd, J =3.0, 17.1 Hz,3-H ), 3.19 (1H, dd, J = 12.6, 17.1 Hz,3-H), 3.88 (3H, s, OCH3), 4.88 (s, 2H, OCH2), 5.50 (1H, dd, J =2.4, 12.6 Hz, 2-H), 6.13 (1H, d, J = 2.3 Hz, 6-H), 6.15 (1H,d, J =2.2 Hz, 8-H), 7.00 (2H, s, 2’,6’-H), 7.07 ( 1H,s, 5’-H), 8.42 (1H, s, CH), 12.14 (s, 1H, OH);13C NMR (CDCl3, 75 MHz): δ 196.9, 165.7, 163.9, 163.1, 147.8, 146.7, 131.7, 113.5,111.4, 103.3, 95.4, 94.1, 79.1, 78.0, 77.0, 55.9, 55.4, 42.6。
1.2.4 7-O-(1,2,3-三氮唑-4-甲氧基)橙皮素(6a~6d)的制备
7-O-(1,2,3-三氮唑-4-甲氧基)橙皮素(6a~6d)的合成方法与白杨素三氮唑衍生物(3a~3d)的合成方法相同,产率65%~73%。
化合物6a:产率69%,m.p.188~189℃。1H NMR (300 MHz, C3D6O): δ 2.21 (1H, s, C≡H), 2.78 (1H, dd, J=3.0, 17.1Hz, 3-H), 3.20 (1H, dd, J=12.6,17.1Hz, 3-H), 3.87(1H, s, OCH3), 5.25 (2H, s, CH2), 5.47 (1H, dd, J=3.0, 12.6Hz, 2-H), 5.66 (2H, s,CH2), 6.16 (1H, d, J=2.4Hz, 6-H), 6.18 (1H, d, J=2.4Hz, 8-H), 6.99 (2H,s, 2’,5’-H), 7.01(1H,s, 3’-H), 7.37 (5H, m, Ar-H), 7.92 (1H,s, 3’-OH), 8.14(1H, s, CH),12.14(1H, s, 5-OH);13C NMR (75 MHz, C3D6O ): δ 196.7, 166.6, 164.0, 163.2, 147.9, 146.7, 142.8, 136.0, 131.7, 128.8, 128.3, 128.1, 124.2, 117.9, 113.5, 113.4, 103.1, 95.3, 94.4, 79.0, 61.9, 55.4, 53.4, 42.6。
化合物6b:产率68%,m.p.167~169℃。1HNMR(300 MHz, C3D6O):δ 2.79 (1H, dd, J=3.3, 17.4Hz, 3-H), 3.20 (1H, dd, J=12.6,17.4Hz, 3-H), 3.87(1H, s, OCH3), 5.25 (2H, s, CH2), 5.47 (1H, dd, J=3.0, 12.6Hz, 2-H), 5.68 (2H, s,CH2), 6.15(1H, d, J=2.4Hz, 6-H), 6.18(1H, d, J=2.4Hz, 8-H), 6.99 (2H, s, 2’,5’-H), 7.06 (1H, s, 6’-H), 7.42 (4H, s, Ar-H), 7.93 (1H, s, 3-OH), 8.18 (1H, s, CH), 12.14 (1H, s, 5-OH).13C NMR (75 MHz, C3D6O ):δ 196.7, 166.6, 164.0, 163.2, 147.9, 146.7 , 142.9 , 134.9, 133.7, 131.7, 128.9, 124.3, 117.9, 113.5, 111.4 103.0, 95.3, 94.4, 79.0, 61.9, 55.4, 52.6, 42.6。
化合物6c:产率70%,m.p.153~155℃。1HNMR(300 MHz, C3D6O):δ 1.83 (s, 3H, CH3), 2.77 (1H, dd, J = 2.7, 17.1 Hz, 3-H), 3.22 (1H, dd, J =12.6, 17.1 Hz, 3-H), 3.86 (3H, s, OCH3), 5.09 (2H, s, NCH2), 5.30 (2H, s, OCH2), 5.48 (1H, dd, J = 2.5, 12.3 Hz, 2-H), 6.27 (1H,d, J = 2.4Hz, 6-H ), 6.36 (1H, d, J = 2.4 Hz, 8-H), 6.93~6.84 (3H, m, Ar-H), 7.45~7.36 (4H, m, Ar-H), 7.71 (1H, s,CH), 9.09 (1H, s, OH), 12.21 (1H, s, OH);13C NMR (CDCl3, 75 MHz): δ 196.8, 166.6, 164.1, 162.9, 145.0, 142.9, 134.9, 133.1, 130.6, 129.8, 129.8,129.4, 126.5, 126.5, 124.7, 123.5, 119.0, 111.5, 106.2, 98.7, 94.2, 66.7, 65.1, 55.9 , 22.7。
化合物6d:产率73%,m.p.152~154℃。1HNMR(300 MHz, C3D6O): δ1.26 (1H, t, J=7.2, CH3), 2.79 (1H, dd, J=3.0, 17.4,3-H), 3.18 (1H, dd, J=12.6,17.1, 3-H), 3.86 (1H, s, OCH3), 4.23 (1H, q, J=7.2, OCH2), 5.28 (2H, s, CH2), 5.34 (2H, s,CH2), 5.46 (1H, dd, J1=3.0,12.6, 2-H), 6.18 (1H, d, J=2.4, 6-H), 6.20 (1H, d, J=2.4,8-H), 6.97(1H, s, 5’-H), 6.98(1H,s,2’-H), 7.07(1H, s, 6’-H), 7.92 (1H, s, 3’-OH), 8.19 (1H, s, CH), 12.1(1H, s, 5-OH);13C NMR (75 MHz,C3D6O):δ 196.8, 166.9, 166.6, 164.0, 163.2, 147.9, 146.7, 142.6, 131.7, 125.7,118.0, 113.5, 111.4, 103.1, 95.4, 94.4, 79.0, 61.7, 55.4,50.5, 42.6, 13.5。
2 结果与讨论
黄酮类化合物是一类天然多酚活性物质,具有广泛的抗氧化、抗肿瘤等作用。白杨素属于黄酮,C2和C3之间为双键;橙皮素属于二氢黄酮,C2和C3之间为单键。选择不同结构的黄酮引入1,2,3-三氮唑活性基团对探讨底物结构与活性之间的构效关系具有重要意义。实验中利用黄酮7-位酚羟基酸性强的特点,在无水碳酸钾作用下与溴丙炔醚化反应引入炔,然后分别与苄基叠氮化物或乙酸乙酯叠氮化物通过click[3+2]环化反应合成了8个含1,2,3-三氮唑结构的衍生物。
化合物2为白杨素7位酚羟基引入丙炔基后产物,1H NMR δ 2.59 (1H, s)处出现了C≡CH的端炔氢的吸收峰;4.94 (2H, s)处出现了-OCH2吸收峰;在13C NMR δ 79.5和78.8出现了代表-C≡C的两个碳原子吸收峰。化合物3a在1H NMR δ 5.25为NCH2的吸收峰;5.56处有-OCH2的吸收峰;δ7.60为三氮唑中双键氢吸收峰;13C NMR 中C≡CH的碳信号消失,δ 54.34出现N-CH2的吸收峰,低场区增加8个不饱和碳原子信号,证实了3a中已形成苄基取代三氮唑结构。化合物3b、3c均能用类似方法得以确定结构。化合物3d1H NMR δ 1.21(3H, t, J=7.2Hz)、4.19 (2H, q, J=7.2Hz)为典型的OCH2CH3结构,13C NMR δ 167.7、 50.9、14.5分别为酯基中C=O及OCH2CH3吸收峰。
橙皮素中羰基碳原子吸收峰在 δ 196.6,白杨素中羰基碳原子吸收峰在 δ 182.5,这与C2和C3之间是否存在双键有关。橙皮素取代炔丙基形成的化合物5及与叠氮化物环化后的化合物6a~6d的确定方法与3a~3d类似。
合成中对比了反应温度对产率的影响,发现低温50℃搅拌8h也有产物生成,产率40%~65%;提高温度对产率有积极的促进作用。Click环化反应使用抗坏血酸钠及五水硫酸铜催化反应,以68%~82%产率得到含三氮唑的黄酮衍生物。该反应条件要求低、操作简易、产物结构单一、原子转化率高,为环境友好型的构建1,2,3-三氮唑杂环的便捷合成方法。所合成的三氮唑黄酮衍生物的抗肿瘤活性有待更深一步的测试。

