微卫星不稳定性与结直肠癌免疫微环境关系的研究
张 周,伍小琼,邱荣元,杨泽若,李熙微,毛杨明,余飞跃
(1.湖南师范大学附属岳阳医院,岳阳 414000;2.北京大学前沿交叉研究院定量生物学中心,北京 100871)
结直肠癌(colorectal cancer,CRC)是最常见的恶性肿瘤之一,全球发病率和死亡率在所有癌症中位居第三位[1]。肿瘤的发生、发展受肿瘤细胞遗传性状、炎症指标和免疫微环境影响[2],CRC 中主要存在三种遗传不稳定性,包括染色体不稳定性、CPG 岛甲基化及微卫星不稳定性(microsatellite instability,MSI)[3]。近年来的研究表明,MSI 状态作为肿瘤遗传不稳定的敏感指标,其检测对于肿瘤的早期诊断、预后判断、化疗敏感性判断以及高危人群的判定等具有重要意义。然而,MSI 状态与CRC 临床病理特征、免疫微环境及预后的系统性分析尚未见报道。本研究系统性地分析了MSI 状态与CRC 临床病理特征、免疫微环境及预后的关系,试图推测MSI 检测可以为评估CRC 患者的预后以及制定个体化临床治疗方案提供一定参考。
1 资料与方法
1.1 临床资料 收集2019 年12 月~2021 年8 月在湖南师范大学附属岳阳医院以及湖南省人民医院行CRC手术患者的临床资料,共计316 例。纳入标准:①首次进行CRC 手术,且术后病理确诊为结直肠癌;②术后病理皆通过免疫组织化学法获取MMR 蛋白相关信息。排除标准:①既往有肿瘤病史;②合并其他恶性肿瘤;③手术前接受过新辅助放、化疗;④临床资料缺失。
1.2 免疫组化检测 研究4 种MMR 蛋白的表达,包括MHL1、MSH2、MSH6 和PMS2。阴性蛋白表达被定义为在存在阳性标记的内部非肿瘤细胞的情况下,肿瘤细胞内完全没有核染色。局部染色定义为<5% 的肿瘤细胞中存在染色。对任何MMR 蛋白显示阴性染色的CRC 被解释为错配蛋白缺失(defective mismatch repair,dMMR),对于4 个MMR 蛋白均阳性表达的CRC 被称为MMR 功能完整(proficient mismatch repair,pMMR)。dMMR 提示高频微卫星不稳定性(microsatellite instability high,MSI-H),pMMR 提示低频微卫星不稳定性(microsatellite stability low,MSI-L)或微卫星稳定(microsatellite stability,MSS)。
1.3 数据库材料与方法 GEO 数据库结直肠癌MSI 数据的分组标准 使用R 语言GEOquery 包(Version 2.52.0)从基因表达综合数据库(Gene Expression Omnibus,GEO)(https://www.ncbi.nlm.nih.gov/geo/)下载数据集GSE24551,该数据集包括147 例结直肠癌患者的转录组表达谱、临床病理资料以及MSI 检测结果。通过荧光PCR 和毛细管电泳的方法对微卫星位点进行扩增,比对正常组织与癌症组织中每个位点片段大小的变化来确定微卫星不稳定性,所有阳性结果均进一步采用PCR 法重复检测确认。依据以下标准对结直肠癌微卫星状态进行分组:无微卫星位点变异为MSS;至少有一个微卫星位点变异并且<30%微卫星位点变异为MSI-L;>30%微卫星位点变异或者BAT25 与BAT26 位点均变异则为MSI-H。依据上述标准将 GEO 数据库下载的结直肠癌病例分为MSS/MSI-L 与MSI-H 两组,对结直肠癌患者临床病理资料、预后以及转录组表达/免疫浸润差异进行生物信息学分析。
生存分析 运用survival 包(version 2.441-1.1)以及survminer(version 0.4.6)对GSE24551 数据集进行生存分析,采用Kaplan-Meier 法以及Log-Rank 检验生存曲线是否存在差异。P 值<0.05 差异有统计学意义。
芯片数据预处理与差异分析 运用R 语言limma 包(version 3.40.6)对芯片数据进行预处理。当多个探针对应到一个基因名时,取多个探针的表达中间值合并数据。利用limma 包进行差异分析,绝对值logFC>1 且P 校正值<0.05 为差异基因筛选阈值,并通过威尔科克森符号秩检验(Wilcoxon-Vorzeichen-Rang-Test,wilcox test)计算基因在两组之间的表达差异,P 值<0.05 差异有统计学意义。
免疫细胞肿瘤浸润丰度分析 运用CIBERSOFT.R(2015)的反卷积算法对芯片表达谱数据进行去卷积,估计各种免疫细胞的浸润丰度,并通过wilcox test 计算免疫细胞浸润丰度在两组之间的表达差异,P 值<0.05 差异有统计学意义。
1.4 统计学方法 用SPSS 23.0 软件进行统计学分析,计数资料以例数或百分比表示,组间比较采用卡方检验或Fisher 精确检验,P<0.05 差异有统计学意义。
2 结果
2.1 结直肠癌组织MSI 与临床病理特征的相关性在316 例结直肠癌样本的免疫组化结果显示,MSI-H组与MSS/MSI-L 组CRC 病人在年龄、性别、大体分型、分化程度、T 分期、N 分期、M 分期、TNM 分期、癌胚抗原(carcinoembryonic antigen,CEA)与糖类抗原199(carbohydrate antigen199,CA199)表达上的差异均不具有统计学意义。MSI-H 组在右半结肠癌、肿瘤直径≥5cm、含有黏液方面所占比例显著高于MSS/MSI-L 组,结果见表1。
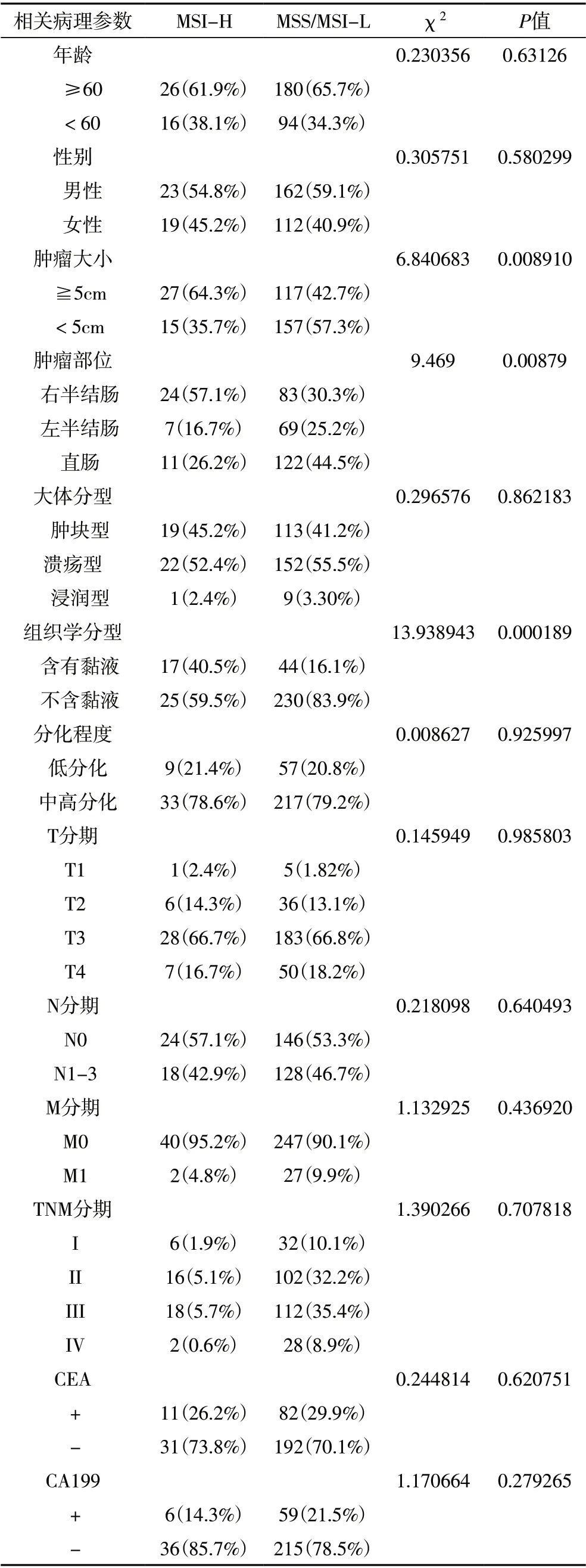
表1 316例结直肠癌患者MSI与临床病理特征的关系
2.2 MSI 与预后关系 对GEO 数据库中获取的147例结直肠癌的MSI 状态进行Kaplan-Meier 分析,结果显示MSS/MSI-L 组结直肠癌患者无病生存期(disease free survival,DFS)中位数为3.535 年,MSI-H 组结直肠癌患者无病生存期中位数为4.47 年,MSI-H 组别DFS较MSS/MSI-L 组别显著延长,其差异具有统计学意义(LogRank 法 χ2=6.6,P= 0.01)(图1)。

图1 MSI状态与CRC患者预后的生存曲线(数据来源于GEO)
2.3 MSI 状态与结直肠癌组织中免疫检查点表达量的关系 对GEO 数据的MSI 状态与免疫检查点CD274 即程序性死亡配体1(programmed death ligand 1,PD-L1)的转录组芯片表达量进行分析,结果表明,CD274 表达量在MSI-H 组显著上调,其差异具有统计学意义(P=2.8E-05)(图2)。
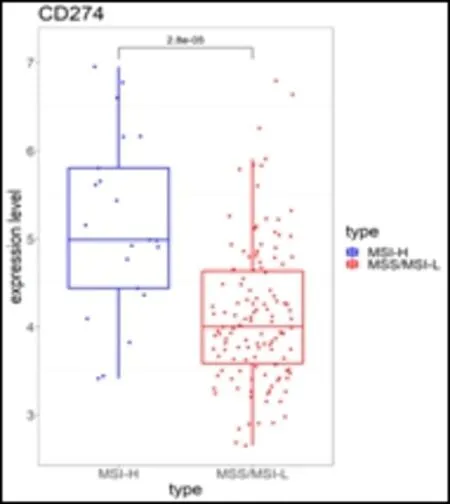
图2 MSI状态与CRC患者的CD274表达(数据来源于GEO)
2.4 MSI 状态与结直肠癌组织中免疫浸润淋巴细胞相关分析 采用cibersoft 提供的LM22 矩阵(22 种免疫细胞的参考标志物基因表达矩阵),对GEO 数据进行免疫浸润分析。结果表明,共有5 种免疫细胞的估计值在MSS/MSI-L 组以及MSI-H 组之间有统计学差异,以中位数丰度大小从高到低的排序分别是巨噬细胞M0型(macrophage M0),浆细胞(plasma cells),辅助T 细胞(t cells regulatory),巨噬细胞M1 型(macrophage M1)以及中性粒细胞(neutrophils),P<0.05。其中巨噬细胞M0 型,浆细胞以及辅助T 细胞在MSS/MSI-L 组中显著上调,巨噬细胞M1 型以及中性粒细胞在MSI-H 组中显著上调,其他免疫细胞类型的差异均无统计学差异(P>0 .05),结果见图3。
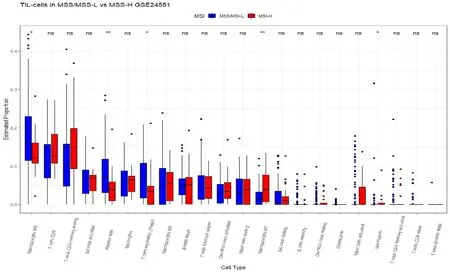
图3 CRC患者MSI-H 组和 MSS/MSI-L 组之间免疫细胞的比较(数据来源于GEO)
3 讨论
1980 年wyman 等首次提出在人类基因组中的短串联连重复序列即微卫星(microsatellite,MS),由于其重复结构,在复制过程中特别容易出现复制错误,由MMR负责错误修配。当dMMR 时,MS 出现复制错误得不到纠正并重复积累,使得MS 序列长度或碱基组发生不稳定,称为MSI。MSI 在一定程度上参与了肿瘤的发生发展,这可能是CRC 具有高度异质性的原因。即使病理特征相似,CRC 的治疗反应与预后也存在显著的个体化差异。有研究发现MSI 可能与CRC 有着独特的生物学联系[4],阐明其关系可能有助于CRC 患者的个性化治疗。
本研究中,MSI-H 型CRC 较MSS/MSI-L 型相比,其肿瘤具有多位于右半结肠、直径大于5cm、其组织表达黏液的特征。一项基于1394 例CRC 患者病理标本的研究提示MSI 与年龄、肿瘤大小、部位、黏液表达、分化程度、TNM 分期有关[5]。本研究与上述研究大致相符,但在年龄、分化程度和TNM 分期未能显示出统计学差异,这可能与本研究收集样本较少、存在抽样误差或检测方法存在差异(PCR 法和IHC 法)有关。MSI-H与MSS/MSI-L 结直肠癌具有不同的病理特征,提示两者发生、发展机制不同,因此本研究推测两者在预后及免疫微环境可能存在一定差异。
进一步研究表明MSI-H 组个体无病生存期较MSS/MSI-L 组显著延长,提示MSI-H 型CRC 患者预后更好。因此MSI 状态对于CRC 预后判断具有重要价值。Hou 等人研究同样发现,与MSS/MSI-L 的CRC 患者相比,MSI-H 的CRC 患者的DFS 更长[6-7],这可能是由于MSI-H 型患者免疫原性诱导机体抗肿瘤免疫反应增强所致[8]。但也有研究表明在IV 期CRC 患者中,MSI-H 型患者DFS 反而短于MSS/MSI-L 型患者[9],这可能是由于在肿瘤晚期,机体为平衡高TH1/CTL 微环境,MSI-H 型上调众多免疫检查点使得肿瘤逃避免疫攻击[10]。
肿瘤的发生除了涉及本身遗传学改变外,免疫微环境发挥着重要作用。免疫微环境主要由肿瘤浸润淋巴细胞(tumor infiltrating lymphocytes,TIL)及相关细胞因子、免疫检查点蛋白组成。免疫检查点主要包括了细胞毒性T 淋巴细胞相关蛋白(cytotoxic T lymphocyte associated antigen-4,CTLA-4)、程序性细胞死亡受体(programmed cell death-1,PD-1)和PD-L1,其中PD-1/PD-L1 通路是近几年肿瘤免疫治疗研究热点。
本研究发现MSI-H 组PD-L1 的基因水平表达明显高于MSS/MSI-L 组。由于dMMR 通过插入、缺失、编码区的碱基错配导致了编码区的点突变,因此MSI-H 的结直肠肿瘤的高突变负荷可导致产生肿瘤特异性抗原,这些抗原通常是MSS 结肠癌的10-50 倍[11],其免疫原性诱导机体抗肿瘤免疫反应增强。通过对免疫检查点的分析可以解释根据组织病理学标准判断的明显具有强免疫原性的肿瘤不被宿主排斥的原因。在MMR 系统存在缺陷时,CRC 免疫微环境会选择性上调某些免疫检查位点,其中包括了PD-L1。PD-L1 可以通过结合激活T 细胞表面的PD-1,抑制T 细胞的增值和活化,诱导其凋亡,进一步使得肿瘤细胞逃脱免疫监视[12]。如果阻断PD-1/PD-L1 的相互作用,肿瘤细胞对于T 细胞的抑制作用可以被消除,最终实现肿瘤T 细胞的浸润,免疫系统抗肿瘤作用增强。上诉机制可能是MSI-H 型结直肠患者更容易在免疫抑制剂治疗中受益的重要原因之一,据此推测MSI 状态有望成为PD-L1/PD-1 通路免疫治疗的预测标记。
目前,免疫检查点抑制剂在多个肿瘤治疗领域取得了突破性进展,但仍只有一部分患者能从治疗中获益。结合TIL 了解免疫微环境,从而指导个体免疫治疗,已经成为免疫治疗新的发展方向。当前关于CRC 和免疫微环境的研究较少,本研究结果表明,MSS/MSI-L 组以及MSI-H 组之间免疫浸润有差异,且差异具有统计学意义。Teng MW 定义了免疫治疗中获得性耐受机制,根据TIL 和PD-L1 表达的存在或缺失分为四种类型(TIL+/PD-L1+,TIL-/PD-L1-,TIL+/PD-L1-,TIL-/PD-L1+),其中TIL+/PD-L1+的肿瘤更容易从PD-1/PD-L1 免疫治疗中获益[13]。刘涛生等人的研究表明,MSI-H 和MSS/MSI-L 组之间的TIL/PDL1 状态存在差异,其中MSI-H 型CRC 更有可能呈现TIL+/PD-L1+肿瘤微环境[14]。另有研究表明,并不是所有MSI-H 型CRC 对于PD-L1/PD-1 通路免疫抑制剂都敏感[15]。可见,由于免疫微环境是一个复杂系统,涉及多种免疫细胞基因子和多个免疫检查点,MSI 与免疫微环境的关系尚需更多研究论证。
综上所述,本研究发现MSI-H 型CRC 具有特殊的病理特征。通过研究DFS 指标,结果表明MSI-H 组CRC 预后更好。分析了MSI-H 组免疫检查点PD-L1表达和免疫浸润模式,与MSS/MSI-L 组相比,MSI-H 组具有更高的PD-L1 表达及差异性的免疫细胞肿瘤浸润丰度。不同MSI 状态下,CRC 免疫微环境有差异,对于CRC 患者进行MSI 筛查,有助于个性化临床治疗方案的制定。
本研究存在一些局限性。首先,本研究为解决临床样本量不足的问题,采取了多中心回顾性样本收集研究,导致患者的临床数据结果判读上可能存在系统性差异。其次,公共数据库中数据量较小,其免疫微环境中TIL 也暂无评分标准,因此本研究未能对不同微卫星状态下PD-L1/TIL 进行分型,无法深入了解MSI 与免疫微环境情况。这也是未来进一步的研究方向。

