长孢藻的生理生态特征及监测研究进展
徐杜敏,余 丽,*,张 民,杨厚云,李卫华,王 嵘,苑惠丽,强俊杰
(1.安徽建筑大学环境与能源工程学院,安徽合肥 230601;2.环境污染控制与废弃物资源化利用安徽省重点实验室,安徽合肥 230601;3.中国科学院南京地理与湖泊研究所,湖泊与环境国家重点实验室,江苏南京 210008;4.金陵科技学院建筑工程学院,江苏南京 211169)
随着人类生产生活的不断加快,水体富营养化现象日益严重,导致越来越多的湖泊、水库发生蓝藻水华[1]。蓝藻水华不仅导致水生态系统和水体功能受到影响和破坏,而且产生的藻毒素直接危害着人类健康和社会经济可持续发展[2]。常见的蓝藻水华类型主要有微囊藻(Microcystis)、长孢藻(Dolichospermum)、束丝藻(Aphanizomenon)、拟柱胞藻(Cylindrospermopsis)等[3]。其中,微囊藻水华的研究关注度最高,全球暴发的蓝藻水华85%以上都是以微囊藻为优势种[4]。然而,随着研究不断深入,再加上其他蓝藻的不断扩张,长孢藻优势逐渐增加,成为继微囊藻之后暴发最为广泛的蓝藻水华,因其毒性、暴发性而日益受到关注[3-5]。长孢藻的丝体形状和细胞形态具有多样性,能够形成水华的种类繁多,还能产生多种类型的藻毒素。此外长孢藻对氮、磷营养盐的利用效率高,对水温和光照强度的适应性强,在富营养化的湖泊和水库中可快速繁殖生长,频繁形成水华[5-6]。
长孢藻可以产生多种藻毒素,特别是鱼腥藻毒素-a(anatoxin-a,ATX-a)和鱼腥藻毒素-a(s)[anatoxin-a(s),ATX-a(s)],已有多起报道证实其会对水生动植物产生不利影响[7-9],是多起家畜和野生动物中毒事件的元凶[10-11],若不慎接触或通过饮用污染水等途径摄入均可能导致中毒。随着全球气候变暖和水体富营养化的加剧,长孢藻已经基本遍布全球,从最北部的芬兰到南部的新西兰,包括了北温带以及亚热带、热带和南温带区域,全球诸多地区的淡水饮用水水源地都检测到长孢藻的存在[7,12]。
长孢藻在淡水水体中的不断扩张,将给人类的用水安全带来更大挑战。虽然目前对长孢藻的生理特性有了一定的研究,但仍较为浅显,而且关于长孢藻的产毒特性、危害及其影响因素等研究也相对匮乏。鉴于长孢藻的危害性,加强产毒长孢藻的监测,对保障水生态安全具有十分重要的意义。本文通过对长孢藻的全球分布、长孢藻的生理生态特征、监测等方面进行概述,并对相关领域进行了展望,为长孢藻水华暴发机理和有效控制的研究提供理论参考。
1 长孢藻的分类
长孢藻属是在2009年Wacklin等[13]依据分子手段将浮游性的鱼腥藻属种类从原来的鱼腥藻属分离出来成立的一个新属,具有气囊,可调节细胞浮力,营浮游生活,被认为是除微囊藻外最易发生蓝藻水华的类群。Wacklin等[13]命名长孢藻属时,指出长孢藻属和鱼腥藻属区别的主要形态学依据就是藻丝细胞是否含有气囊,而藻丝长度、异形胞和厚壁孢子的形态是鉴定长孢藻属下不同种类的主要形态学特征[14]。长孢藻属中的一些常见的藻种有螺旋长孢藻、水华长孢藻和卷曲长孢藻等,在富营养化的湖泊、水库中往往可以形成水华(图1)。

图1 常见长孢藻Fig.1 Common Dolichospermum
2 长孢藻的全球分布
长孢藻水华在全球范围内普有发生,欧洲、美洲、南非、亚洲、澳洲都有相关报道[5]。20世纪初开始,美国伊利湖的富营养化程度日趋加重,浮游藻类的数量也不断增加,长孢藻的生物量仅次于微囊藻[15];同样在20世纪80年代,日本的琵琶湖也出现了长孢藻水华[16];在芬兰、加拿大、澳大利亚等淡水湖中都发现了长孢藻的存在。国内云南、安徽、江苏、等地淡水湖泊中共计发现50多种长孢藻[17]。长孢藻在云南滇池的初春季节、洱海的夏季[18]、安徽巢湖的春秋两季[19]、江苏太湖的初春季节[20]成为优势种群并形成水华。诸多报道证明长孢藻除南极洲以外的几大洲均有分布(表1)。
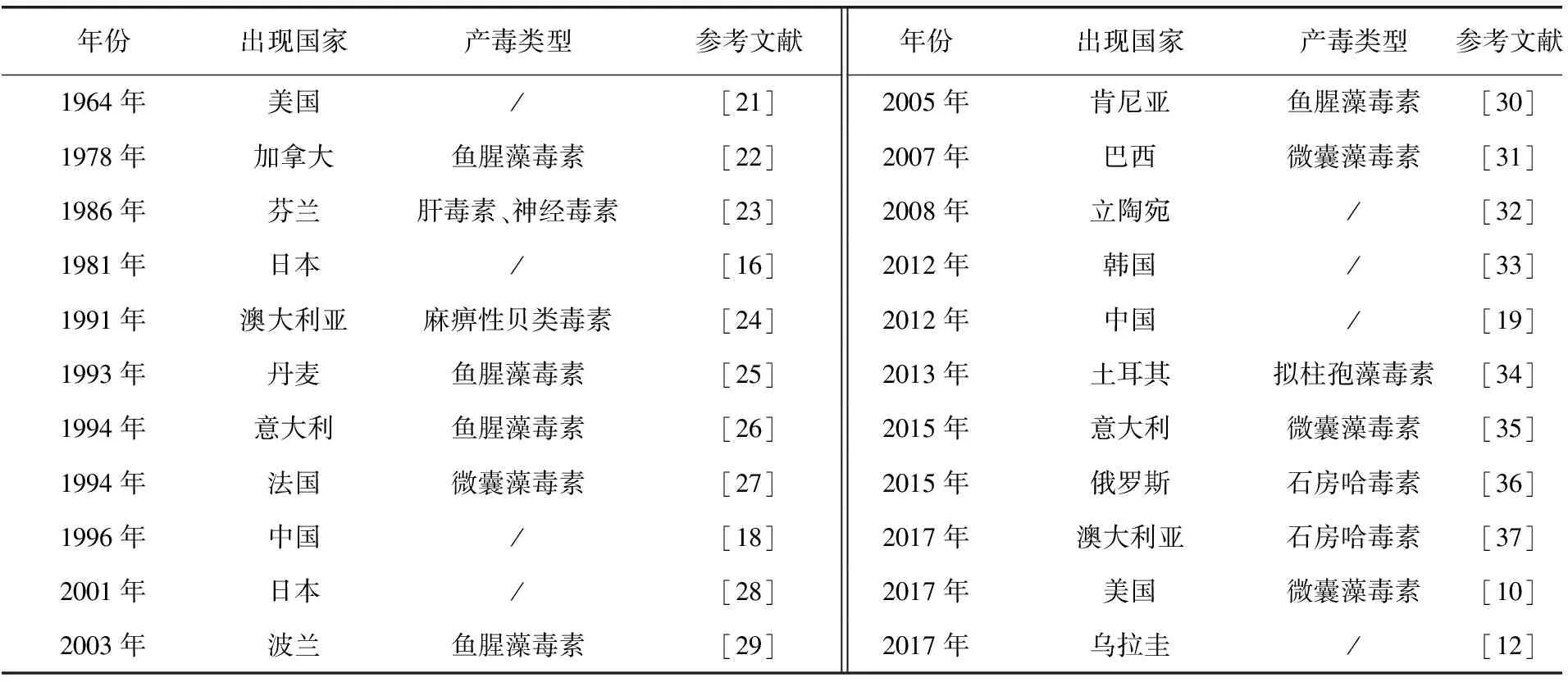
表1 长孢藻出现地区及产毒类型Tab.1 Occurrence Area of Dolichospermum and Type of Toxin Production
早期研究者认为产毒长孢藻只分布在加拿大和欧洲北纬地区[10],但随着时间的推移发现产毒长孢藻也基本遍布全球,如表1所示,截至2020年,产毒的长孢藻还出现在美国、俄罗斯、澳大利亚、巴西、中国等地。研究者认为水体富营养化和全球气候变暖是造成长孢藻水华频繁暴发的重要原因[7],当然这与长孢藻本身对氮、磷营养盐高效的利用率、人类的活动以及鸟类等动物的传播也有关系。
3 长孢藻的生理生态特征
3.1 形态特征
长孢藻呈细丝状,多数是直的,也有呈卷曲状,其藻丝及细胞形态具有较高的多样性。藻丝单一,或群集成群体;自由漂浮,或黏附基质上。整条藻丝粗细一致,或两端稍变细,有的藻丝外面有透明、无色的水样胶鞘。长孢藻藻丝长度一般在15~2 400 μm,主要由2种形状不同的细胞组成,一连串形状较小的细胞称之为营养细胞,而形态较大的细胞称为异形细胞[7,38]。营养细胞能进行类似于高等植物的光合作用,其原生质体均匀或有颗粒,有的充满许多伪空胞,而异形细胞常位于藻丝的中间和末端,呈球形、椭圆形、圆柱形,能进行固氮作用,在水体中缺乏无机氮源时,藻丝中的一些营养细胞会转化为异形胞,固定大气中的氮气,为其生长繁殖提供了保证[39-41];厚壁孢子或仅生在异形胞的一侧或两侧,或仅在远离异形胞处发生,单一或数个相接成串,常大于营养细胞,一般为圆球形或两端变圆的圆柱形,每条藻丝亦呈念珠状。Guan等[42]发现长孢藻可以改变细胞的形态和群体大小来适应环境,在巢湖的秋末冬初时期,长孢藻是以最大的细胞直径,来获得生存优势,其群体的大小和藻细胞的直径呈显著负相关关系。长孢藻在自然水体中常聚集形成群体,以便获得更大的生存优势,室内培养的长孢藻都是呈单体的状态,无法聚集成群体。
3.2 繁殖特征
长孢藻适应性强,是淡水蓝藻水华中除微囊藻之外的又一类常见优势种群,其广泛分布在我国湖泊、河流、水库等淡水水体[17-18,38]。随着全球气候变暖,长孢藻的生长范围逐渐扩大,可在温带和亚热带水体中成为优势种[7]。长孢藻属喜温生物,经常出现在夏季,但因其温度适应性广,故在其他季节长孢藻也可大量生长繁殖形成水华。长孢藻的异形胞可以固氮,当氮源不足时可固定氮来满足自身生长的需求,同时伪空胞还可以提供自主沉浮的条件,所以长孢藻在营养竞争和光合同化作用中处于优势地位[13,37],如果此时磷源充足,长孢藻就极可能暴发水华。长孢藻水华暴发会产生一系列的水质问题,如水体散发异味、藻毒素含量增高、水体溶解氧下降等,对水生生物以及人类健康构成威胁。
3.3 产毒和产嗅特征
长孢藻能够产ATX-a、ATX-a(s)、微囊藻毒素(microcystin,MC)和麻痹性贝类毒素(paralytic shellfish poisons,PSPs)等多种毒素。其中,最主要的是ATX-a,20世纪60年代初,最先从水华鱼腥藻NRC-44中分离出ATX-a,分子式是C10H15NO,相对分子质量为165[43]。ATX-a是一类具有神经毒性的小分子二环结构的二级胺生物碱,其作为神经递质乙酰胆碱的结构类似物,可作用于神经细胞突触后膜与乙酰胆碱受体结合,从而持续地传导神经冲动,造成肌肉神经细胞过度兴奋而死亡,它不仅会引起动物中毒死亡,还能引起植物细胞的氧化胁迫反应[43]。ATX-a(s)是一种神经毒素,结构和ATX-a不同,是环状氮羟基鸟嘌呤的磷酸酯,分子质量约为252;PSPs包括石房蛤毒素(saxitoxin,STX)、新石房蛤毒素(neosaxitoxin,neoSTX)、漆沟藻毒素(gonyauotoxin,GTX),它们是一类氨基甲酸生物碱类神经毒素,也是四氢嘌呤衍生物。其中,STX是三环嘌呤衍生物,分子质量约为299,是毒性最强的藻毒素;MC是一种肝毒素,由非核糖体多肽合成酶及其相关的修剪酶组成的环七肽,现共计报道了100多种同系物[7]。不同的长孢藻株产藻毒素类型有明显差异,有的仅产生ATX-a,有的可同时产生多种毒素,另外不同藻株产毒能力也有所不同,主要是依赖长孢藻是否有相关的产毒基因,以及该基因能否充分表达。目前,长孢藻具体的产毒生物学机制尚未完全阐明,长孢藻之所以产生藻毒素,有以下几种可能:(1)抵御其他生物的捕食;(2)诱导种群结构的变化获得生态优势;(3)为化感作用提供信号传递的物质[44-47]。长孢藻产生毒素的种类似乎和地区有一定的关系[48],由表1中全球长孢藻的分布和产毒类型可知,长孢藻的“产毒型”存在地理分布的特点,这种“产毒型”地理分布可能是环境适应的结果,但这种推断还需要大量的研究。
长孢藻能够产生多种异味物质,主要有土臭素(geosmin)、2-甲基异莰醇(2-MIB)等[7],土臭素和2-MIB不易被分解处理,少量的土臭素和2-MIB就可导致水体发臭,处理含有土臭素和2-MIB的饮用水给社会带来巨大的经济负担[49]。Wang等[50]认为土臭素和2-MIB的浓度与温度、光强均不相关,叶绿素a的前体合成物焦磷酸香叶酯(geranyl pyrophosphate)和焦磷酸法呢酯(farnesyl pyrophosphate)也是土臭素和2-MIB的合成物,在不适合长孢藻生长的温度和光照强度环境下,藻内的叶绿素a浓度降低,土臭素和2-MIB有所升高。在营养盐方面,低氮磷比促进了长孢藻的生长和土臭素的产生,然而高氮磷比会促进长孢藻的生长,抑制土臭素的产生[51]。此外,土臭素和2-MIB也具有毒性,可以提高长孢藻生存的竞争力。
3.4 生长和产毒影响因素
3.4.1 温度
不同水体中长孢藻有较宽的温度波动,有着不尽相同的水华暴发温度[7]。长孢藻在14~23 ℃萌发复苏率最高[52],室内试验中长孢藻最适的生长温度在25 ℃左右,在10 ℃下依然能保持增长,在35 ℃高温的水中仍能保持活性,在高温和低温培养下比较,长孢藻更适合低温环境中生长[53]。管乐等[6]发现长孢藻在低温或者高温的条件下细胞直径相对较大,藻丝长度较短,这可能是长孢藻应对极端温度自我保护的方式。长孢藻较强的温度适应性,是其在各个季节生存繁殖的基础,也是广泛分布于温带和亚热带地区的保障。此外温度对长孢藻产生ATX-a也存在影响,在20世纪末期Rapala等[54-55]做了长孢藻产ATX-a的试验,产毒长孢藻在略低于最适生长温度下更有利于ATX-a的合成,同时它们比不产毒长孢藻更能耐受高温。
3.4.2 光照强度
长孢藻不但在黑暗环境下不能萌发,而且在低光强情况下还会抑制其生长[52],但其可以通过伪空胞调节在水中垂直方向的位置,以获得适合自己生长繁殖的光照强度,提升生存竞争力成为优势种群[7]。同样长孢藻由于种类的不同,最适光照强度也不同,Zapomělov等[56]研究8种长孢藻的最适生长光照强度,结果显示长孢藻最适光照强度在990~4 400 lx。另有研究发现长孢藻在不同的光照强度下藻丝长度和细胞比重不同,在100 lx下长孢藻细胞的生物量增长缓慢,但有利于藻丝长度的增长;在3 000 lx和5 000 lx情况下抑制了长孢藻生物量和藻丝的增长速度[57]。此外,产毒长孢藻比不产毒长孢藻需要更高的光照强度才能达到生长饱和;在弱光的条件下,产毒长孢藻的生长速率又高于不产毒长孢藻[58];Rapala等[54-55]发现长孢藻最适产毒光强略低于最适生长光强。
3.4.3 营养盐
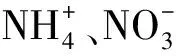
长孢藻在磷浓度较高时,将磷以多聚磷酸盐的形势储存在细胞内[59],在藻细胞含磷最高期,将长孢藻放置无磷的培养基中仍可生长12~13 d,但其在缺磷的环境中只能使用自己储备的磷元素,无法从外界获得磷元素[61]。研究发现长孢藻生长受磷源的限制,在巢湖微囊藻和长孢藻相互演替过程中,当磷浓度较低情况下长孢藻无法正常生长,从而促进微囊藻生长继而成为优势种群[62]。但Rapala等[54]在不同磷浓度的条件下培养产毒长孢藻,发现磷浓度的高低并没有影响长孢藻的产毒能力。长孢藻的储磷能力可以缓解磷源危机,当磷源再次回到合适的水平时,长孢藻可快速生长繁殖。
近年来,氮、磷营养盐对长孢藻生长影响的研究表明,氮、磷对长孢藻生长不但是同时影响的,而且它们的代谢是相互依赖的,比如磷可通过异形胞形成过程中的能量供应,以影响长孢藻的固氮速率,而氮的有效性可以通过合成磷转运蛋白和胞外磷酸酶,以帮助长孢藻克服磷限制[59,61],这种代谢关系可以充分利用营养盐,极大提高了对氮、磷的利用率。但目前氮、磷浓度对长孢藻产毒影响机理的研究仍十分不足,还需进一步的探究。
3.4.4 盐度
长孢藻适合在低盐度的水体中生长,特别是适合在淡水中生长,但在一些海湾中也发现了长孢藻。水体盐浓度较高会被抑制长孢藻的生长,随着盐度的增加藻内光合色素的含量减少,高盐度会导致藻细胞缺磷直至死亡[63]。Engstroem-Oest等[64]在波罗的海发现低盐度的海湾长孢藻的生物量和产毒量都比高盐度的海湾高。
3.4.5 pH
长孢藻适合生长在偏碱性(pH值为7~9)的水体中[65],陈家长等[66]把长孢藻分别培养在pH值为6、7、8、9的培养液中,发现长孢藻的生物量与pH成正比,在弱碱性条件下长孢藻固氮速率更快,细胞光合效率更高[67]。将长孢藻置于pH值为5.5、6.0、6.5的培养液中培养,发现藻细胞的沉降速率明显加快,酸性环境会抑制长孢藻的生长[68]。
表2为长孢藻在不同环境中生长和产毒产嗅的情况。

表2 长孢藻在不同环境中生长和产毒产嗅的情况Tab.2 Dolichospermum Growth and Production of Toxins and Odors under Different Environment
4 长孢藻的监测
鉴于长孢藻的高频发生和危害性,加强对湖泊、水库中长孢藻及藻毒素的监测工作已迫在眉睫。藻类监测最直接的方法是通过显微镜观察是否有长孢藻,但无法判断该藻是否产毒,最原始的鉴定方式是通过动物生物模型来区分,但这种方法速度慢、准确度低,且存在伦理问题。目前,藻类的监测方法有显微镜观察法、生物化学法、化学分析法和分子生物学法(表3)。

表3 监测方法的特点Tab.3 Characteristics of Monitoring Methods
4.1 显微镜观察法
显微镜观察藻类是科研工作者常用的方法,在10×40倍不仅可以观察藻细胞的形态来鉴定藻种,还可以对藻细胞计数,计算蓝藻的丰度。使用细胞计数法计数藻细胞丰度,将藻液摇匀,取0.1 mL的藻液置于计数框内,盖住盖玻片,观测10个及以上视野,计算藻细胞的平均值;也可采用血球计数板法,将藻液滴入血球计数板的凹槽内,待藻液浸入计数区,方可进行计数,计数完成后再用血球计数板的计算公式计算藻细胞的数量[69]。长孢藻是由若干个球形细胞组成的丝状藻体,对长孢藻等丝状藻体的计数,一般可通过准确地识别细胞间隔来确定视野中的藻体的数量,这对计数人员的要求较高,难度较大;另一种方法可通过藻体的长度计数,一般常用20 μm计为一个藻体,但长孢藻大多呈卷曲状,通过藻体长度确定数量,操作难度也较高[70]。受人力的限制,此方法不适用于日常大面积水域的长孢藻监测工作。
4.2 物化学法
显微镜观察法只能判断水体中是否存在长孢藻,但无法检测潜在产毒藻的水体中是否有藻毒素,生物化学法即可快速地检测出水体中是否有某种藻毒素,目前主要有酶联分子法(ELISA)、蛋白磷酸酶抑制分析法(PPIA),其中,ELISA是将待测的藻毒素作为抗原,制作特异性的抗体对该藻毒素进行检测,现已有商用的ELISA试剂盒,一种试剂盒只能检测特定的藻毒素,监测人员可在现场用ELISA试剂盒检测相应的藻毒素的浓度[71]。PPIA是通过藻毒素对蛋白磷酸酶的抑制程度来测定藻毒素的含量,此法对藻毒素浓度的测定需要结合比色法、荧光法和同位素法,耗时短,操作简单,但特异性蛋白磷酸酶需要自制[72]。生物化学方法操作简单,无需对水样进行特殊处理,分析速度快,灵敏度较高,可以对水体是否含有某种藻毒素进行初步筛选,但不能准确鉴定水体藻毒素的种类,因而,没有广泛应用于藻毒素的监测。
4.3 化学分析法
随着检测技术的发展,可以准确检测出水体中藻毒素的种类和结构,化学分析法就成为了主要的检测手段,目前,检测藻毒素的化学分析法主要有液相色谱/质谱分析法(LC/MS)和高效液相色谱法(HPLC)[72],其中,HPLC常和其他检测方法结合使用。王素钦等[73]使用高效液相色谱-二极管阵列检测法(HPLC-PDA)和超高效液相色谱-串联质谱法(UPLC-MS/MS)对ATX-a的检测结果显示,UPLC-MS/MS更加灵敏、高效,但HPLC-PDA操作简单、检测费用低,更加适合实际工作中对湖泊、水库中长孢藻产生的毒素的监测。色谱分析法虽然可以分析出毒素的结构,分离和制备毒素,但检测时需要标准毒素样品,设备要求高,前处理操作比较耗时。
4.4 分子生物学法
自然水体中产毒藻和非产毒藻是同时存在的,以上方法都无法鉴别出水体中产毒藻株的丰度情况,随着分子生物学的发展,利用分子生物学方法监测水体蓝藻、产毒藻的种类和丰度成为可能,主要有聚合酶链式反应(polymerase chain reaction,PCR)、实时荧光定量PCR(quantitative real-time PCR,qPCR)和基因芯片技术。PCR技术可以对长孢藻的某种特异性的基因进行检测,是一种简单快速的分子监测技术,但此方法对特异性基因只能定性地分析,会出现假阴性和假阳性的结果[72],随着分子生物学的发展,qPCR逐渐运用到野外水体产毒藻的检测中。qPCR是通过荧光信号进行实时监测,具有灵敏度高、特异性强的特点,可对特异性基因进行定性定量的分析。该技术可根据长孢藻产ATX-a的特异性基因anaC、anaC-gen和anaC-anab等进行qPCR实时监测产毒株的丰度变化[74],也可通过对长孢藻产土臭素的特异性基因进行qPCR实时监测产土臭素长孢藻的丰度[75]。PCR技术不能同时监测水体中多个可能存在的基因片段,但基因芯片技术是将若干个待测的基因片段进行标记后作为靶分子,与基因芯片上的探针列阵杂交,可固定大量的探测分子,同时监测多种藻类基因[76]。分子生物法的特异性、敏感性、高通量的特点,可以作为监测蓝藻水华和藻毒素重要手段。随着5G技术的发展,人工智能和分子生物监测技术相结合,是长孢藻监测发展的新方向。
5 总结与展望
长孢藻在全球淡水水体中分布范围不断扩大,广泛分布于温带和亚热带地区的湖泊、河流和水库中。长孢藻对温度和光照的适应范围广,并有固氮作用,对磷有较强的吸收和很强的存储能力,加之藻细胞具有调节形态的能力,使其在诸多淡水系统中成为有力的竞争者继而成为优势种群,且在条件适宜的情况下形成水华。在全球变暖的背景下,长孢藻良好的环境适应性更有利于其繁殖生长。
长孢藻能产生多种对水环境和人类健康有害的藻毒素,特别是神经毒素ATX-a,除室内试验探究环境因子对长孢藻产毒能力的影响外,还需要调查自然水体中长孢藻的产毒分布情况和毒素的代谢机理,以进一步探究其毒性机制。鉴于长孢藻的危害性,有必要对淡水水体特别是饮用水源地进行定性定量的跟踪监测,传统的显微镜观察必不可少,生物化学法操作简单,色谱技术有利于更清楚地认识和了解藻毒素的结构,而qPCR技术和基因芯片技术给湖泊监测提供了高通量的方法,在长孢藻及其毒素的监测方向有广阔的前景。
鉴于现有的研究状况,可继续开展以下研究。(1)在全世界范围内都分布有长孢藻,且随着全球温度升高,还会在更多的水域出现长孢藻,所以有必要对不同地区或水域的长孢藻进行长期跟踪监测,特别是新出现长孢藻的水域,要对其进行基因水平的分析,推断长孢藻的亲缘性,确定其来源,从而为研究长孢藻的扩张提供重要的参考数据。(2)长孢藻的藻丝形态差异很大,环境因子和营养盐的差异不仅对长孢藻的形态有影响,而且对其产毒也有很大的影响。长孢藻作为重要的优势种群,需进一步地研究关键因子变化对其生长和产毒的影响。(3)在长孢藻产毒的机制方面,还需要进一步地探究ATX-a的产生和相关基因的表达以及产毒途径。(4)自然水体中监测ATX-a时需要实时准确的数据,因此,研究开发精准简便的监测长孢藻及其毒素的方法具有重要意义。目前,我国对长孢藻的发生、产毒等研究还比较薄弱,加强对长孢藻的研究和监测将对防控湖泊蓝藻水华灾害、保障水质安全提供重要的科学依据。

