学龄期儿童肉类食品摄入模式对其肠道菌群结构的影响
林琼希,伦静娴,张吉敏,何肖龙,龚泽龙,高雪峰,曹 虹
1南方医科大学公共卫生学院//广东省热带病研究重点实验室//微生物学系,广东 广州 510515;2南方医科大学南方医院康复理疗科,广东 广州510515
肉类能供给人体所必需的氨基酸、脂肪酸、无机盐和维生素,但过度、单一的肉食模式也会为人体的健康带来威胁。《中国居民膳食指南2021》[1]指出过量摄入畜肉、烟熏肉类是主要健康结局风险提高相关的膳食因素,建议居民应优化单一动物性食物消费结构。既往的研究结果显示肉类食品的摄入行为与糖尿病、冠心病、肥胖症等多种疾病密切相关,不良的肉食习惯将造成肠道菌群失调和代谢紊乱继而进一步增加疾病的风险[2,3]。青春期前的肠道微生物处于不成熟状态,早期的饮食习惯直接影响儿童的菌群模式,与生长发育的多种功能密切相关[4]。研究肉类饮食对儿童肠道微生物健康的影响,可精准优化儿童健康的饮食策略和干预措施,从微生物组学角度寻找预防疾病和促进健康的机会。因此,对学龄期儿童肉类饮食和肠道微生物的关系具有重要的意义。
红肉是指畜肉类包括猪、牛、羊等的肌肉、内脏及其制品。其脂肪含量比较高,其摄入含量的多少直接影响血液中胆固醇的含量。既往研究已发现过度摄入红肉将增加糖尿病、心血管疾病和癌症等疾病的风险[4,5]。白肉包括禽肉及水产品肉类,相比红肉脂肪含量较低,但蛋白质的含量较高。普遍认为白肉中所含的多不饱和脂肪酸含量较高,更有利于健康[1,5],但近期一项研究也显示白肉和红肉对机体胆固醇水平具有相同的效应[6]。由此可见,肉类饮食模式与人体健康密切相关,且仍存在大量的未知等待研究。既往有关肉类饮食的研究多基于特定疾病或正常成年个体,尚未发现有关儿童肉类饮食和肠道微生物关系的研究。本研究拟比较不同肉食模式下学龄期儿童的肠道菌群差异,为学龄期儿童肉类饮食和健康发展提供指导意见和生物学数据支持。
1 资料和方法
1.1 研究对象
选取深圳学龄期的健康儿童共44 例,年龄8~10岁。根据每个儿童白肉和红肉的月均摄入频率的比值R白/红(R=白肉摄入频率/红肉摄入频率),将所有儿童分为3组:白肉模式组15例(R<1),均衡组16例(R=1),红肉模式组13例(R>1)。入组的儿童排除标准:患有代谢性疾病、血液系统疾病、精神系统疾病或者其他重要脏器功能异常疾病;两周内曾患过胃肠道相关疾病;调查开始前1月内有服药记录;过去1年存在饮食结构变化。采集研究对象的膳食信息和新鲜晨便,提取粪便DNA后进行研究。本研究涉及多个机构合作,已获得马来西亚理工大学联合伦理委员会的审查(USMHLWE/IEC/2014-0006),所有被试儿童的法定监护人在实验前已签署知情同意书。
1.2 方法
1.2.1 膳食问卷调查 本研究采用由新加坡健康促进委员会提供的膳食频率调查问卷[7],该问卷由新加坡健康促进委员会和南方医科大学结合国内实际情况编制而成。问卷膳食情况包括瘦肉类、加工肉类、禽类、鱼类、海鲜类、奶制品、蛋类、绿叶蔬菜、非绿叶蔬菜、水果、豆类、甜品、饮酒咖啡以及营养添加剂等的摄入频率,膳食调查由经过统一培训的调查员进行面访调查。根据世界卫生组织的定义和文献参考[5,8],将膳食频率调查问卷中的猪、牛、羊等哺乳动物瘦肉类和加工肉类归为红肉,将禽类、鱼类和海鲜类归为红肉进行分析,并根据每个儿童白肉和红肉的月均摄入频率计算两者的比值R白/红,R=白肉摄入频率/红肉摄入频率。
1.2.2 粪便样本采集 采集研究对象的新鲜晨便5 g装入无菌粪便采集管内,立即密封、编号后送至-80 ℃超低温冰箱保存。
1.2.3 DNA 的提取和测序 根据QIAamp DNA Stool Mini kit(Qiagen)试剂盒的说明书提取粪便样本中DNA,经质检后对粪便16S rDNA基因Ⅴ3-Ⅴ4可变区进行PCR扩增,采用的测序引物为测序引物为338F(5'-A CTCCTACGGGAGGCAGCA-3')和806R(5'-GGACT ACHⅤGGGTWTCTAAT-3')。PCR产物使用AxyPrep DNA Gel Extraction Kit(Axygen)纯化,使用NEXTFLEX Rapid DNA-Seq Kit 进行建库,采用Illumina Miseq PE300平台进行双端高通量测序(上海美吉生物医药科技有限公司)。测序数据使用FLASH 软件进行拼接[9],fastp 软件进行质控[10],并使用UPARSE[11]软件根据97%的相似度对序列进行操作分类单元(OTUs)聚类,获得OTU丰度表。
1.3 统计分析
基本资料分析:运用SPSS 22.0软件对数据进行统计分析,计量资料描述采用均数±标准差表示计量资料组间比较采用卡方分析,计数资料3组间的比较采用单因素方差分析或者,方差齐的数据事后多重比较采用LSD比较,方差不齐的数据采用Tamhanes'T2比较,P<0.05为差异具有统计学意义。
肠道菌群分析:采用R语言(version 3.3.1)软件绘制肠道粪便OTU的Ⅴenn图及群落柱形图(Bar图),利用α多样性分析组内肠道菌群的物种多样性,其中Chao1和Ace指数反映群落丰富度以及Shannon指数反映多样性。采用β多样性分析比较两组间的菌群结构差异,以主坐标分析(PCoA)结果展示。采用Kruskal-Wallis H test统计法分析物种组间差异。采用LEfSe分析方法对样本组间差异细菌进行线性判别分析(LDA),找出在两组间产生显著性差异影响的物种。采用PICRUSt2对菌群测序结果进行功能预测分析。
2 结果
2.1 3组儿童基本资料和每月膳食频率比较
本研究共纳入44名学龄期儿童(24男,20女),年龄8~10周岁。收集膳食资料后,根据每个儿童白肉和红肉每月摄入频率的比值,将其归类为红肉模式组、均衡模式组和白肉模式组。3组儿童组间年龄、民族和性别分布无统计学差异(P>0.05),具有可比性。
对膳食频率问卷数据进行分析,3组儿童在红肉摄入量上,分别为红肉模式组>均衡模式组>白肉模式组(F2,41=3.727,P=0.033),而在白肉摄入量上,白肉模式组>均衡模式组>红肉模式组(F2,41=8.794,P=0.001),差异具有统计学意义。此外,在总肉类、面包、大米、蔬菜、水果、蛋类和奶制品等食品的月均摄入频率上,3组儿童均不存在差异(P>0.05),可排除由其他膳食变量所引起的分组偏倚。
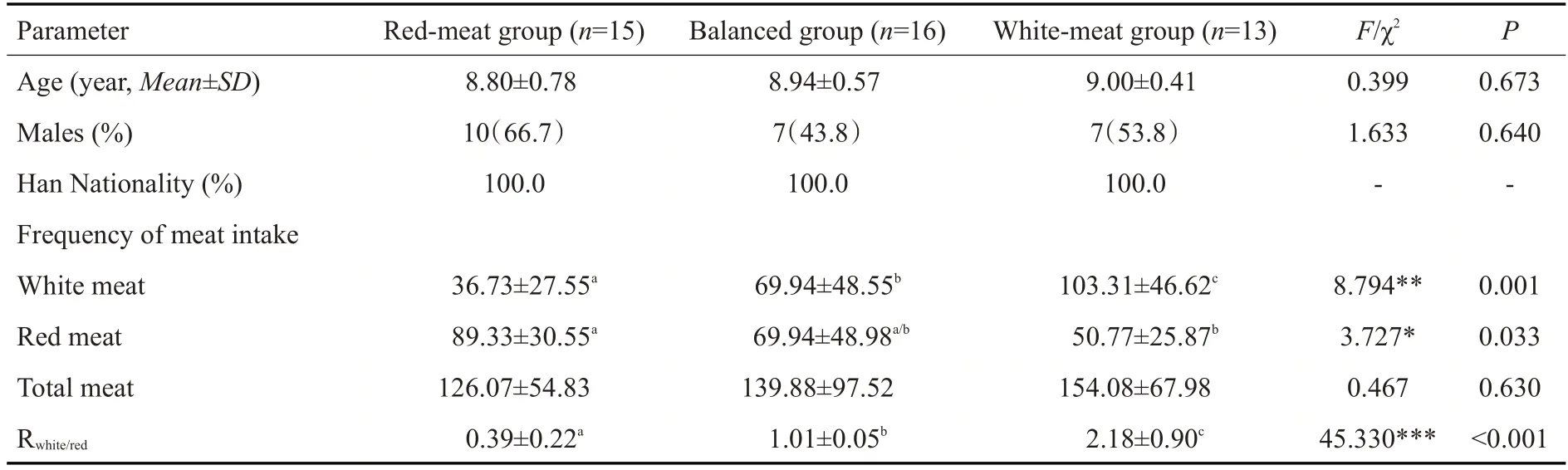
表1 3组儿童基本资料和肉类食品月均摄入频率比较Tab.1 Comparison of basic information and monthly frequency of meat product intake among the 3 groups of children
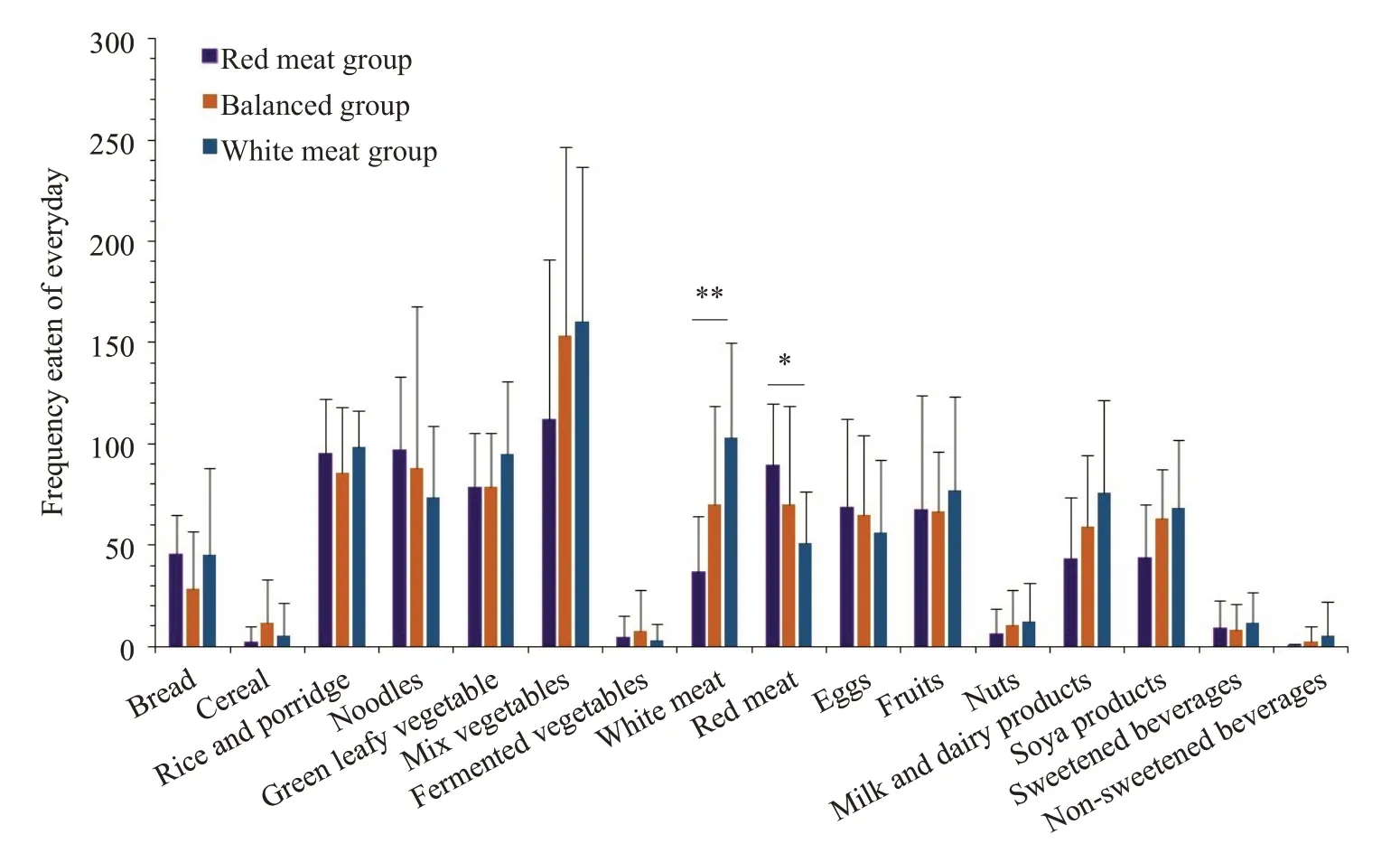
图1 3组儿童各类食物月平均摄入频率的比较Fig.1 Comparison of monthly intake frequency of different foods among the 3 groups of children(*P<0.05,**P<0.01).
2.2 3组儿童的肠道菌群结构分析
2.2.1 微生物群落OTU数量分析比较 经优化后44例儿童粪便DNA共获得1456565条有效序列,OTU聚类分析得到均衡组中OTUs数目比较丰富,共产生505个OTU,其余两组所产生的OTU数目均低于均衡组,分别是红肉组412个OTU,白肉组397个OTU。经过Ⅴenn图分析可见,红肉组和均衡组重叠361个OTU,白肉组和均衡组重叠349个OTU,红肉组和白肉组重叠335个OTU,3组共同重叠的OTU数目一共310个。
2.2.2 α多样性分析 对3组儿童粪便样本微生物群落多样性指数进行分析,α多样性中的Chao1和Ace指数越大,表示该组肠道微生物丰富度越高,Shannon指数越大说明群落多样性越高。结果发现3组样本检测到的OTU丰富度Chao指数和Ace指数均有显著性差异,偏好红肉模式和白肉模式的儿童肠道菌群的OTU丰度显著低于均衡饮食模式,这与前面的OTU 分析结果一致。通过Shannon指数组间差异分析发现,在肉制品上均衡饮食组儿童的肠道菌群多样性显著高于偏好红肉和白肉模式的儿童。此外,红肉组和白肉组在OTU丰富度和多样性指数上无显著差异(P>0.05)。

图2 3组儿童粪便微生物群落OTU分析Fig.2 OTU analysis of the fecal samples in the 3 groups of children.
2.2.3 β多样性分析 基于unweighted UniFrac distances的PCoA分析显示,3组儿童肠道微生物群落组成存在明显差异(Adonis,P=0.001),第一主成分和第二主成分的贡献率分别为15.13%和8.3%,不同的肉制品摄入模式会对儿童肠道菌群组成产生显著影响。
2.2.4 肠道菌群物种组成分析 在门水平上的构成比较显示,3组儿童肠道菌群的优势物种相同,主要是拟杆菌门(Bacteroidota)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和梭杆菌门(Fusobacterioa),但相对丰度不同,红肉模式组这4种菌门分别占比为52.6%、41.2%、3.5%、2.1%,均衡模式组分别是47.4%、48.2、3.5%、0.2%,白肉模式组分别为53.5%、42.8%、2.5%、0.7%。此外,尽管3种模式的拟杆菌门和厚壁菌门的占比不同,但3组儿童肠道厚壁菌门与拟杆菌门的比值(F/B)差异无统计学意义(F2,41=0.494,P=0.613)。
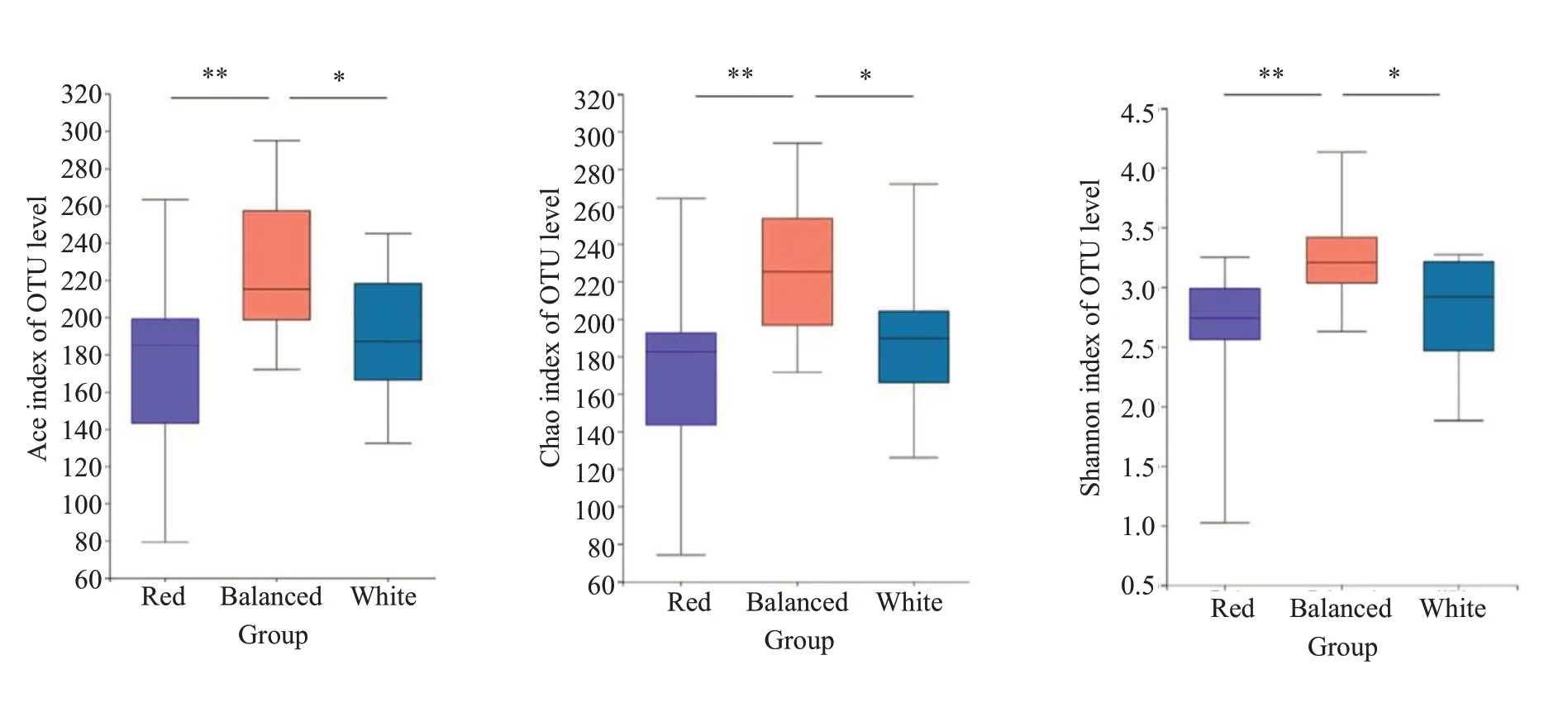
图3 3组儿童的肠道多样性比较Fig.3 Comparison of α diversity of intestinal microflora among the 3 groups(*P<0.05,**P<0.01).
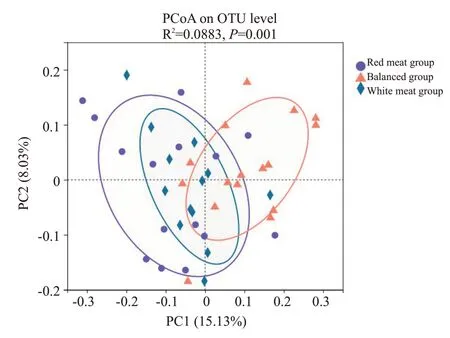
图4 3组儿童菌群的β多样性分析比较Fig.4 PcoA based on unweighted UniFrac distances in the 3 groups.
在属水平上的构成比较显示,红肉模式和白肉模式的前4种优势菌属分别是拟杆菌属(Bacteroides)、粪杆菌属(Faecalibacterium)、普雷沃氏菌属(Prevotella)和Agathobacter,而均衡模式的前四种优势菌属与前面两组略有不用,分别是拟杆菌属(Bacteroides)、粪杆菌属(Faecalibacterium)、Agathobacter和另枝菌属(Alistipes),普雷沃氏菌属(Prevotella)的丰富度较低,仅占比0.04%,明显低于红肉组的11.3%和白肉组的9.1%。

图5 3组儿童肠道菌群在门(A)和属(B)上的分布比较Fig.5 Comparison of the composition of intestinal microflora at the phylum (A) and genus (B) levels among the 3 groups of children.
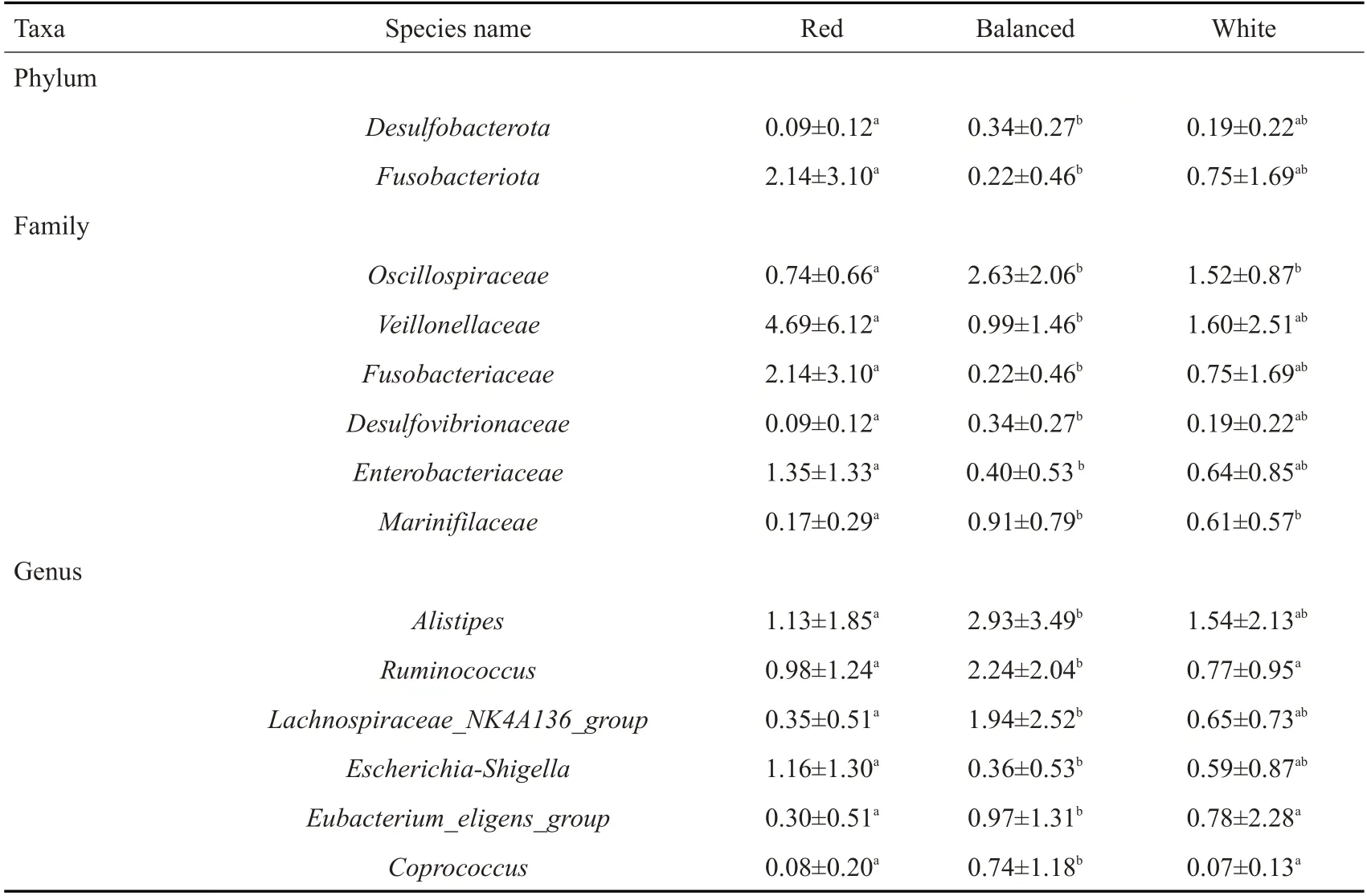
表2 3组儿童菌群在门科属水平上的组间差异分析Tab.2 Differences of community abundance among three groups of children at phylum,family and genus levels
2.2.5 肠道菌群组间差异分析 对3组儿童粪便标本菌群进行组间差异显著性检验分析,结果显示在门水平上红肉组与均衡组相比脱硫杆菌门(Desulfobacterota)显著降低,梭杆菌门(Fusobacterioa)显著增加。在科水平上,红肉组相比于均衡组显著增加韦荣氏球菌科(Veillonellaceae)、梭杆菌科(Fusobacteriaceae)和肠杆菌科(Enterobacteriaceae),显著减少颤螺菌科(Oscillospiraceae)和Marinifilaceae。在属水平上,红肉组的埃希-志贺菌属(Escherichia-Shigella)显著高于均衡组,Alistipes、瘤胃球菌属(Ruminococcus)、毛螺菌属(Lachnospiraceae_NK4A136_group)、Eubacterium eligens和粪球菌属(Coprococcus)显著低于均衡组。此外,白肉组的瘤胃球菌属(Ruminococcus)、Eubacterium eligens和粪球菌属(Coprococcus)也显著低于均衡组。红肉组和白肉组菌群在组间差异无统计学意义(P>0.05)。
为进一步筛选出不同肉类饮食模式下具有显著差异的微生物,我们通过LEfSe分析(LDA阈值为2)属水平上的3组儿童菌群差异,发现与均衡组相比,红肉组的样本中主要富集埃希-志贺菌属(Escherichia-Shigella)、粪芽孢菌属(Coprobacillus)和嗜冻菌属(Peptoniphilus),白肉组样本主要富集霍尔德曼氏菌属(Holdemanella),而均衡组样本相比红肉组和白肉组分别显著富集了毛螺菌属(Lachnospiraceae)、瘤胃球菌属(Ruminococcus)等31个和25个物种。此外,红肉组相比白肉组主要富集毛螺菌属(Lachnospiraceae),而白肉主要富集Odoribacter、Candidatus_Soleaferrea和Parvimonas菌属。

图6 LEfSe组间差异分析Fig.6 Histogram of LDA score distribution in the 3 groups.

图7 3组儿童菌群的KEGG通路比较Fig.7 Comparison of KEGG pathway abundance among the 3 groups(*P<0.05,**P<0.01,***P<0.001).
2.2.6 3种肉食模式对儿童菌群信号通路的影响 通过对比KEGG PATHWAY数据库,对3组儿童的菌群功能信号通路分析发现,红肉组的脂多糖生物合成、花生四烯酸代谢、甲状腺激素合成、碳水化合物消化吸收通路显著高于均衡组,而白肉组在阿米巴病通路显著低于均衡组。红肉组仅在花生四烯酸代通路显著低于均衡组。此外,红肉组仅在花生四烯酸代谢和甲状腺激素合成通路显著高于白肉组。
3 讨论
肠道菌群稳态对于人体的正常代谢和健康发展具有重要的意义,而肉类饮食习惯会直接影响肠道菌群结构并进一步对多种疾病的发生起作用[12],因此对儿童不同肉类饮食模式的菌群研究具有重要的意义。本研究根据深圳地区44名学龄期儿童不同的肉类饮食习惯将其分为3种肉食模式(红肉组、均衡组和白肉组)进行肠道菌群分析,探讨不同肉类饮食模式对儿童肠道菌群的影响。
α多样性分析结果显示红肉和白肉摄入频率较高的儿童菌群丰富度和多样性均显著低于均衡组,而红肉组和白肉组之间的菌群丰富度和多样性无显著差异,说明相比均衡的肉类饮食,偏好红肉饮食和白肉饮食均会引起肠道菌群的丰度和多样性显著降低,且两者在肠道微生物的丰富度和多样性上没有差异。α多样性可作为预测个体近期食用不同蛋白质来源后肠道微生物变化程度的指标[13],肠道内较低的细菌丰富度和多样性容易破坏其稳定性引起菌群失调,是造成各种疾病的风险因素之一[14]。由此可见,相比均衡的肉食模式,偏食红肉或者白肉的饮食模式可能会更容易引起儿童肠道菌群稳态失衡。
进一步分析也显示3组儿童的菌群结构显著存在差异,相比均衡组红肉组儿童肠道中显著增加梭杆菌科和肠杆菌科,更多富集埃希-志贺菌属,菌群功能预测分析中显示脂多糖生物合成通路显著上调,说明红肉饮食可能增加脂多糖(LPS)相关的革兰阴性菌并促进LPS生成,进而更容易破坏肠道屏障引发炎症反应[15],既往研究显示菌群失调导致内毒素入血和炎症反应是肥胖症及其相关代谢疾病的诱导因素之一[16]。Filippo等[17]对欧洲儿童和非洲儿童的粪便菌群进行研究,发现高脂肪的西方饮食会引起儿童肠道中具有更多的志贺菌及大肠埃希菌,本研究同样发现高脂肪的红肉组相比均衡组显著富集有更多的埃希-志贺菌属,而相对而言具有较多非饱和脂肪的白肉组虽然介于两组之间但差异不具有统计学意义,推测埃希-志贺菌属的丰度可能与红肉富有饱和脂肪密切相关。红肉(牛、羊、猪等)在2015年10月16日被国际癌症研究机构认为分别是2A级可能性致癌物[18],本研究也发现过量的红肉摄入可能对儿童健康存在菌群失衡等潜在的危险因素,但具体和癌症的关系仍有待进一步的临床研究。此外,均衡组相比其余两组显著富集瘤胃球菌、毛螺菌属、Eubacterium eligens菌属和粪球菌属等参与多种功能代谢的细菌[19-21],提示均衡摄入肉类食品比偏好红肉或者白肉的儿童更具有稳定和丰富的肠道代谢功能。白肉组相比均衡组富集有更多的霍尔德曼氏菌属,目前该菌给宿主带来的影响尚不明确,有研究显示其丰度与机体葡萄糖代谢和脂质代谢异常有关[22],也有研究显示双形霍尔德曼菌可以改善肥胖小鼠的糖耐量和调节GLP-1信号[23]。此外,菌群功能预测分析还显示红肉组在花生四烯酸代谢和甲状腺激素合成通路上显著高于其它两组,碳水化合物消化吸收显著高于均衡组,提示红肉组在脂质代谢、激素合成和碳水化合物代谢等相关功能上可能存在潜在异常。
本研究首次对健康儿童不同肉类饮食模式的肠道菌群特征进行分析,从精准微生物组学的角度为儿童的肉类饮食和肠道健康指导给予建议和基础数据支持。通过对不同肉食模式的学龄期儿童进行肠道菌群分析,发现相比均衡模式,红肉和白肉偏好模式均会显著下调肠道菌群丰度及改变菌群结构,减少瘤胃球菌、毛螺菌属、Eubacterium eligens菌属和粪球菌属等参与日常人体多种功能代谢的细菌。红肉模式饮食会富集更多的埃希-志贺菌属,并可能显著上调脂多糖生物合成通路。综上,本研究建议学龄期儿童应合理搭配肉类食品的摄入,均衡饮食,避免单一、过度的肉食模式。