GnRH激动剂和经血源性干细胞联合治疗对小鼠卵巢功能的影响
孙 芳,韦 伟
1绍兴第二医院医共体总院药剂科,浙江 绍兴 312000;2浙江大学医学院附属邵逸夫医院妇产科,浙江 杭州310000
卵巢早衰(POF)是指由于卵巢储备能力不足,在40岁之前出现的月经稀发、闭经、性欲减退等围绝经期症状,是妇科的常见疾病。近些年来,由于社会压力增加及饮食变化等因素,导致其患者数量日益增长且呈年轻化趋势。然而POF的发病机制尚未明确,临床上最常用的治疗方法为补充激素治疗[1-4]。以干细胞为核心的细胞疗法虽然取得了一定的疗效,但是仍集中在动物实验,临床应用较少[5,6]。
促性腺激素释放激素(GnRH)激动剂应用已久,主要利用下丘脑-垂体的负反馈通路机制直接促使黄体生成素(LH)和卵泡刺激素(FSH)升高。间充质干细胞为多功能细胞,在多种疾病的临床治疗中具有很大的应用价值。相关研究表明,从经血中分离出的经血源性间充质干细胞(MenSCs),注射到卵巢早衰小鼠模型后可以分化成卵巢颗粒细胞,且卵巢质量、雌二醇(E2)水平和正常卵泡数量均明显增加[7-10]。但是运用两种方法联合治疗POF 尚未有相关报道,本实验利用环磷酰胺(CCTX)腹腔注射小鼠构建POF模型,研究GnRH激动剂和MenSCs联合治疗对化疗所致POF模型小鼠的影响。
1 材料和方法
1.1 实验动物及细胞
45只6~8周的SPF级健康雌性昆明白小鼠,体质量为30~46 g,购于上海西普尔-必凯实验动物有限公司,动物生产许可证号SCXK(沪)2018-0008,饲养于杭州鹰旸生物科技有限公司动物中心,动物使用SYXK许可证号(浙)2020-0024。本实验符合《实验动物管理条例》并通过医院伦理委员会的批准。
MenSCs取自邵逸夫医院生殖障碍重点实验室,于低糖DMEM培养基中进行培养,添加10%胎牛血清。
1.2 实验药品及试剂
CTX(Eaivelly),丙氨瑞林(Acmec),HE染液套装(SERⅤICEBIO),FITC Mouse Anti-Human CD44、CD73、CD34、CD90、CD146、CD133、CD45RO(BD BIOSCIENCES PHARMINGEN),Mouse Anti-Human CD49d-PE(联科生物),BCA蛋白定量试剂盒(Solarbio),Ki67、Bcl-2、Bax、caspase 9、caspase 3、Antibody-Internal[AF0198(1∶2000)、AF6139(1∶2000)、AF0120(1∶3000)、AF6348(1∶2000)、AF6311(1∶2000),Affinity],GAPDH、cleaved-caspase 9 (Asp353)、cleaved-caspase 3(Asp175)、p-AKT(Ser173)、Akt、PI3K、p-PI3KAntibody[AF7021(1∶3000)、AF5240(1∶2000)、AF7022(1∶2000)、AF0016(1∶2000)、AF6261(1∶2000)、AF6241(1∶2000)、AF3242(1∶2000),Affinity],小鼠促黄体激素(LH)、小鼠促卵泡生长激素(FSH)、小鼠缪勒管抑制物质/抗缪勒管激素(MIS/AMH)、小鼠雌二醇(E2)ELISA试剂盒(批号:MM-0582M2、MM-0555M2、MM-44204M2、MM-0566M2,酶免)。
1.3 实验仪器
病理切片机(型号:RM2016,上海徕卡仪器有限公司),正置光学显微镜(型号:Nikon Eclipse E100,日本尼康),二氧化碳培养箱(型号:Scientific BB150,Thermo),流式细胞仪(型号:C6,BD),化学发光仪(型号:610020-9Q,勤翔),酶标仪(型号:CMaxPlus,MD),倒置显微镜(型号:AE2000,Motic)。
1.4 实验分组及给药
取45只6~8周大的SPF级健康雌性昆明白小鼠按随机数字表法平均分为Control 组、POF 组、MenSC+POF组、GnRHa+POF组、MenSC+POF+GnRHa组,每组9只。Control组给予生理盐水腹腔注射l mL/d,连续灌胃14 d。POF组腹腔注射120 mg/(kg·d)CTX,连续注射15 d。MenSCs+POF组于第16天(即CTX损伤处理之后)行干细胞局部注射移植,200 μL细胞悬浮液,含2×106MenSCs。GnRHa+POF组中POF造模前14 d予丙氨瑞林0.1 mg/(kg·d)皮下注射,第15天开始CTX连续腹腔注射。MenSC+GnRHa+POF 组按MenSC+CTX组和GnRHa+CTX组方案联合用药,其中MenSCs于第30天局部注射移植。MenSCs注射治疗约5 d,通过动情周期确定指标检测时间。
1.5 流式细胞术仪检测MenSCs细胞表面标志物的表达情况
胰酶消化贴壁细胞并收集细胞,用PBS清洗2次后重悬,按照分组加入对应的抗体,避光孵育30 min;孵育结束后,洗去未结合的抗体,重悬后上机检测。
1.6 HE染色观察小鼠卵巢组织病理变化情况
石蜡切片脱蜡至水,依次用苏木素、伊红染色后,脱水并封片,显微镜镜检,图像采集分析。
1.7 ELISA检测小鼠血清中相关激素含量水平
小鼠眼眶取血后,分离血清,依据试剂盒说明检测血清中LH、FSH、抗缪勒管激素(AMH)和E2的含量水平。
1.8 Western blot检测
提取小鼠卵巢颗粒细胞的蛋白,依据BCA蛋白浓度测定试剂盒说明测定样品的总蛋白浓度,行SDSPAGE电泳后转至PⅤDF膜,TBST洗膜。行免疫印迹反应,封闭液封闭,加含一抗稀释液,4 ℃过夜孵育,弃一抗,加入二抗(IgG H&L(HRP),稀释倍数为1∶3000),室温摇床振荡反应1~2 h,回收二抗,TBST 洗膜。以GADPH为内参,化学发光仪显影,chemi capture软件分析图像,测定各组小鼠颗粒细胞中KI-67、Bcl-2、BAX、caspase 9、caspase 3、cleaved-caspase 9、cleavedcaspase 3、p-PI3K、PI3K、p-Akt及Akt的蛋白表达情况。
1.9 统计学处理
采用SPSS 16.0统计软件进行数据分析,计量资料多组间用One-way-ANOAY单因素方差分析,组间比较采用SNK分析。方差不齐者采用Kruskal-Wallis H检验。所有数据以均数±标准差表示,P<0.05为差异有统计学意义。
2 结果
2.1 流式细胞术检测MenSCs细胞表面标志物的表达情况
MenSCs高表达CD44、CD49、CD73、CD90、CD146,低表达CD133、CD34、CD45(表1)。

表1 MenSCs细胞表面标志物的表达情况Tab.1 Expression of MenSCs cell surface markers(Mean±SD,n=6)
2.2 GnRH激动剂和经血源性干细胞联合治疗对小鼠卵巢的影响
治疗后POF组小鼠行动缓慢、食欲下降、体毛晦暗无光泽,整体状态较差,MenSC+POF、与POF+GnRHa组小鼠活动及进食基本正常,Control 组及MenSC+POF+GnRHa组小鼠活动正常,进食正常,体毛光滑而有光泽。Control组小鼠卵巢各级卵泡清晰可见,卵泡数较多;与Control组相比,POF组小鼠卵巢纤维化明显,卵巢中窦前卵泡及窦卵泡数量减少,而闭锁卵泡数增多;与POF组相比,MenSC+POF组与POF+GnRHa组卵巢组织中空泡及闭锁卵泡明显减少,颗粒细胞数量增多且呈放射状整齐排列,并开始出现各级卵泡,成熟卵泡明显增多,MenSC+POF+GnRHa组卵巢组织中卵泡数量丰富,各级卵泡均可见到,黄体数量较多,可见到少量闭锁卵泡(图1)。
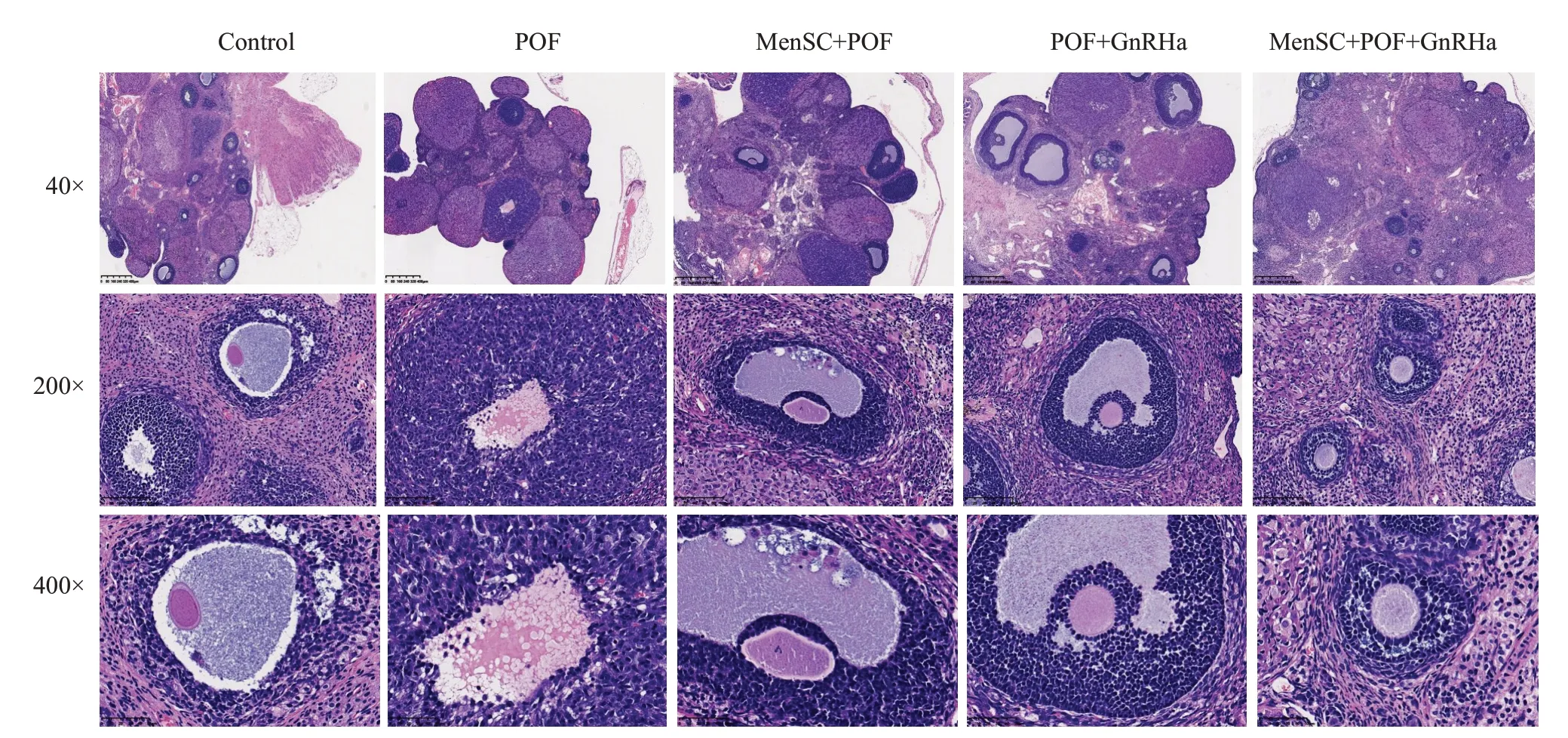
图1 小鼠卵巢组织病理学改变Fig.1 Histopathological changes of mouse ovary.
与Control组相比,POF组小鼠卵巢组织原始卵泡、初级卵泡与次级卵泡数显著降低(P<0.01),闭锁卵泡数显著升高(P<0.01)。与POF组相比,MenSC+POF组小鼠卵巢组织原始卵泡显著升高(P<0.01),闭锁卵泡数显著降低(P<0.01),POF+GnRHa 组与MenSC+POF+GnRHa组小鼠卵巢组织原始卵泡、初级卵泡与次级卵泡数显著升高(P<0.01),闭锁卵泡数显著降低(P<0.01,表2)。
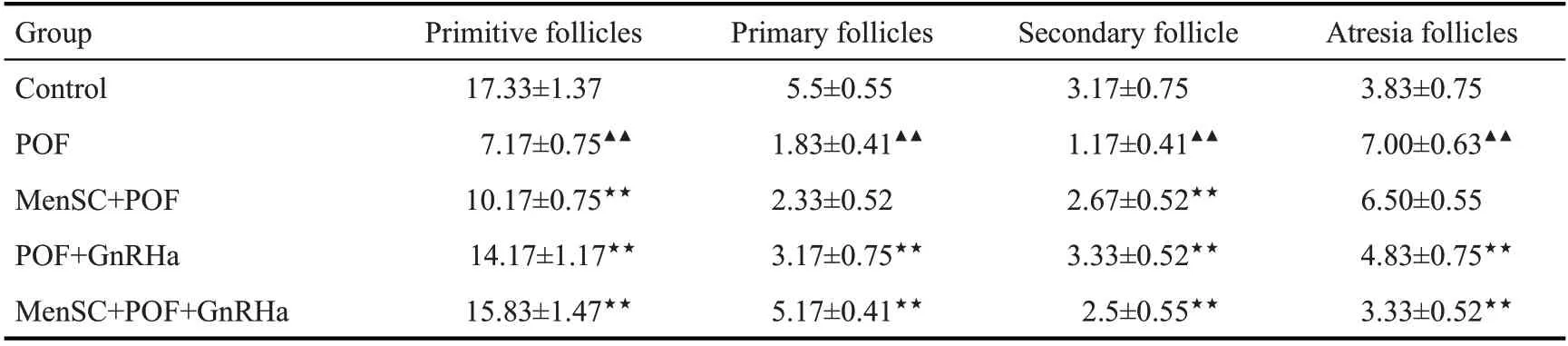
表2 小鼠卵巢组织各级卵泡统计Tab.2 Statistics of follicles in mouse ovarian tissue(Mean±SD,n=6)
2.3 GnRH激动剂和经血源性干细胞联合治疗对小鼠血清性激素水平的影响
与Control组比较,POF组小鼠血清中LH和FSH的含量水平显著升高(P<0.01),AMH和E2含量水平显著降低(P<0.01);与POF 组比较,POF+GnRHa 组和MenSC+POF+GnRHa组血清中LH和FSH的含量水平显著降低(P<0.01),AMH和E2的含量水平显著升高(P<0.05或P<0.01,图2)。
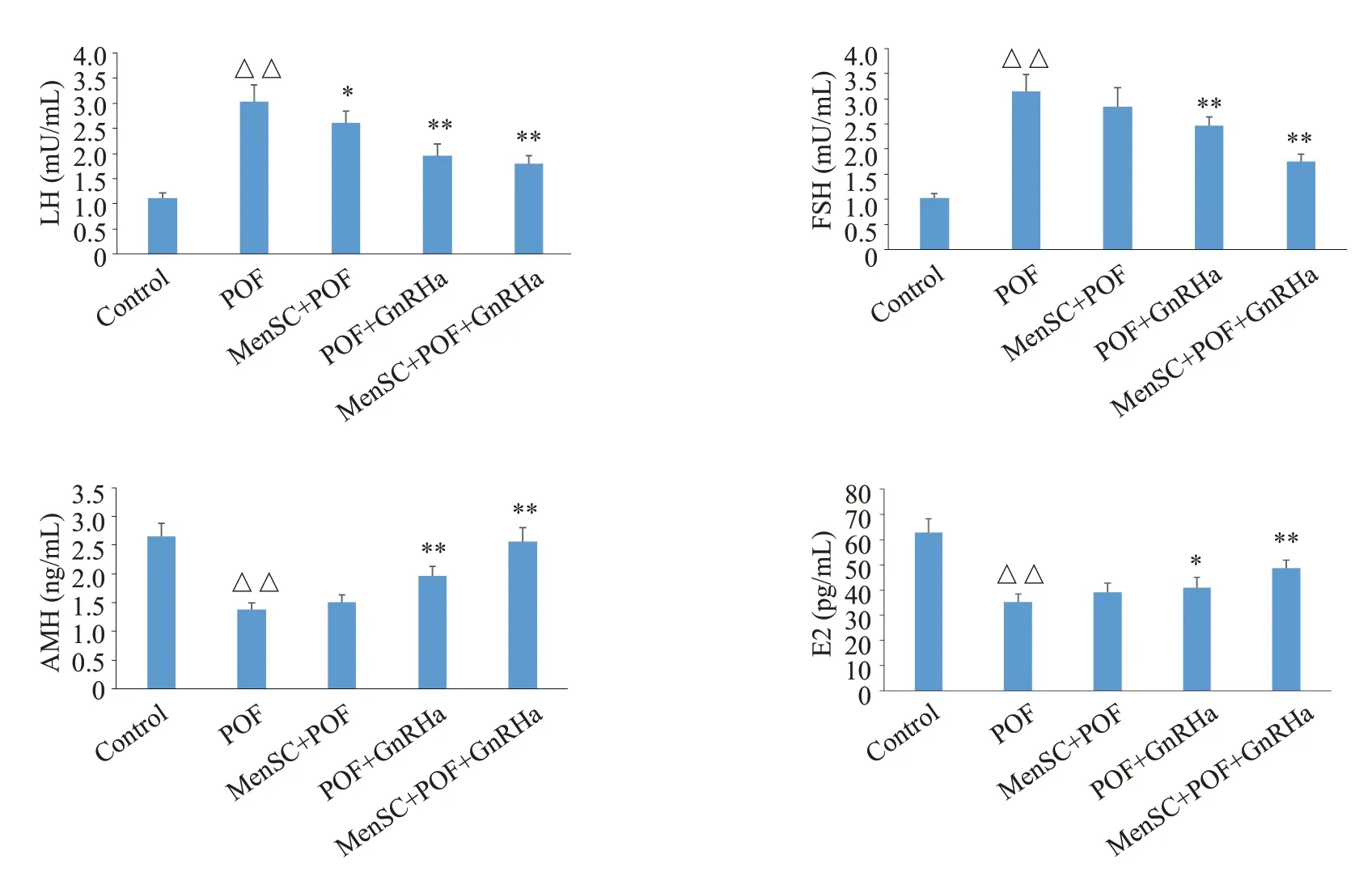
图2 各组别小鼠血清中LH、FSH、AMH和E2的含量水平Fig.2 Serum levels of LH,FSH,AMH and E2 in each group(Mean±SD,n=6).△△P<0.01 vs Control group,*P<0.05,**P<0.01 vs POF.
2.4 GnRH激动剂和经血源性干细胞联合治疗对小鼠卵巢颗粒细胞中相关蛋白表达水平的影响
与Control组相比,POF组的小鼠卵巢颗粒细胞中BAX、cleaved-caspase 9/caspase 9、cleaved-caspase 3/caspase 3 蛋白表达水平显著升高(P<0.01),KI-67、Bcl-2的蛋白表达水平显著降低(P<0.01);与POF组相比,POF+GnRHa组和MenSC+POF+GnRHa组小鼠卵巢颗粒细胞中BAX、cleaved-caspase 9/caspase 9、cleaved-caspase 3/caspase 3 蛋白表达水平显著降低(P<0.05或P<0.01),KI-67、Bcl-2的蛋白表达水平显著升高(P<0.05或P<0.01,图3)。
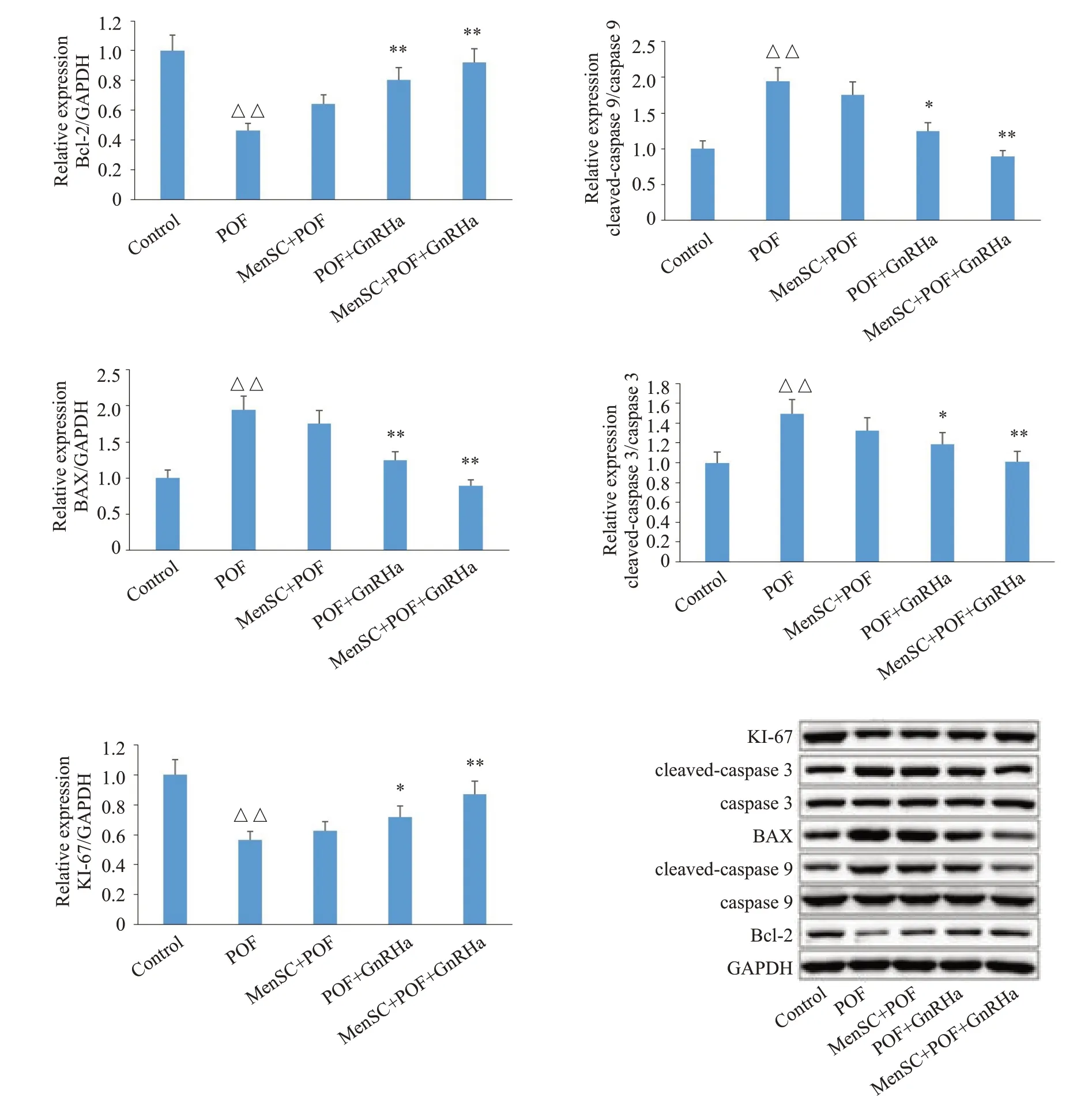
图3 小鼠卵巢颗粒细胞中KI-67、Bcl-2、BAX、Cleaved-Caspase 9、Cleaved-Caspase 3蛋白表达情况Fig.3 Protein expression of Ki-67,Bcl-2,BAX,cleaved caspase 9,and cleaved caspase 3 in different groups.△△P<0.01 vs Control group,*P<0.05,**P<0.01 vs POF.
2.5 小鼠卵巢颗粒细胞中p-PI3K、PI3K、p-Akt及Akt蛋白的表达情况
与Control 组相比,POF 的小鼠卵巢颗粒细胞中p-PI3K、p-Akt蛋白表达水平显著降低(P<0.01);与POF组相比,POF+GnRHa组和MenSC+POF+GnRHa组小鼠卵巢颗粒细胞中p-PI3K、p-Akt蛋白表达水平显著升高(P<0.05或P<0.01,图4)。
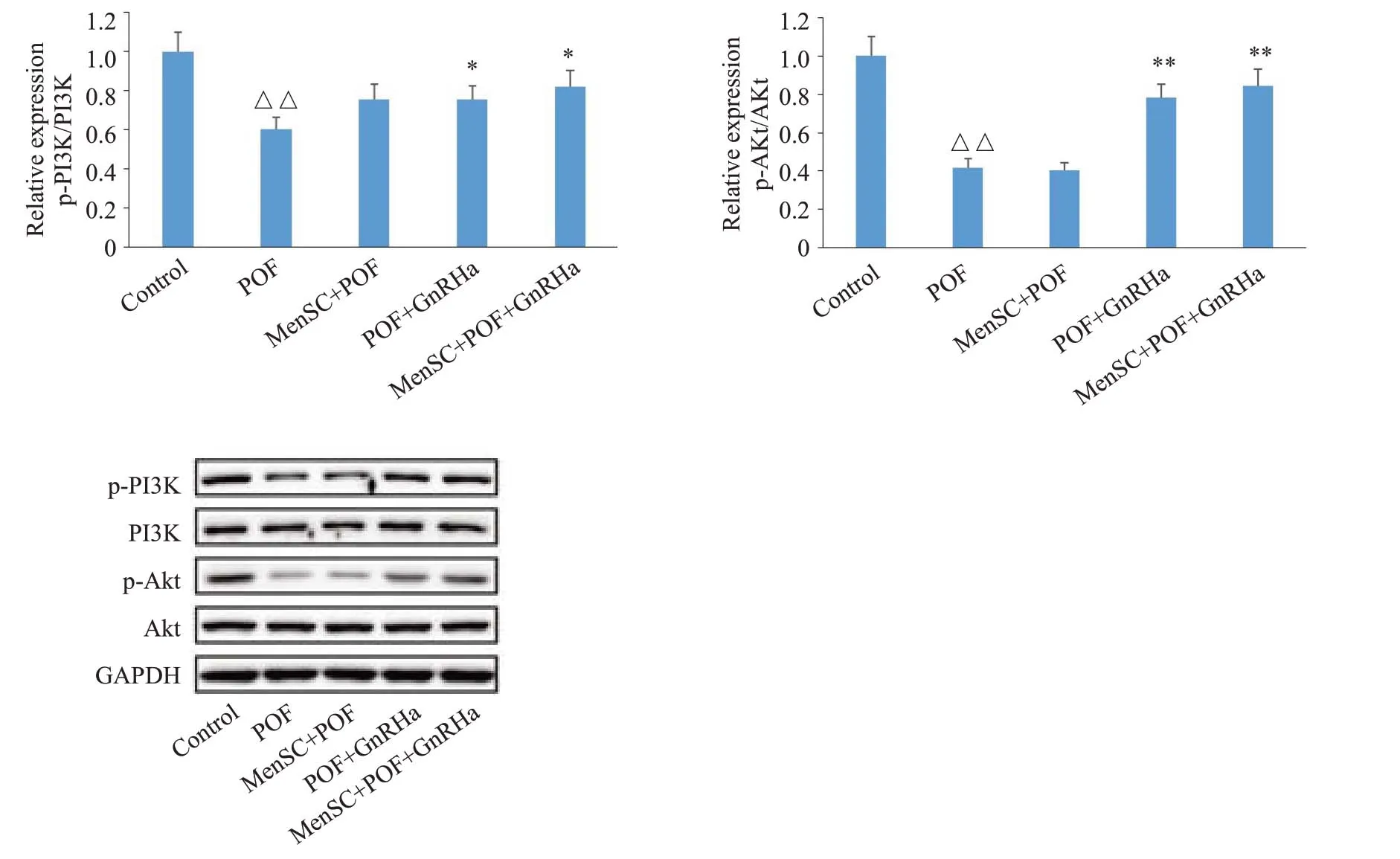
图4 小鼠卵巢颗粒细胞中p-PI3K、PI3K、p-Akt 及Akt蛋白表达情况Fig.4 Protein expression of p-PI3K,PI3K,p-Akt,and Akt in ovarian granulosa cells in different groups(Mean±SD,n=3).△△P<0.01 vs Control group,*P<0.05,**P<0.01 vs POF.
3 讨论
近些年POF已成为临床上的常见病症,困扰着广大的女性患者,POF发病主要与颗粒细胞的凋亡、脆性X智力障碍基因、AMH基因、生长分化因子9基因、叉头框因子-1基因、LRPPRC基因等的突变和缺失以及患者自身免疫功能异常以及线粒体功能异常等因素有关[11,12]。作为治疗POF临床常用药物,GnRH激动剂对GnRH受体具有高亲和力,当GnRH激动剂占据GnRH受体后可减少腺垂体分泌FSH 和LH,最终降低体内雌激素水平。有相关研究报道GnRH激动剂在恶性肿瘤化疗过程中具有保护绝经前女性卵巢功能的作用[13-15]。作为一种新兴的细胞治疗方式,人类MenSCs能定向迁移到POF模型鼠的卵巢间质中,通过减少颗粒细胞凋亡和减轻卵巢间质纤维化来改善卵巢微环境进而恢复卵巢功能[16-19]。
利用人经血来源间充质干细胞治疗卵巢早衰小鼠,卵巢组织增殖标记物Ki67升高,证明其治疗机制可能为促进细胞增殖[7]。将热休克处理的间充质干细胞注入大鼠卵巢后,卵巢质量和E2水平均增加,不同阶段的卵泡数量也相应增加,并降低疗卵泡刺激素水平和颗粒细胞凋亡率[20,21]。本研究采用GnRH激动剂和经血源性干细胞联合治疗POF小鼠模型,为明确本研究中的细胞来源和特性是否由原始具有多种分化能力的全能干细胞分化而来,本研究通过流式细胞术检测实验MenSCs中各蛋白表达水平,结果显示,所运用的经分离的经血干细胞高表达间充质干细胞表面标志物,如CD73、CD90、CD44等,不表达或低表达造血干细胞标志物CD34、CD38,表明实验所用细胞具有间充质干细胞的特性。HE染色结果显示GnRH激动剂和经血源性干细胞联合治疗对POF小鼠卵巢具有保护作用,可抑制卵巢纤维化,减少卵巢闭锁卵泡的产生。
PI3K-Akt信号通路广泛存在与细胞中,参与细胞生长,增殖,分化及凋亡的调节,Akt位于PI3K-Akt信号通路的中心,是最重要的PI3K下游靶酶。激素能够激活PI3K的活性,从而对下游信号通路进行调控,调节卵巢激素的分泌。相关研究报道,针刺治疗可通过提高E2的分泌水平进而调控PI3K/Akt/mTOR信号通路来实现对POF的治疗[22-25]。曲晓力等[26]分析了100例卵巢疾病患者的激素水平,结果显示血清FSH和LH激素水平与卵巢储备功能呈明显负相关,AMH与E2激素水平与卵巢储备功能呈明显正相关,表明AMH、FSH、LH、E2可作为患者卵巢储备功能评价的指标。在本研究中,与POF 组比较,POF+GnRHa 组和MenSC+POF+GnRHa组血清中LH和FSH的含量水平显著降低(P<0.01),AMH和E2的含量水平显著升高(P<0.05或P<0.01),推测GnRH激动剂和经血源性干细胞联合治疗,可能通过调控PI3K-Akt信号通路改善POF小鼠的性激素水平,提高POF小鼠卵巢的储备功能。
PI3K/Akt与经典的凋亡途径有直接关联,可以通过抑制各种转录因子的活性,减少凋亡基因的表达下调细胞的凋亡过程。Bcl-2是一种主要的凋亡抑制基因,BAX基因是人体最主要的凋亡基因,KI-67抗原是一种与细胞增殖相关的核抗原[27,28]。有研究在调查重组人乳铁蛋白对卵巢早衰的影响时发现,在给药后POF大鼠的KI-67表达上调,BAX的表达随Bcl-2的表达上调而降低[29],证明在治疗POF的过程中,Bcl-2、BAX、KI-67具有重要作用。caspases是一组存在于胞质溶胶中的结构上相关的半胱氨酸蛋白酶,其顺序激活在细胞凋亡的执行阶段起着核心作用,是一种肿瘤抑制因子。caspase-9属于启动型caspase,处于细胞凋亡传导通路的起始部位,当有其他辅助因子作用时,发生自我活化,激活下游的caspase[30],caspase-3属于执行型caspase,能够特异性裂解底物,使机体细胞发生形态学和生化改变,发生细胞凋亡[31]。本研究结果显示:与POF组比较,GnRH激动剂和经血源性干细胞联合治疗可抑制小鼠卵巢颗粒细胞中BAX、cleaved-caspase 9、cleavedcaspase 3的蛋白表达(P<0.05或P<0.01),促进KI-67、Bcl-2的蛋白表达(P<0.05或P<0.01)。表明GnRH激动剂和经血源性干细胞联合治疗可抑制颗粒细胞的凋亡,且其原因可能为多基因共同作用的结果。而在联合治疗后,p-PI3K、p-Akt的蛋白表达(P<0.05或P<0.01)升高表明多基因作用可能由PI3K-Akt信号通路调控产生。
综上所述,GnRH激动剂和经血源性干细胞联合治疗可能通过PI3K-Akt信号通路表达升高,减少闭锁卵泡的产生,提高小鼠卵巢的储备功能,从而达到对卵巢修复和保护的目的。