促生菌对烟草生长及土壤微生物数量及养分的影响
伍德洋,张再刚,彭文勇,陈 凡,郑福端,廖 萍,陈 强,赵 珂
(1.四川省烟草公司凉山州公司盐源分公司,四川 西昌 615200;2.四川省烟草公司凉山州公司会东分公司,四川 西昌 615200;3.四川农业大学,成都 611130)
四川省是我国3大烟叶生产基地之一,四川烤烟生产主要分布在凉山、攀枝花、泸州、宜宾和广元五大烟区。其中,凉山州烟区地处川西南横断山系东北缘,具备得天独厚的自然条件,生产的烟叶气味清香独特,2017年凉山州种植烟叶6.25万hm2,是中式卷烟的重要原料供应地,因此稳定和提高烤烟质量是凉山烟区的主要任务[1]。施肥是提高烟叶产量和质量的重要措施,而一味追求高经济效益和产量,不合理使用化肥,且过量施肥会导致烟叶贪青晚熟,较难把握烘烤环节,容易生产出失去经济价值的劣等烟,有效产量不高以及对壤质量和环境造成难以恢复的破坏[2]。
以微生物菌剂为代表的微生物肥料是实现“减肥减药”“化肥零增长”“农业可持续发展”和“生态农业”不可或缺的一类低能耗、环境友好型肥料,而优良的菌种资源是研发微生物菌剂的重要来源[3-4]。放线菌是一类数量大、种类多、具有重要实用价值和开发潜力的微生物资源。放线菌通过产生抗生素、植物生长调节素等机制促进植物生长,通过产生几丁质酶、纤维素酶、蛋白酶、磷酸酶等活性酶提高植物的抗逆性,是筛选功能微生物菌剂的一个重要来源[5-6]。近年来,已报道与烟草有关的促生菌主要是芽孢杆菌属(Bacillus)、假单孢菌属(Pseudomonas)、肠杆菌属(Enterobacter)等[7-9];但关于放线菌促进烟草生长方面的研究鲜有报道。因此,基于本实验室前期从筛选获得的具有产IAA、溶磷、产铁载体以及抑菌功能的放线菌帚状链霉菌(Streptomycesscopiformis)CL21和加利福尼亚链霉菌(Streptomycescalifornicus)CL52为研究对象,并充分考虑两株菌的互作作用,通过盆栽实验研究这两株促生菌对烟草生长的作用及其对烟草根际土壤营养和微生物数量的影响,为植烟区烟草生产可持续发展提供优良的促生菌株。
1 材料与方法
1.1 试验地点和材料
1.1.1 实验场地 试验于2019年3~5月在凉山州烟草公司会东县分公司的育苗基地进行,采用盆栽的方式种植。
1.1.2 供试土壤 盆栽土壤采自会东县参鱼河镇植烟大田0~20cm土壤,阴干灭菌后过2mm筛网,按7.5kg/盆装入口径为30cm的花盆中。
1.1.3 供试菌株 帚状链霉菌(Streptomycesscopiformis)CL21,加利福尼亚链霉菌(Streptomycescalifornicus)CL52。
1.1.4 供试烟草材料 云烟85。
1.1.5 仪器设备 采用CIRAS-1型光合作用测定系统(英国PP-System公司)测定叶片的光合作用参数;采用EPSON1680根系扫描仪(Epson,LongBeach,USA)扫描根系进行扫描和分析。
1.2 方法
1.2.1 促生菌菌剂的制备 在三角瓶中装入1/3量的麦粒于121℃灭菌30min冷却至室温。将供试菌株CL21、CL52在高氏一号培养基上活化,待菌株长满斜面后,加入无菌水洗下孢子,再转入装有麦粒的三角瓶中与麦粒充分混匀,于28℃培养1周以上,待麦粒长满白色的孢子后备用。
1.2.2 接菌与培养 烟草采用漂浮盘方法进行育苗,待长出3~5片真叶后移栽到花盆中,每个花盆中栽1株。按照不同处理给烟草灌根,3个处理加1个对照,每个处理3次重复(表1)。
1.2.3 样品采集 待烟草生长至旺长期(50~60d),铲去1cm表层土,小心将烟草植株拔出,收集根际土和非根际土,洗净植物,备用。
1.2.4 烟草农艺性状测定 在烟草旺长期测定包括烟株株高、茎围、有效叶片数、最大叶长、最大叶宽、植株地上地下部的鲜重和干重等数据。
1.2.5 烟草光合作用 待烟草长至旺长期,参照肖雨等人[10]的方法采测定烟叶的净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)、细胞间隙CO2浓度(Ci)等指标。
1.2.6 烟草根系形态研究 参加李静等人的方法对各组样品的根系总长度、总根表面积、总根体积和总根毛数等形态指标[11]。
1.2.7 烟草及其土壤养分含量测定 参考鲍士旦等人[12]方法测定测定烟草全氮、全磷、全钾,土壤全氮、全磷、全钾,速效氮、速效磷、速效钾含量以及有机质含量。
1.2.8 烟草及土壤微生物数量测定 参考沈萍等人[13]方法分离烟草根、茎、叶以及根际和非根际土壤中的细菌、放线菌和真菌,并测定各类菌的数量。
1.2.9 数据分析 Excel采用SPSS20.0软件进行方差分析和LSD法多重比较。
2 结果
2.1 接种菌株对烟草全氮、全磷、全钾含量的影响
盆栽实验表明,接种菌剂后对烟草根、茎、叶中全氮、全磷和全钾的具有较大影响。混合菌剂CL21+CL52处理后的烟草根、茎、叶中的全氮的含量显著高于单菌处理,且均远高于对照组,但单菌CL21和CL52处理之间,以及单菌处理与对照组全氮含量差异都不明显。烟草全钾、全磷的分析结果表明,经过接种菌剂处理后,烟草的根、茎、叶中全钾和全磷含量均高于对照组,混合菌剂CL21+CL52处理的效果明显高于单菌处理,烟草经CL21+CL52处理烟茎中的全磷含量经提高了1.6%,烟叶的全钾含量提高了1.5%。结果表明,促生菌CL21和CL52能提高烟草植株内全氮、全磷、全钾的含量,且混合菌剂CL21+CL52效果更佳。
2.2 促生菌对烟草根际土与非根际土养分含量影响
通过对接种单菌CL21、CL52、混合菌剂CL21+CL52以及不接种促生菌剂烟草根际土与非根际土壤理化成分的分析发现,接种促生菌剂后的烟草根际土壤与对照组之间存在显著性差异(P<0.05)。接种菌剂后根际土壤分析结果表明,除单菌CL52处理根际土中有效钾较CK组低外,烟草根际土壤壤中的碱解氮、速效钾、有效磷和有机质在接种促生菌剂后均有显著增加,表现为混菌CL21+CL52>单菌CL52>单菌CL21>CK;接种菌剂后非根际土壤分析结果表明,混菌CL21+CL52处理后土壤中的碱解氮、速效钾、有效磷和有机质显著高于单菌CL21、CL52处理以及对照组处理,单菌处理与对照组无明显差异,其中单菌处理的有效钾和有机质还显著低于对照组(表2)。
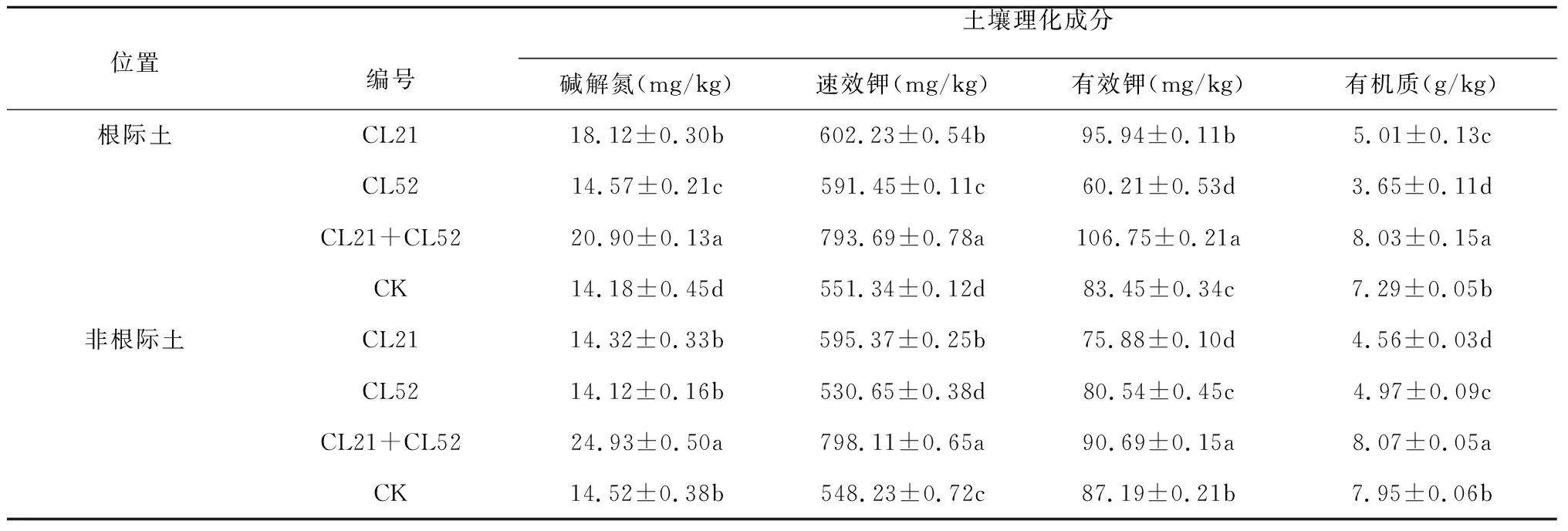
表2 促生菌对土壤理化性质的影响
2.3 促生菌对烟草生长的影响
盆栽结果表明,接种菌剂后能较好的促进烟草的生长。烟草生长数据统计结果表明,混菌CL21+CL52处理在烟草株高、最大茎围、最大叶长和最大叶宽均优于其它处理,较对照组分别增加35.5%,28.5%,25.5%,15.2%,较单菌CL21处理分别增加了25.8%,11.4%,12.5%,4.5%,较单菌CL52处理分别增加了29.1%10.3%7.1%3.2%,单菌CL21和CL52处理优于对照组。
烟草地上和地下2个部分的鲜重和干重也均是混菌CL21+CL52处理效果最佳,较对照组烟草鲜重和干重分别增加了47.2%,27.6%,45.7%,21.8%。除单菌CL52地下部的鲜重和干重低于对照组外,单菌处理组均能促进烟草地下部分的生长。烟草有效叶片数统计结果表明,各处理组烟草有效叶片数CL21+CL52(17片)>CL21(13片)>CL52(12片)>CK(10片)。
2.4 烟草光合作用分析
对烟草净光合速率的测定结果表明,各处理的净光合速率为CL21+CL52(10.58)>CL52(9.88)>CL21(9.67)>CK(8.99),混菌CL21+CL52处理下烟草叶片净光合速率最大,表明其光能利用率最高;单菌处理净光合速率均大于对照组,表明接种促生菌剂能有效提高烟草叶片的光能利用率(表3)。
经测定,烟草的气孔导度为混合菌剂CL21+CL52(1.12)>CL21(0.85)>CL52(0.58)>CK(0.50),混菌处理CL21+CL52组处理的气孔导度最大,而对照组处理的气孔导度最小,说明该组处理下的烟草叶片生理活性最强(表3)。
对各处理烟草胞间CO2浓度和蒸腾速率的分析结果表明,胞间CO2浓度为CL21+CL52(372.56)>CL21(353.45)>CL52(342.65)>CK(332.32);单菌CL21和CL52的蒸腾速率无差异,混菌CL21+CL52蒸腾速率明显高于其它处理,进一步表明促生菌CL21和CL52能提高烟草的生理活性强度和光能利用率,促进烟草的生长(表3)。
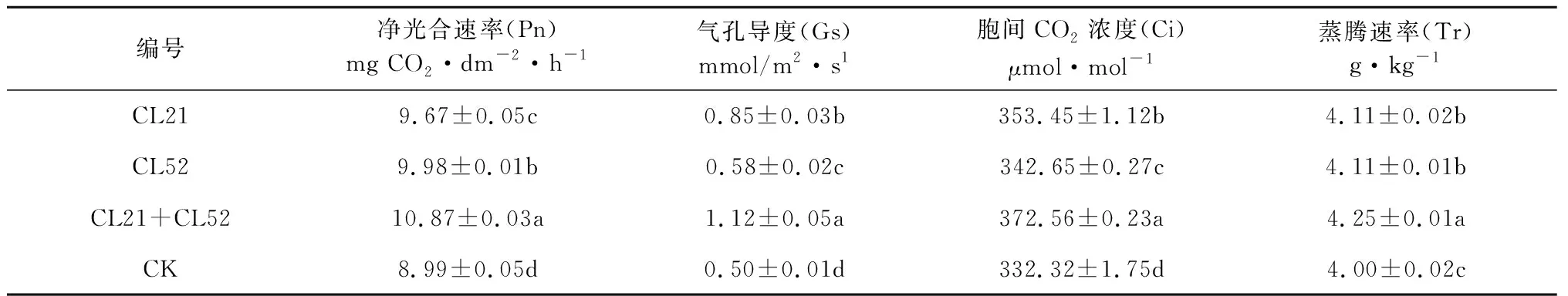
表3 烟草光合作用测定结果
2.5 烟草根系形态研究
各处理烟草旺长期的根系形态经过根系扫描结果表明,显示样品间存在显著性差异(P<0.05),接菌剂处理的各项指标均大于对照组,且CL21+CL52处理下根的总根长、总表面积、平均直径、总体积和总根毛数均最大,分别为9678.12cm,1296.76cm2、1.99mm、14.98cm3、13867.67个(表4)。
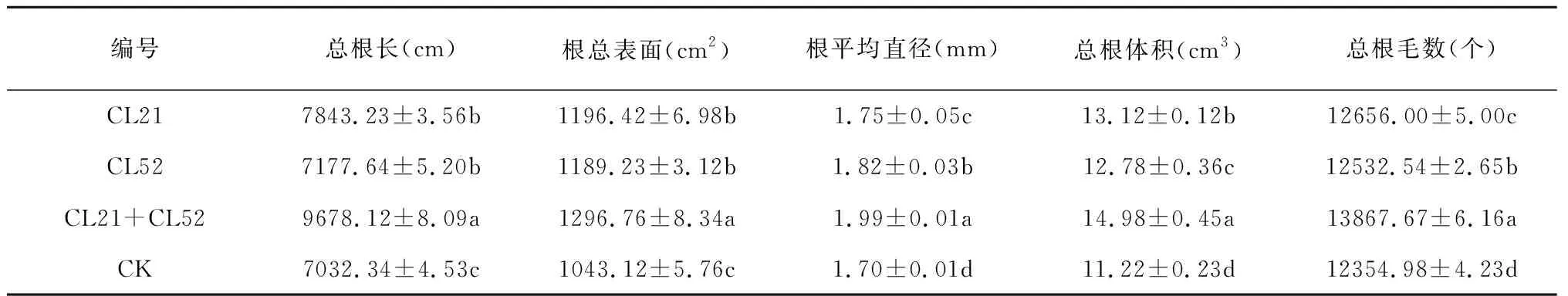
表4 烟草根系形态特征
2.6 促生菌对烟草及土壤中微生物数量的影响
本研究对接种菌剂后烟草的根、茎及其根标土壤、非根际土壤中的微生物数量进行计数分析。结果表明,接种菌剂影响了烟草和土壤中三大微生物的数量分布,接种混菌CL21+CL52对烟草根、茎、叶中细菌数量影响最大,对土壤中细菌的数量影响不明显;接种混菌CL21+CL52后烟草根中放线菌的数量明显高于单菌处理和对照组,而接种单菌CL52对烟草茎中放线菌的数量影响较大,但接种菌剂对烟草叶及其根际和非根际中放线菌数量无明显影响,;烟草根中真菌数量受菌剂CL52的影响较大,茎和叶中真菌数量在接种菌剂后无明显变化,但接种混菌CL52+CL21增加了根际和非际土壤真菌数量(表5)。

表5 促生菌对烟草各部位及其土壤微生物数量的影响
3 讨论
氮、磷、钾是植物生长所必需的营养元素,植物的光合作用和体内的生化过程都必须有它们的参与,植物中全氮、磷、钾的含量可以揭示植物的营养状态,以及吸收利用氮、磷、钾的能力[13-14]。烟草全氮、磷、钾测定结果表明,接种菌剂CL21、CL52、CL21+CL52后显著增加了的烟草中的全氮、磷、钾的含量,其中接种混合菌剂CL21+CL52表现出的效果最佳。烟草根际土与非根际土中碱解氮、速效钾、有效磷和有机质含量测定值表明接种菌剂的各处理均优于对照处理,这可能是促生菌株CL21、CL52分离自植物内部,能很好的在植物体内定殖并通过其生长繁殖、产生次级代谢产物提升烟草活力,增加其对各营养元素的吸收,同时通过刺激根系分泌物的产生增加了根际土和非根际土中氮、磷、钾及有机质的含量。本研究结果表明接种促生菌CL21和CL52能够提高植烟土壤氮、磷、钾、有机质含量以及提升烟草对氮、磷、钾的吸收利用水平,有利改善土壤肥力状况,为烟草的正常生长发育营造良好的土壤环境[15-16]。
接种促生菌剂后烟草植株的株高、最大茎围、最大叶长、最大叶宽、干重、鲜重、气孔导度、胞间CO2浓度和蒸腾速率均增加,根株的总根长、总表面积、平均直径、总根体积、总根毛数较其它处理有显著性差异,说明接种促生菌后能够调节烟草气孔导度,提高胞间CO2浓度、蒸腾速率与净光合速率,促进根系生长,从而提高烟草的生物量。值得注意的是,相较于单株处理绷带,混菌CL21+CL52处理对烟草营养的吸收、烟草生物量以及根际土壤肥力水平的提升更为有效。已有的研究表明,在实际生产应用中,相较于单一菌株,采用多种优势菌株进行混合后接种到植株上,具有更好的接种效益[17],这是因为多种混合菌之间通过协同作用,能完成一些单一菌株无法完成的较为复杂的生理生化反应[18-19]。
此外,烟草及其根际土和非根际土中微生物数量测定的结果显示,接种促生菌CL21、CL52后增加了烟草的根、茎、叶和根际土中细菌数量增加,非根际土的细菌数量减少;烟草的根、茎、叶、根际土和非根际土中放线菌的数量增加;烟草根、茎、根际土和非根际土的真菌增加,烟草叶中真菌数量减少,说明放线菌能够丰富烟草及其根际土中微生物的群落结构,非根际土中的细菌和烟草叶中真菌数量减少的原因可能是放线菌对其应菌群有竞争作用,而根灌的菌株在数量上占有优势从而导致相应环境中细菌和真菌数量的减少,表明接种促生菌后对烟株根际土壤的微生物区系产生了影响,这种变化可对提高烟株根际土壤的生态功能有积极作用[20]。
4 结论
促生菌CL21、CL52通过活化土壤营养元素,提高烟草营养元素吸收水平,促进根系生长、提高烟草光合效率,改变烟草内部及其土壤中微生物群落的方式促进烟草生长,为烟草专用微生物菌剂的研发提供了优良菌株资源。

