胶质母细胞瘤VMAT计划应用头皮保护技术的剂量学比较
胡小洋 李斐顗 倪春霞 陈淑 韩磊 李红伟 上海伽玛医院放疗科 (上海 200235)
内容提要: 目的:对比头皮保护技术对放疗剂量的影响。方法:随机选取10例GBM患者,分别设计常规VMAT计划和头皮保护VMAT计划,处方剂量为60Gy/30Fx。对比两种计划对靶区、危及器官及头皮组织的剂量影响。结果:两种计划的靶区剂量差异不大,常规计划的HI更好,头皮保护计划的CI更好。两种计划的危及器官剂量没有统计学差异。对于头皮组织,头皮保护计划的Dmax、D20cc、D30cc下降约500cGy、400cGy、330cGy,结果具有显著统计学差异。结论:采用头皮保护计划,对靶区及危及器官的剂量没有明显差异,但可明显降低头皮的放疗剂量。
胶质母细胞瘤(Glioblastoma,GBM)是恶性程度最高的原发中枢神经系统肿瘤,目前,针对胶质母细胞瘤的规范化治疗为手术最大限度地切除肿瘤,术后进行放射治疗辅助替莫唑胺(Temozolomide,TMZ)同步化疗、替莫唑胺序贯化疗。放疗是胶质母细胞瘤规范化治疗中重要的一环,可以有效控制肿瘤,提高患者生存期。
近年来,容积旋转调强放疗技术(Volumetric Modulated Arc Therapy,VMAT)已经应用到了胶质母细胞瘤的临床治疗中。放疗中,放射性皮炎、溃疡是常见的并发症[1]。胶质母细胞瘤患者术后放疗,出现放射性皮肤反应还可能导致伤口愈合不良、感染、延误放疗等临床问题。本文通过应用头皮保护VMAT计划,探讨与常规VMAT计划的剂量学差异,头皮保护计划的可行性。
1.资料与方法
1.1 临床资料
随机选择2020年在本院接受放疗的GBM患者10例为观察对象。其中5名男性患者、5名女性患者,平均年龄49岁,均为新诊断的GBM患者。所有患者靶区均设计两种计划,常规VMAT计划和头皮保护VMAT计划。
1.2 方法
所有患者体位均采用仰卧、A型头枕加固定头架,利用热塑网面膜固定。患者体位固定后行定位CT扫描,扫描条件为电压140kV,电流250mA,扫描层厚为2.5mm,扫描范围为颅顶至颅底下2cm。采用GE 1.5T磁共振对患者MRI扫描,扫描体位、层厚、范围尽量与定位时一致,MRI扫描序列为T1、T2、T1增强、DWI、FLAIR。将定位CT影像、MRI影像导入Monaco 5.11 TPS中。
1.2.1 靶区及危及器官勾画
在Monaco TPS中,将患者定位CT与MRI影像融合,便于靶区及危及器官的精确勾画。由高年资医师进行晶体、视神经、垂体、脑干等危及器官勾画。靶区由科主任依照RTOG标准进行勾画,患者放疗分为两个疗程,第一程放疗靶区命名PTV1,剂量46Gy/23Fx,第二程放疗靶区命名PTV2,剂量14Gy/7Fx,总放疗剂量60Gy/30Fx。
并勾画患者表皮下5mm的区域组织定义为头皮组织。
1.2.2 计划设计
所有患者靶区均设计两种计划,常规VMAT计划和头皮保护VMAT计划。计划设计都基于Monaco 5.11 TPS,直线加速器为Elekta Synergy加Agility机头,机头MLC参数为80对共160叶片,每个叶片的等中心宽度为5mm,最大照射野面积40cm×40cm。所有VMAT计划的设置为1Beam 2Arcs,计算网格为2.5mm,采用蒙特卡洛算法,计划的统计学不确定度设置为0.7%,每Arc的最大控制点数为100,最小子野宽度为5mm。计划的临床要求满足处方剂量覆盖95%的靶区。
先设计常规VMAT计划,针对患者的两个疗程靶区PTV1、PTV2将计划命名为VMAT1、VMAT2。计划满足临床剂量要求,危及器官剂量在限值内。再设计头皮保护VMAT计划,在常规计划的基础上,加入头皮作为优化目标限制高剂量,头皮的优化函数设置为最大剂量、5%体积剂量值、10%体积剂量值,对于不同患者调整函数的剂量限值,在计划满足临床要求的基础上,尽可能的限制头皮高剂量。计划的命名为VMAT1-s、VMAT2-s。
1.3 观察指标与判定标准
靶区的评估参数为均匀指数HI(Homogeneity,HI)、适形指数(Conformity,CI)、Dmax、Dmin、D50%、Dmean,依照ICRU 83号报告,HI=(D2%-D98%)/D50%,D2%为最高2%的靶区体积照射的剂量,D98%为覆盖98%的靶区体积照射的剂量,D50%为50%的靶区体积接受的剂量,HI指数越接近0,表示靶区的均匀性越好[2]。CI=V2ref/(VT×Vp),Vref表示处方剂量覆盖的靶区体积,VT表示靶区的总体积,Vp为处方剂量覆盖的全部照射体积。CI指数越接近1,表示照射的适形指数越好。Dmax、Dmin、Dmean表示靶区接受的最大剂量、最小剂量、平均剂量。D50%描述靶区接受的放疗剂量。
危及器官评估最大剂量,即晶体、视神经、垂体、脑干的Dmax。
头皮组织评估最大剂量、平均剂量、20cc接受的剂量、30cc接受的剂量,即Dmax、Dmean、D20cc、D30cc。
对比两种VMAT的计划的机器跳数(MUs)。
1.4 统计学分析
2.结果
2.1 靶区剂量学比较
对第一疗程PTV1的计划,VMAT1、VMAT1-s的结果如表1所示,靶区的Dmax、Dmin、Dmean、D50%数据接近,结果没有统计学差异。头皮保护计划具有更高的靶区适形度,常规计划具有更好的靶区均匀性和更低的机器跳数,均具有统计学差异。
表1. PTV1的两种计划剂量学数据比较(±s)
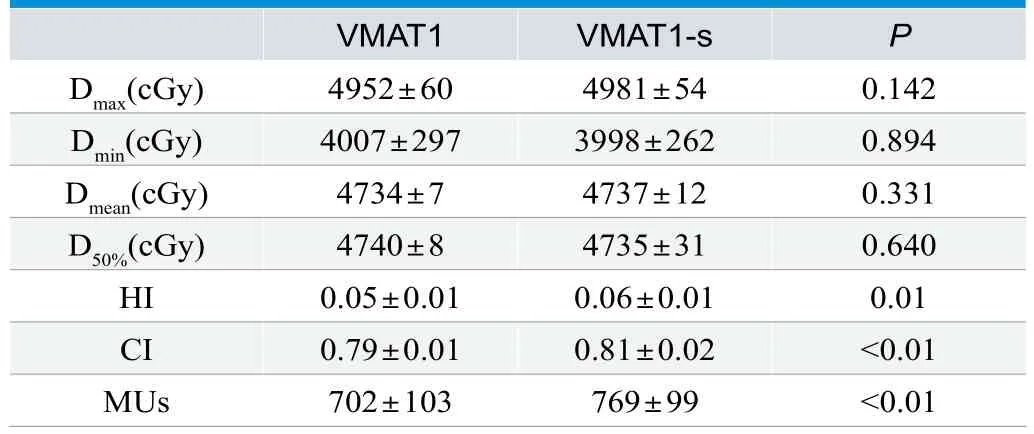
表1. PTV1的两种计划剂量学数据比较(±s)
VMAT1 VMAT1-s P Dmax(cGy) 4952±60 4981±54 0.142 Dmin(cGy) 4007±297 3998±262 0.894 Dmean(cGy) 4734±7 4737±12 0.331 D50%(cGy) 4740±8 4735±31 0.640 HI 0.05±0.01 0.06±0.01 0.01 CI 0.79±0.01 0.81±0.02 <0.01 MUs 702±103 769±99 <0.01
对第二疗程PTV2的计划,VMAT2、VMAT2-s的剂量学差异见表2,结果与PTV1剂量学对比类似,只是VMAT2-s的Dmin相比VMAT2下降约70cGy。
表2. PTV2的两种计划剂量学数据比较(±s)
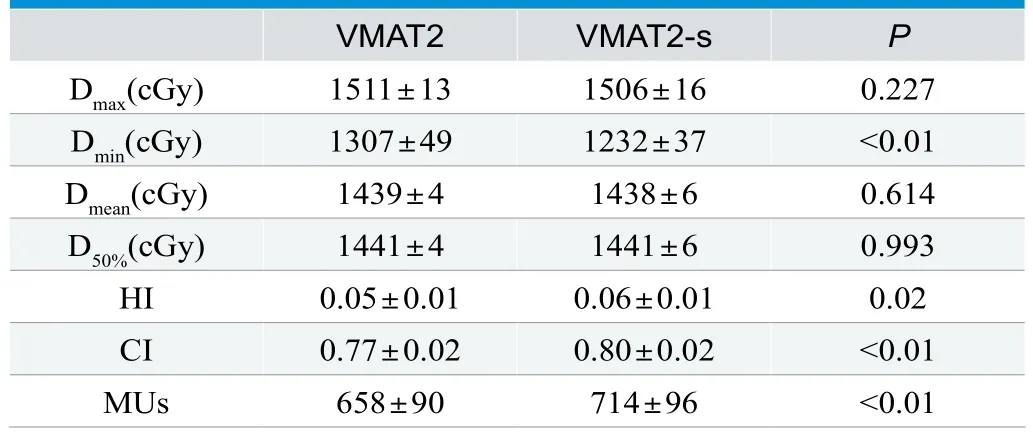
表2. PTV2的两种计划剂量学数据比较(±s)
VMAT2 VMAT2-s P Dmax(cGy) 1511±13 1506±16 0.227 Dmin(cGy) 1307±49 1232±37 <0.01 Dmean(cGy) 1439±4 1438±6 0.614 D50%(cGy) 1441±4 1441±6 0.993 HI 0.05±0.01 0.06±0.01 0.02 CI 0.77±0.02 0.80±0.02 <0.01 MUs 658±90 714±96 <0.01
2.2 危及器官剂量学比较
将两个疗程的计划分别叠加,评估在总剂量60Gy时危及器官的剂量学差异,结果见表3。晶体、视神经、垂体、脑干的Dmax数据接近,结果没有统计学差异。
表3. 危机器官的两种计划剂量学数据比较(±s,cGy)

表3. 危机器官的两种计划剂量学数据比较(±s,cGy)
VMAT VMAT-s P Lens L Dmax 440±123 433±125 0.198 Lens R Dmax 442±121 437±131 0.436 ON L Dmax 2852±1959 2803±2021 0.465 ON R Dmax 2543±1656 2576±1718 0.470 Pituitary Dmax 3568±2353 3507±2366 0.096 BrainStem Dmax 4901±1693 4898±1703 0.896
2.3 头皮组织剂量学比较
在总剂量60Gy时,两种计划的剂量学差异见表4,头皮保护计划的Dmax、D20cc、D30cc、Dmean下降约500cGy、400cGy、330cGy、120cGy,结果具有显著统计学差异。
表4. 头皮组织的两种计划剂量学数据比较(±s,cGy)
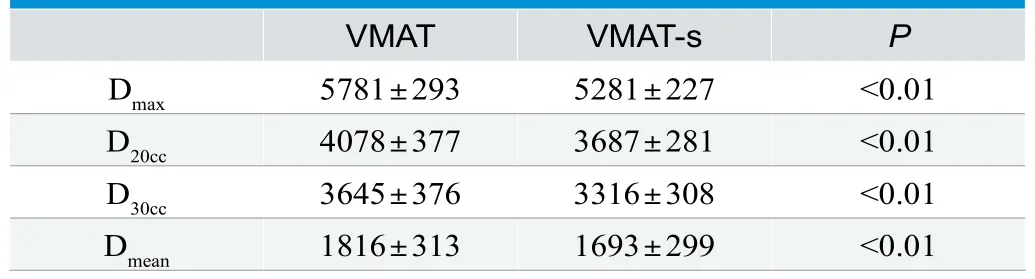
表4. 头皮组织的两种计划剂量学数据比较(±s,cGy)
VMAT VMAT-s P Dmax 5781±293 5281±227 <0.01 D20cc 4078±377 3687±281 <0.01 D30cc 3645±376 3316±308 <0.01 Dmean 1816±313 1693±299 <0.01
见图1,为某一病例的两组计划剂量示意图,剂量分布显示为45~65Gy,蓝色区域为头皮组织,左侧为常规计划,右侧为头皮保护计划。可以看到右侧的头皮组织没有45Gy以上的剂量覆盖。头皮保护计划限制了头皮的高剂量区。
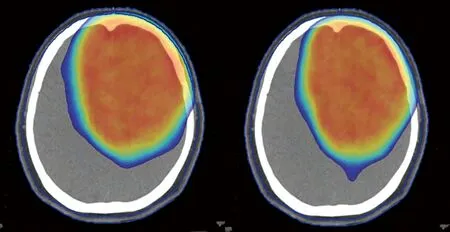
图1. 两组计划剂量分布示意图
3.讨论
放射治疗是胶质母细胞瘤治疗中不可或缺的重要手段,VMAT技术是近年来计算机技术、医学影像技术等与放疗技术结合下发展的新技术。VMAT的特点是在治疗时,机架、多叶准直器连续运动,剂量率连续变化,实现高靶区剂量适形、低危及器官剂量。
放射性皮炎是放疗中最常见的并发症,约47%的患者出现放射性皮肤反应[3]。在胶质母细胞瘤的放疗中,勾画出头皮组织,降低头皮组织的高剂量,可以降低头皮组织发生不良反应的概率。头皮组织的高剂量区就是贴近肿瘤区域的头皮区域,也是术后伤口的所在区域,区域内是高剂量分布,本文是通过头皮保护VMAT计划降低高剂量区,对比常规VMAT计划,靶区的剂量分布,危及器官最大剂量没有明显差异,头皮保护计划有略高的靶区适形度和略低的靶区均匀性。但对于头皮组织,头皮保护计划大幅的降低了头皮组织高剂量区。Dmax、D20cc、D30cc下降约500cGy、400cGy、330cGy。头皮保护计划具有较多的MUs,因在优化时避让头皮具有较多的子野,提高了总MUs。
肿瘤治疗电场是目前治疗胶质母细胞的新手段,它采用中等强度的低频交变电场抑制细胞有丝分裂,它的治疗中,临床不良反应中最常见的是皮肤反应[4]。当肿瘤治疗电场联合放疗时,降低放疗时头皮高剂量区,对降低头皮不良反应发生的概率有积极的临床意义。在本实验中,相比处方剂量,头皮保护计划的头皮高剂量区降低不太明显,后续还需要继续的优化方法,并与临床相结合,达到更好的剂量降低和头皮保护。
本研究中利用VMAT头皮保护技术,对比了与常规计划的剂量学数据,头皮保护计划在靶区与危及器官剂量没有明显差异时,大幅降低了头皮高剂量。对降低头皮不良反应的概率有临床可行性。

