建立一种医疗器械材料体外激活血小板的新方法
杨文润 莫晓彦 杨立峰 许建霞 郑保婷 祝冰倩 南方 潘贤珮
1 广东省医疗器械质量监督检验所 (广东 广州 510080)
2 中国食品药品检定研究院 (北京 102629)
内容提要: 医疗器械材料对血小板的激活与其表面性质、接触面积、接触时间和血小板的浓度等因素有关。首先使用家兔血液分别与不同的医疗器械材料进行接触反应,然后检测医疗器械材料接触血液后其血小板数量和形态学指标的变化,并在显微镜下观察分析血小板的数量和形态以对检测结果作进一步的确认和验证。最后统计分析血小板数量的变化和形态学的变化并且进行关联,从而建立一种医疗器械材料体外激活血小板的新方法,可以更科学、更准确地反映出医疗器械材料激活血小板的情况。
医疗器械材料(以下简称:材料)与血液相互作用后导致的血小板激活是血液相容性评价的重要内容[1-2],血小板计数(PLT)是评价血小板激活的常用方法。血小板计数减少的基本原理是因为血小板粘附在材料表面或者是血小板聚集或者激活发生了不可逆转的形态学改变,有文献和标准[1,3]指出血小板粘附不一定就意味着血小板活化,即粘附在材料表面的血小板不一定会被激活。作者认为血小板粘附在材料表面是正常血小板的一个正常的生理功能,血小板粘附在材料表面的影响因素有很多,除了材料本身还容易受到血液的状态、抗凝剂的使用、试验的条件等因素的影响。因此单一的血小板计数试验存在局限性,不足以科学、准确地评价材料对血小板的影响[3-7]。
一般情况下,血小板被激活后可伸出伪足发生形态学改变,血小板之间可融合成粘性变形的血小板[8,9]。Kunicki和Mitrovic[4,5]等提出了在显微镜下应用血小板形态学计分可以评价血小板的激活程度。临床上平均血小板体积大小(MPV)是血小板功能和活化的标志,在血栓性疾病的病理生理机制中起着重要的作用[6,7];血小板平均体积分布宽度(PDW)是反映血小板体积异质性的参数,它是反应血小板激活状态的敏感指标[9]。大血小板比率(P-LCR)是评价血小板形态的重要参数[10],与血栓性疾病发生有密切关系[11,12]。
1.材料与方法
1.1 一般材料
血液来源:普通级家兔(广东省广州市白云区龙归兴科实验动物养殖场)。
仪器与试剂:全自动血液分析仪XT-2000i(希森美康医用电子(上海)有限公司),徕卡显微镜DM2500(德国徕卡仪器(中国)有限公司),旋转培养器(太仓市实验设备厂),隔水式恒温培养箱(上海森信实验仪器有限公司);3.2%柠檬酸钠抗凝剂(上海源叶生物科技有限公司),10%EDTA-K2抗凝剂(上海源叶生物科技有限公司),一次性使用真空采血管(江苏康健医疗用品有限公司)。
1.2 方法
编号A~G共7组,每组设3个平行管,所有组别材料制备条件一致,取样原则和比例按标准要求进行,制备完成后装入一次性使用真空采血管[12,13]。A组(A1~A5):阴性材料组,长宽高约为(3.2×2.4×1.2)mm的低密度聚乙烯粒料(Low-Density Polyethylene,LDPE),A1~A5表面积:6cm2、12cm2、18cm2、24cm2、36cm2;B组(B1~B5):阳性材料组,直径约2.0mm玻璃珠,B1~B5表面积与A组一致;C组(C1~C2):C1组取0.2g空心纤维膜Ⅰ,C2组取0.4g空心纤维膜Ⅰ;D组(D1~D2):D1组取0.2g空心纤维膜Ⅱ,D2组取0.4g空心纤维膜Ⅱ;E组:取0.4g树脂颗粒Ⅰ;F组:取0.4g树脂颗粒Ⅱ;G组:空白组,不添加任何材料。
选用健康、成年的普通级家兔,使用3.2%柠檬酸钠抗凝剂,按血液与抗凝剂体积9:1的比例进行抗凝,通过心脏采血,置于塑料管中,充分混匀后备用。
实验前每个采血管加入适量生理盐水湿润管壁和材料,然后每个采血管加入2.0mL新鲜抗凝兔血,充分混匀后将所有采血管置于隔水式恒温培养箱的旋转培养器上,在37°C条件下动态接触孵育。孵育结束后向每个采血管加入EDTA-K2抗凝剂40μL以终止血小板的反应,再次混匀分离材料取血液,取血液后涂制成血涂片进行瑞氏染色,最后用全自动血液分析仪测定各管血液中PLT,MPV,PCT,PDW和P-LCR等指标[8,14]。
根据标准中对血小板激活对照材料的要求,阳性材料需与空白对照的PLT百分比(A%)需降低到50%以下、阴性材料需与空白对照的PLT百分比(B%)在80%~100%,实验方法体系方可成立[14]。试验数据采用SPSS19.0进行统计学分析,数据使用±s表示。血涂片使用显微镜在油镜下观察血小板的形态(Microscopic platelet morphology,MPM)。
2.结果
2.1 材料表面积对PLT及P-LCR数值变化的影响
接触血液后A、B两组材料的PLT及P-LCR见图1、图2。B组表面积超过12cm2时,PLT下降数值超过50%,直至形成血栓;P-LCR随着表面积增加数值一直上升,在表面积超过12cm2后趋于稳定。A组数值随表面积增加虽有下降,但总体仍保持在80%以上;P-LCR基本无变化。
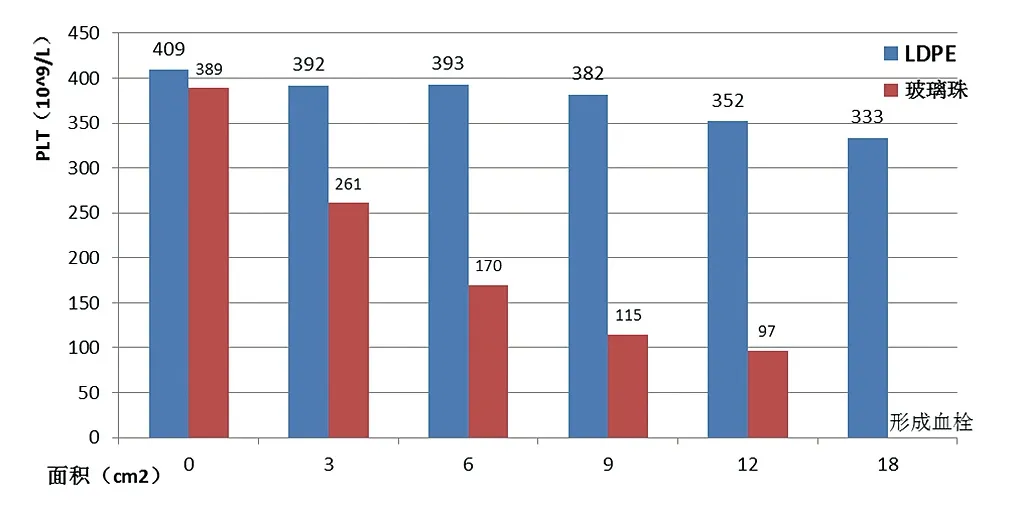
图1. 不同表面积A组和B组的PLT数量变化

图2. 不同表面积A组和B组的P-LCR的比值变化
2.2 接触时间对PLT及P-LCR数值变化的影响
图3中可见A1组、G组各时间点PLT在统计学上无显著性差异(P>0.05),受接触时间的影响较小;B1组则随时间延长PLT一直下降直至形成血栓;图4中可见G组P-LCR无明显波动,A1组与B1组则随时间变化会出现波动,B1组更明显。
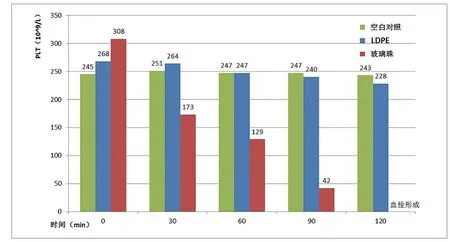
图3. 不同时间下A1组、B1组、G组的PLT数量变化
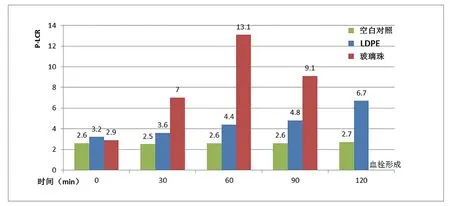
图4. 不同时间下A组、B组、G组的P-LCR的比值变化
2.3 不同浓度PLT接触材料后PLT及P-LCR的变化
表1中可见,当PLT浓度较高(>300)时,B%可以降到50%以下,P-LCR显著升高;A组材料与接触前P-LCR基本保持一致,A%稳定在80%以上。
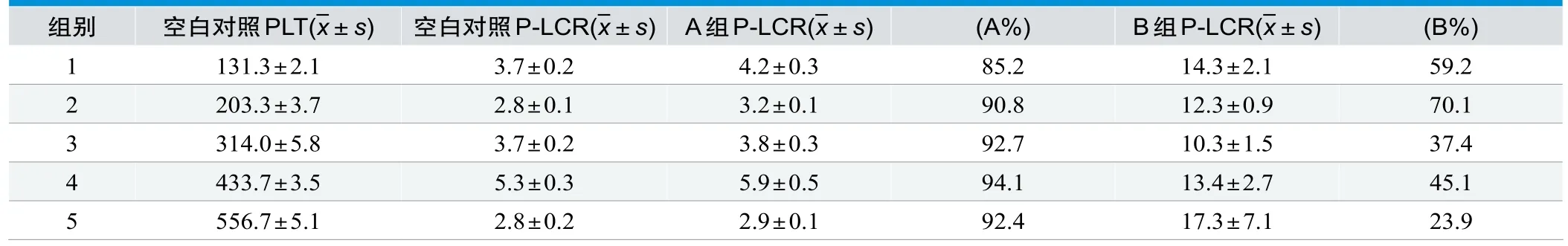
表1. 不同的PLT接触玻璃珠后PLT和P-LCR的变化
2.4 各组材料接触60min后血小板及MPM的变化
表2中PLT相比G组下降一半或以上的组别,P-LCR数值均发生明显变化,以B1、C1、C2上升得最为明显;图5为G组MPM,可见少量血小板聚集状分布,颗粒区染色较深且相对致密;图6为B1组MPM,可见血小板呈椭圆形,常见聚集状分布,树突型血小板伸出伪足彼此间相互聚集呈团簇状分布,相比较于G组血小板体积较大,颗粒区染色浅且疏松。
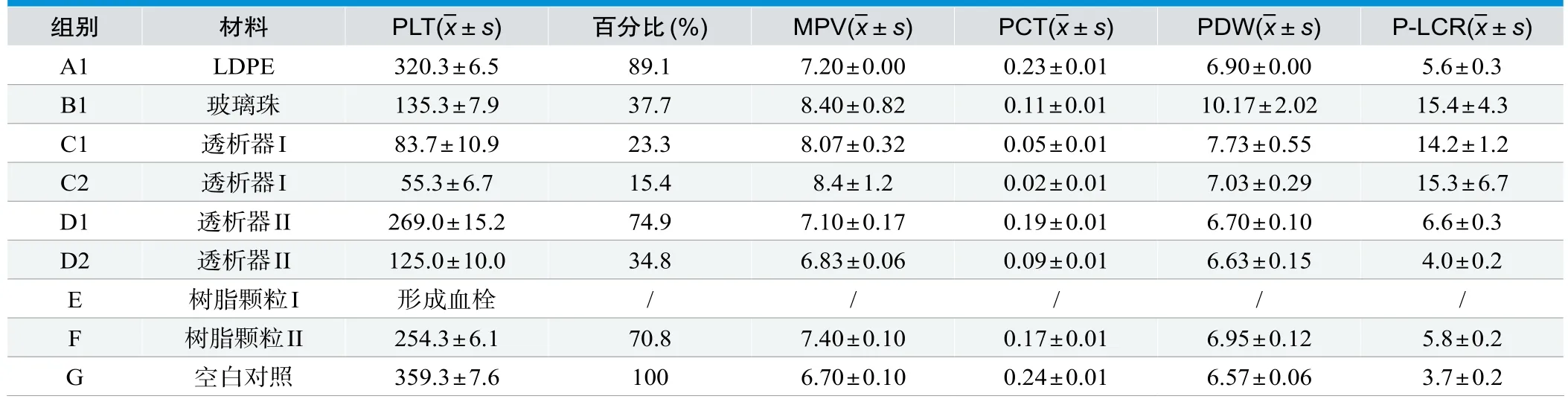
表2. 不同的材料接触血液后血小板指标的变化

图5. G组材料的MPM
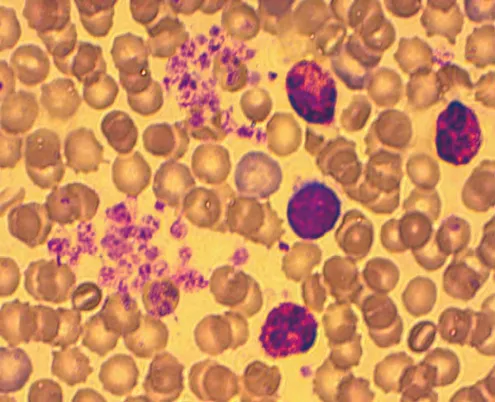
图6. B1组材料的MPM
3.讨论
当材料与血液相互接触后,血液中的血小板可粘附在材料表面,且可激活血小板,使血液向着血栓形成的方向发展[1,2,14,15]。血小板激活可以是材料的表面性质导致[1,2,15],材料表面性质的改变可诱导血小板的激活[16-18]。
图表的统计数据表明,当阳性材料的接触时间或接触面积逐渐增加时,PLT会逐渐降低,达到一定程度时可导致血栓形成的现象。阴性材料P-LCR受接触面积影响较小,阳性材料P-LCR受接影响最大。P-LCR随着接触面积和接触时间分别达到6cm2/mL和60min时,P-LCR可达到相对平稳的高值。加入EDTA-K2后,粘附聚集在材料上的血小板被解聚散开,血液中的PLT随即回升,血小板粘附在材料表面在一定情况下是可逆的,可见血液中PLT降低未必与血小板的激活有关。
图表的统计数据表明,阳性材料随着接触时间或接触面积的增加,血小板有逐渐被激活的趋势,在统计数据上可见MPV、PDW、P-LCR均有不同程度升高。血小板激活达到一定程度后加入EDTA-K2,上述指标仍保持稳定,由此可见血小板被激活后,血小板发生了粘附、聚集到形态学的改变,血小板最终发生了交联纤维蛋白和其它血细胞,此过程血小板粘附解聚不可逆。
目前使用血液分析仪检测血小板数量也存在一定的局限性。例如,材料接触血液后,电阻抗法检测容易导致血小板假性增高;选择的不当的抗凝剂,血小板也容易发生假性聚集,光学法检测也无法消除其影响[15,19,20]。对于MPM,血细胞的形态学分析在临床诊断中具有重要的参考价值,甚至被认为是一些诊断的金标准[8,21]。但MPM也存在制片染色、观察选点及个人主观性等问题。因此本研究检测分析血小板数量和形态学指标的变化,并在显微镜下观察分析血小板的数量和形态以对检测结果作进一步的确认和验证,从而建立一种医疗器械材料体外激活血小板的新方法,可以更科学、更准确地反映出医疗器械材料激活血小板的情况。
目前使用血液分析仪检测血小板数量以评价材料的血液相容性存在一定局限性。如电阻抗法会存在血小板假性增高;当血小板聚集时,光学法也无法消除对血小板计数的影响[15,19,20]。对于MPM,血细胞的形态学分析在临床诊断中具有重要的参考价值,甚至被认为是一些诊断的金标准[8,21]。但MPM亦存在涂制片、选观察点及主观性等问题。因此本研究采用两者联合进行相互验证和补充,使得到的结果更为全面准确。

