前列腺癌雄激素剥夺治疗的新思路
——睾酮最大控制临床研究新进展
卞晓洁,叶定伟
复旦大学附属肿瘤医院泌尿外科,复旦大学上海医学院肿瘤学系,上海200032
前列腺癌是常见的男性恶性肿瘤之一,位居男性恶性肿瘤第二位,仅次于肺癌。其发病率居于所有男性恶性肿瘤首位,甚至达到所有男性新发肿瘤病例的21%[1]。中国男性的前列腺癌发病率低于欧美国家,但随着生活方式、饮食习惯的西化以及人均寿命延长,其发病率也呈现逐年升高的趋势[2-3]。
1 睾酮与前列腺癌发展
雄激素受体(androgen receptor,AR)在前列腺癌的发生、发展过程中扮演着重要角色,抑制AR信号转导通路是前列腺癌治疗的基础[4],如在去势抵抗性前列腺癌(castrationresistant prostate cancer,CRPC)治疗中,使用AR拮抗剂能够竞争性结合AR并阻断内源性雄激素的结合,从而干扰雄激素依赖的细胞下游反应,阻止前列腺癌的进展[5]。最早在1941年Huggins等[6]就观察到睾丸切除术或雌激素治疗可有效地控制转移性前列腺癌,首次提出抑制睾酮(testosterone,T)水平可用于治疗转移性前列腺癌,并在后续研究中证实抑制T水平的雄激素剥夺治疗(androgen deprivation therapy,ADT)可以降低前列腺特异性抗原(prostate-specific antigen,PSA)水平,直接降低死亡风险。
关于血清T水平影响前列腺癌进展的机制目前有多种假说。Morgentaler[7]认为T水平与前列腺癌发病并无直接关系,并在分子基础上提出了“雄激素饱和”的概念,指出靶细胞表面的AR数量有限导致了“饱和”状态的发生,即血清T水平在AR达到饱和后,多余的T不能进入细胞核刺激细胞生长。Salonia等[8]提出了非线性“U”型相关性模型,即血清T水平最高和最低的患者患前列腺癌的风险均有明显增加。Sonnenschein等[9]认为雄激素可能不直接参与前列腺癌细胞的生长,而是通过血浆中的“抑制因子”调节前列腺癌细胞的生长,这种抑制因子可能对前列腺的固有增殖起抑制作用,当雄激素水平正常时,阻断抑制因子的作用后前列腺可进行正常的固有增殖,而前列腺癌发生的一个重要因素就是雄激素对抑制因子阻断作用的缺失。
2 T与前列腺癌患者预后
ADT是目前局部进展和转移性前列腺癌的基础治疗方案,即通过药物或手术方法使患者的T降低到去势水平,减少T对前列腺癌细胞的生长刺激。早期研究与临床上公认的去势水平标准为T<50 ng/dL。随着循证医学证据的累积,研究者们发现T水平在20~50 ng/dL范围内的临床结局较T<20 ng/dL患者差,因此建议将去势水平的标准定义为T<20 ng/dL。目前欧洲泌尿外科协会(European Association of Urology,EAU)已在最新的指南中明确记述控制T<20 ng/dL相较于T水平在20~50 ng/dL的前列腺癌患者可有更多获益[10]。加拿大复发和转移性前列腺癌T抑制治疗共识(2018年版)也将“T<20 ng/dL”作为新的去势标准[11]。T达去势水平后,降低T至更低水平(T<20 ng/dL)可作为判断前列腺癌患者更佳预后和调整治疗的参考标准[12]。Klotz等[13]从机制层面提出三细胞模型用于解释ADT中T<20 ng/dL的意义:T低于20 ng/dL时,治疗期间全面杀死细胞效果更好,同时剩余的肿瘤细胞在治疗间歇期间更易增殖成为雄激素敏感细胞,延长肿瘤发展为去势抵抗的时间(图1)。ADT治疗期间,可能发生T“逃逸”,即T一过性或持续性不能达到去势水平。有研究[14]显示,将T抑制于更低的水平(<20 ng/dL),T逃逸的发生率将显著降低(HR=0.38,P=0.0012)。通过多次规律检测T,发现并更换ADT方式,可以及时纠正T逃逸。
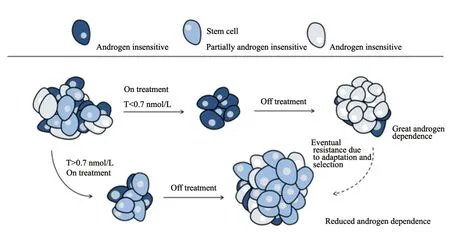
图1 三细胞模型描述维持T低水平在ADT中的意义Fig.1 Three-cell-type model depicting importance of low testosterone in androgen deprivation therapy
在一项纳入了206 例转移性前列腺癌患者的研究[15]中,接受促性腺激素释放激素激动剂(gonadotropin-releasing hormone agonist,Gn R Ha)或A R 拮抗剂治疗后,T<25ng/dL的患者相较于未能控制T<25ng/dL的患者进展至CRPC的时间明显延长(19.1个月vs14.6个月),PSA水平更低(522.8 ng/mLvs861.8 ng/mL);T控制在<20 ng/dL的患者进展至CRPC的时间更长(HR=1.99)。根据大型前瞻性PR-7研究的设定,在持续治疗的第1年,T水平若高于20 ng/dL的目标阈值则预示着治疗失败,需要考虑改变治疗方式或手术治疗;对于局限性或转移性前列腺癌患者,不管是接受睾丸切除还是接受最少4周的GnRHa联合非甾体抗雄激素治疗,在1年观察期时抑制T<20 ng/dL的患者进展至CRPC的风险明显降低[16]。2016年欧洲肿瘤内科学会(European Society for Medical Oncology,ESMO)年会的冰岛研究事后分析中,更低的T水平会延长患者进展至CRPC的时间[17]。一项回顾性研究发现控制T<32 ng/dL的非转移性前列腺癌患者,雄激素非依赖性的无进展生存时间较T水平较高患者的生存时间更长(137个月vs88个月)[18]。
前列腺癌患者接受去势治疗后的第一年应该规律接受每3~6个月的T检测,并视临床情况确定监测PSA水平的时机。患者应在每次促性腺激素释放激素类似物(luteinizing hormone-releasing hormone analogue,LHRHA)治疗前进行T基线水平评估,以确保在治疗间期患者T抑制能够保持达标和稳定。CRPC患者的T基线水平与疾病预后相关,与更高基线T水平的患者相比,中位T水平(2.6~14.5 ng/dL)的CRPC患者无进展生存期(HR=0.51,P=0.014)和总生存期(HR=0.74,P=0.016)更长[19]。在持续治疗第1年时间,若T水平高于20 ng/dL的目标阈值,预示着治疗失败,需要考虑改变治疗方式或手术治疗[16]。在充分抑制T的前提下,PSA的升高预示向CRPC进展,应根据加拿大泌尿外科协会联合加拿大泌尿肿瘤组(Canadian Urological Association-Canadian Uro-Oncology Group,CUA-CUOG)指南进行后续治疗[20]。研究[21]表明T进行性升高可能是GnRHa更换为拮抗剂的指征。
综上所述,T水平降低可显著地改善患者的预后,其中大多数研究以T水平20 ng/dL为界,证实生存率和或特异性生存与T水平相关,且T<20 ng/dL显示显著的促进患者预后的作用。同时,上述部分前瞻研究显示T水平<20 ng/dL亦可有效地延长其进展至CRPC的时间。根据Niraula等[22]研究,目标T水平指导下的ADT能够在尽可能减少用药的同时,达到和维持去势水平,或许可作为前列腺患者管理治疗进度的模式。在任何阈值界定下更低的T水平始终预示着更好的疾病预后,T<20 ng/dL的前列腺癌患者从激素敏感进展至去势抵抗的时间更长、无进展生存率更高。因此将20 ng/dL作为临床T水平控制目标能够更好地指导用药,进而有助于改善患者生存和预后。
3 前列腺癌的内分泌治疗
前列腺癌内分泌治疗药物包括抗雄激素类、雌激素类和GnRHa类药物。比卡鲁胺是目前临床上最常用的AR拮抗剂,与去势治疗联合可以阻断雄激素信号,但对于晚期前列腺癌患者效果欠佳。恩杂鲁胺和阿帕他胺作为第三代AR拮抗剂,在Ⅲ期临床研究中展示了治疗晚期CRPC的良好效果,并在后续临床试验中联合ADT可显著地改善转移性激素敏感性前列腺癌患者的总体生存[23-24],在2020版的EAU指南中作为一线治疗推荐[10]。
GnRH类似物分为GnRHa与GnRH拮抗剂两类,目前临床常用的GnRHa包括亮丙瑞林、戈舍瑞林、曲普瑞林等。目前已有大量循证医学证据证实了GnRHa在治疗局部晚期非转移患者或转移性前列腺癌过程中控制T水平的疗效和安全性。经GnRHa治疗数周后患者体内可出现GnRH受体内化、下调和脱敏,进而抑制黄体生成素和卵泡刺激素的释放,促进T下降至去势水平,达到与手术去势同样的效果;并且因为没有手术去势带来的相关心理问题,具有可灵活调节等优势,已逐渐成为内分泌治疗的最用方法之一。与此同时,GnRHa也作为二线治疗药物用于治疗CRPC。尽管CRPC的细胞存在逃逸机制,对ADT治疗不敏感,但其对抑制雄激素通路的恩扎鲁胺和阿比特龙仍存在反应和疗效[25]。既往研究[26]表明曲普瑞林治疗6个月可使90%的前列腺癌患者T水平维持<20 ng/dL,持续时间达12个月甚至更长。曲普瑞林6个月缓释剂可显著减少患者复诊次数、注射次数和PSA检查次数,治疗1年的就诊成本可降低46.8%[27]。在一项纳入两个前瞻性研究共计1906例前列腺癌患者的meta分析[28]中,亮丙瑞林给药12个月可有效地抑制T水平,并使PSA从12.0 ng/mL降至0.5 ng/mL。一项使用亮丙瑞林3.75 mg的Ⅲ期研究[29]结果显示,治疗4周后96.8%患者达到去势水平,73.1%达到T<20 ng/dL;研究结束时所有患者达到去势水平,并且T<20 ng/dL的比例升高至92.8%。一项前瞻性研究[30]显示,亮丙瑞林给药6个月后94%的患者PSA从11.6 ng/mL降至0.7 ng/mL,其中50%的患者PSA控制在0.1~1.9 ng/mL。纳入多项关键性研究[31]的汇总分析显示,在皮下注射醋酸亮丙瑞林后,T<20 ng/dL、T<10 ng/dL、T<5 ng/dL的达标率分别为99%、97%和91%。在戈舍瑞林、曲普瑞林及亮丙瑞林的对比研究[32]中,当T去势阈值设定为50或20 ng/dL时,三药的去势功效相当。当T去势阈值设定为<10 ng/dL时三组的达标水平有着显著性的差距(P<0.001):戈舍瑞林治疗组为54.2%,曲普瑞林治疗组为93.2%,亮丙瑞林治疗组为86.4%[32]。GnRHa治疗不会导致初治患者由于T水平波动引起的症状加重,并可以迅速达到T去势水平,同时减少心血管事件和代谢综合征等其他不良事件的发生,目前已被用于局部进展或晚期前列腺癌的标准治疗[33]。
GnRH拮抗剂则通过竞争性结合GnRH受体,快速抑制内源性GnRH对垂体的兴奋作用,阻断黄体生成素和卵泡刺激素的分泌。理论上GnRH拮抗剂不激活下丘脑-垂体-性腺轴,可以成为较GnRHa更理想的去势治疗药物,但受限于药物存在溶解度低、易形成凝胶以及具有组胺释放活性等缺陷,其临床开发和应用都较为缓慢,如阿巴瑞克因组胺释放相关的超敏反应发生率高而已经在美国撤市,目前国内获批的GnRH拮抗剂仅有地加瑞克。地加瑞克的Ⅲ期临床试验结果显示80或160 mg的地加瑞克在T抑制方面非劣于亮丙瑞林,尤其在用药后3~14 d的快速抑制方面取得了显著更优的效果[34]。
4 总结
将ADT目标定义为T<20 ng/dL,可改善前列腺癌患者PSA水平、延长进展至CRPC的时间,并提高生存率。目前临床常用的GnRHa均能在大部分前列腺癌患者中将T水平控制在20 ng/dL以下。随着制药工艺改进,更长作用时间的GnRHa缓释剂型推出,将会给患者带来更便捷、更有效的ADT方案,为前列腺癌患者的治疗和管理提供更多的选择。

