硝呋齐特增加乳腺癌细胞对奥拉帕利敏感性的初步研究
侯 净,程纪淦,王 华,魏 娜,倪 青
贵州省人民医院乳腺外科,贵州 贵阳 550002
乳腺癌是女性最常见的恶性肿瘤,世界卫生组织国际癌症研究机构(International Agency for Research on Cancer,IARC)发布的最新数据显示,2020年全球乳腺癌新增病例数达226万[1]。近年来,在根据乳腺癌分子分型进行分类治疗的原则指导下,乳腺癌患者的预后得到显著改善,但某些亚型如三阴性乳腺癌因其自身恶性程度较高且缺乏靶向药物,目前治疗仍较棘手。因三阴性乳腺癌伴有较高比例的BRCA基因突变且存在DNA修复缺陷,因此利用联合致死策略治疗三阴性乳腺癌一直是该领域的研究热点[2]。聚腺苷二磷酸核糖聚合酶[poly (ADP-ribose)polymerase,PARP]抑制剂是第一种成功利用联合致死策略获得批准在临床使用的抗癌药物。目前,PARP抑制剂被美国食品药品管理局(Food and Drug Administration,FDA)批准用于卵巢癌、原发性腹膜癌的治疗[3]。随着乳腺癌两个Ⅲ期临床试验结果的公布,PARP抑制剂奥拉帕利(olaparib)已经被美国FDA批准用于治疗胚系BRCA突变的晚期乳腺癌[4]。另一个PARP抑制剂他拉唑帕尼(talazoparib)也被美国FDA授予优先审评资格[5]。目前有关乳腺癌还有大量的临床试验正在进行中,新的使用方法及新的适应证不断出现,进一步为乳腺癌的治疗增加选择性。然而PARP抑制剂的应用仍存在两个问题:一是目前仅用于伴BRCA突变的患者,能否拓展到其他类型的乳腺癌以使更多的患者获益?二是耐药问题普遍存在。要解决这两个问题,一方面需要对PARP抑制剂的作用机制进行深入研究,另一方面就是筛选能增加PARP抑制剂敏感性的药物。本研究通过筛选能够抑制DNA同源重组(homologous recombination,HR)修复的药物找到硝呋齐特(nifuroxazide),并发现其与PARP抑制剂奥拉帕利有联合增敏效应,报道如下。
1 材料和方法
1.1 细胞培养
乳腺癌细胞系MCF-7、MDA-MB-231,人骨肉瘤细胞系U2OS及HEK-293T培养在DMEM培养基中,向培养基中添加l0%的胎牛血清、1 mmol/L非必需氨基酸、2 mmol/L L-谷氨酰胺、100 U/mL的青霉素、100 mg/mL的链霉素,在37 ℃、CO2体积分数为5%的饱和湿度环境中培养。
1.2 See-Saw系统及药物筛选
See-Saw系统的构建:在绿色荧光蛋白(green fluorescent protein,GFP)基因的3’端克隆引入两个方向相反的I-SceI靶点。I-SceI表达能诱导DNA双链断裂(double-strand break,DSB)。当DNA损伤通过非同源末端连接(nonhomologous end joining,NHEJ)修复时,细胞表达GFP,若损伤通过HR修复时,细胞则表达红色荧光蛋白(red fluorescent protein,RFP)。本研究使用带有See-Saw 2.0报告系统的MCF-7细胞来分析DSB修复的效率。将See-Saw 2.0质粒转染到MCF-7细胞中,用G418筛选2周稳定,然后用表达I-SceI的慢病毒感染细胞,6 h后接种细胞于96孔板中。24 h后,用指定药物处理细胞。36 h后,收集细胞,磷酸盐缓冲液(phosphatebuffered saline,PBS)悬浮后用4%多聚甲醛溶液室温固定20 min,然后进行流式细胞术(flow cytometry,FCM)检测。
1.3 HR与NHEJ报告系统
将HEK-293T细胞铺于24孔板中过夜,将HR报告基因(DR-GFP)或NHEJ报告基因(EJ5-GFP)以及pCBA-I-SceI和mCherry按2∶2∶1转染细胞。6 h后用药物处理,36 h后收集细胞,然后进行FCM检测分析。
1.4 克隆形成实验
将300~500个MCF-7、U2OS细胞接种到6孔板中。24 h后用药物处理,然后培养10~14 d。用4%多聚甲醛溶液室温固定20 min,用0.1%结晶紫室温染色20 min。计数≥50个细胞的克隆数。
1.5 MTS检测
将2000~4000个MCF-7、MDA-MB-231细胞接种到96孔板中。贴壁后用不同浓度药物处理,然后培养72 h。加入MTS,温育2~4 h后检测490 nm处的吸光度(D)值。
1.6 免疫荧光染色
免疫荧光染色用于检测药物处理后γH2AX焦点的形成情况以了解DNA损伤的程度及修复能力。简要步骤如下:在6孔板中爬片过夜,然后用药物处理1、8 h,用4%多聚甲醛溶液固定,室温温育10~20 min;用PBS洗涤3次,每次5 min,0.2%Triton透化处理5~10 min;用含3%牛血清白蛋白的PBS室温封闭1 h;PBS洗涤3次,每次5 min;一抗4 ℃温育过夜,然后用PBS洗涤3次,每次5 min;二抗室温温育1 h,PBS洗涤3次,4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI)核染,封片,在共聚焦显微镜下观察,计数。
1.7 统计学处理
应用Graphpad Prism 8软件对数据进行分析。所有数据均以x±s表示。采用双侧t检验比较实验组之间的差异。P<0.05为差异有统计学意义。
2 结果
2.1 硝呋齐特抑制细胞HR修复
HR修复在DNA双链断裂修复中发挥重要作用,从而维持基因组的稳定性。然而,癌细胞可能通过不同机制上调HR能力并引起治疗耐受。因此,诱导HR修复缺陷(HR deficiency,HRD)是一种可行的克服细胞对DNA损伤药物耐药的策略。为此,本研究利用See-Saw 2.0报告基因系统筛选潜在的能抑制HR的药物。See-Saw 2.0系统是一种研究DNA双链断裂修复途径的新工具,其中RFP阳性细胞和GFP阳性细胞分别代表HR或NHEJ对I-Scel诱导的双链损伤修复。本研究使用TargetMOL(目录编号:L8200)小分子药物库(包含240种药物)处理含有See-Saw 2.0体系的MCF-7细胞。然后检测HR和NHEJ效率。根据标准化RFP与GFP比值,药物被分为两类。RFP与GFP比例小于1表示目标药物能抑制HR,RFP与GFP比值大于等于1的药物表示能促进HR(图1A)。在抑制HR的候选药物中,我们发现硝呋齐特抑制作用显著,因此选择该药物用于后续研究。为进一步验证硝呋齐特能抑制HR,在HEK-293T细胞中采用DR-GFP报告基因检测方法进行验证。硝呋齐特处理细胞后显著抑制HR效率,抑制程度与剂量相关,而对NHEJ无明显影响(图1B)。
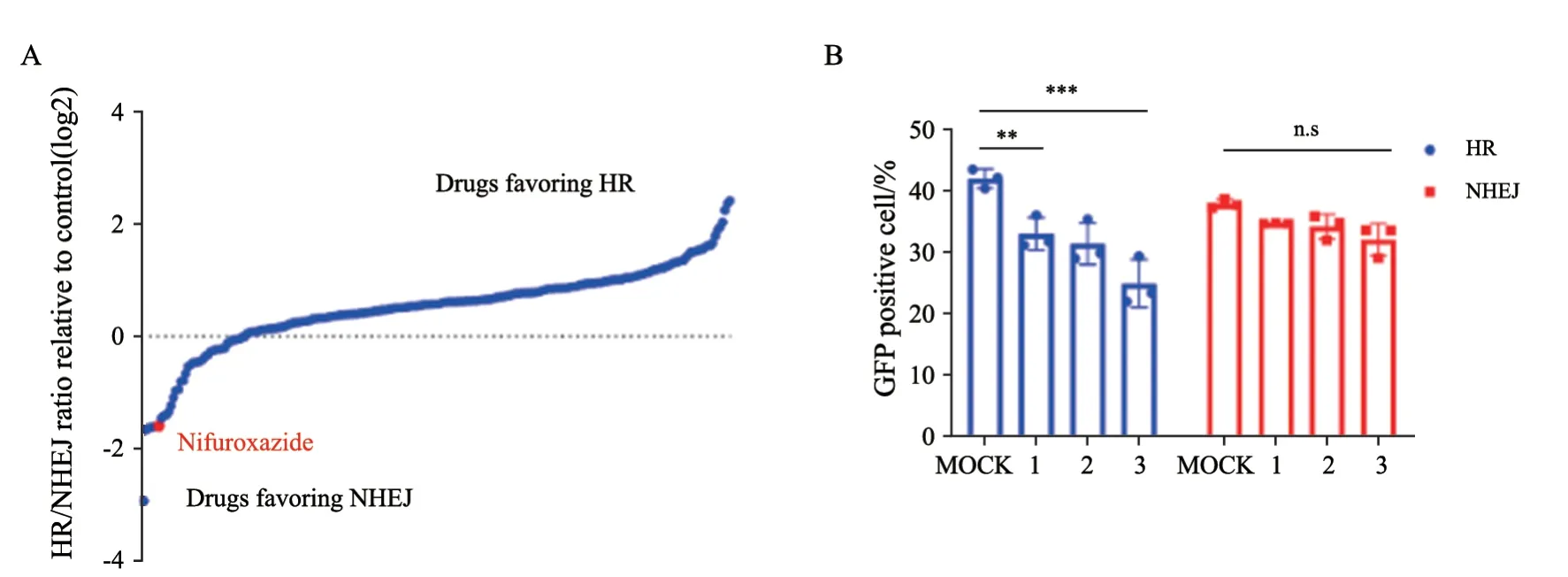
图1 硝呋齐特抑制DNA HR修复Fig.1 Nifuroxazide inhibits HR repair of DNA
2.2 硝呋齐特增加奥拉帕利致DNA损伤程度
因为硝呋齐特能抑制HR,我们推测其能增加PARP抑制剂所造成的DNA损伤程度。为验证这一假设,本研究利用免疫荧光检测硝呋齐特单用或联合PAR P抑制剂奥拉帕利处理细胞后DNA损伤标志物γH2AX(组蛋白H2AX上的第139位丝氨酸发生磷酸化修饰)焦点形成情况,发现单用硝呋齐特处理细胞后无明显γH2AX焦点形成,提示硝呋齐特不会引起DNA双链断裂,单用奥拉帕利后有少量γH2AX焦点形成,8 h后基本修复。而联用后γH2AX焦点形成数目明显增加,且8 h后仍有较多γH2AX焦点(图2),表示硝呋齐特能增加奥拉帕利致DNA损伤程度并降低损伤修复能力。
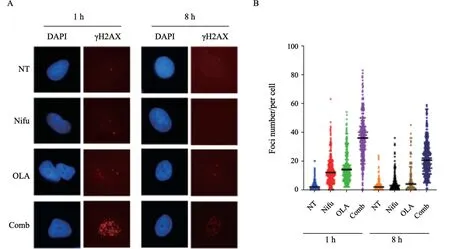
图2 硝呋齐特增加奥拉帕利致DNA损伤程度,延迟损伤修复时间Fig.2 Nifuroxazide increases DNA damage induced by olaparib and delays damage repair
2.3 硝呋齐特增加奥拉帕利治疗敏感性
基于上述结果,我们推测硝呋齐特能增加奥拉帕利治疗敏感性,我们采用MTS方法检测奥拉帕利单用或联合硝呋齐特处理乳腺癌细胞MCF-7、MDA-MB-231后的细胞增殖情况,联用硝呋齐特可增加奥拉帕利对细胞增殖的抑制作用(图3)。此外,克隆形成实验也显示,奥拉帕利和硝呋齐特联用能显著抑制细胞的克隆形成效率(图4)。且该效应在U2OS细胞中也得到证实,表明硝呋齐特对奥拉帕利的增敏作用不限于乳腺癌细胞。
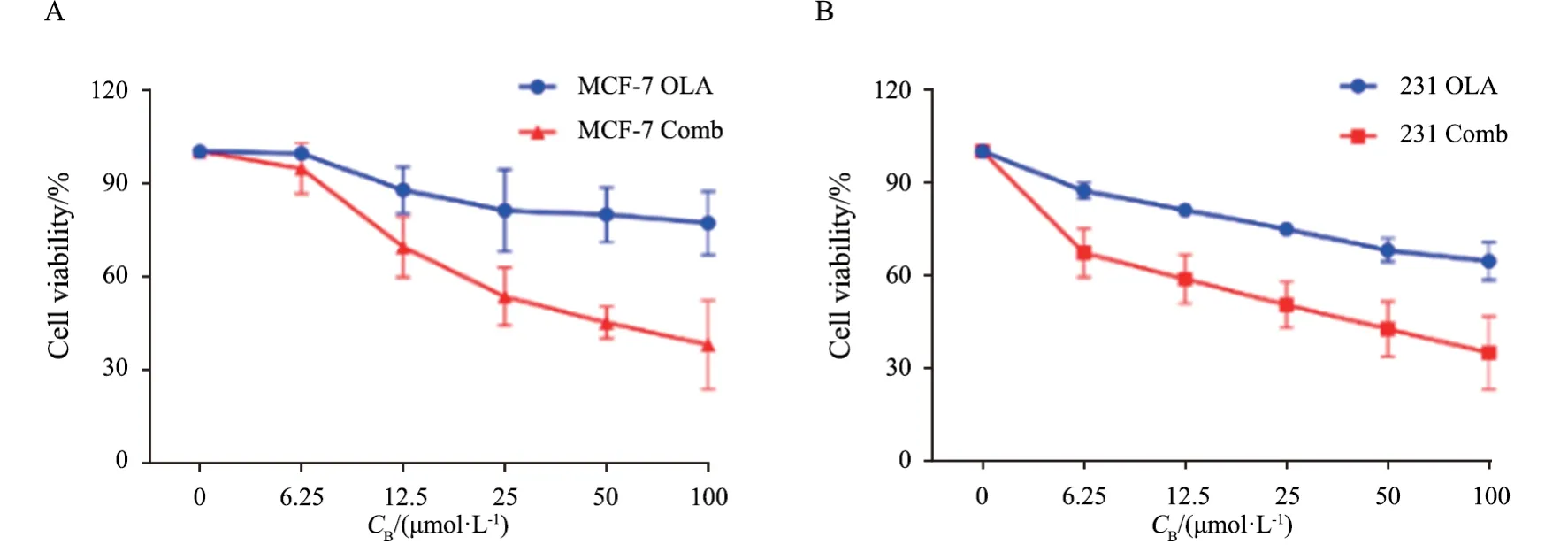
图3 硝呋齐特增加奥拉帕利对乳腺癌细胞增殖抑制作用Fig.3 Nifuroxazide increases the inhibitory effect of olaparib on breast cancer cells
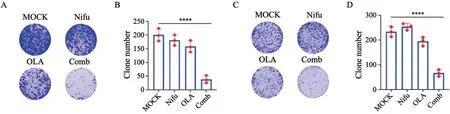
图4 硝呋齐特增加奥拉帕利克隆形成抑制作用Fig.4 Nifuroxazide increases the inhibitory effect olaparib on clone formation
3 讨 论
对于携带BRCA突变的乳腺癌患者,目前主要的治疗方式包括手术治疗和药物治疗,其中药物治疗包括铂类药物及PARP抑制剂治疗。作为一种利用合成致死效应对存在DNA HR修复缺陷的患者具有选择性毒性的靶向药物,PARP抑制剂最初被批准用于卵巢癌的治疗,但其快速发展使乳腺癌患者获益[6]。随着PARP抑制剂奥拉帕利治疗乳腺癌的Ⅲ期临床试验结果[4]的公布,其已经被美国FDA批准用于治疗胚系BRCA突变的晚期乳腺癌患者;另一个PARP抑制剂talazoparib也于2018年获得美国FDA批准用于人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阴性伴有BRCA突变的局部晚期或转移性乳腺癌[5]的治疗。
从药理作用上讲,PARP抑制剂主要针对的是存在DNA HR修复缺陷的肿瘤,研究[7]发现,除BRCA突变造成的HR修复缺陷外,其他参与HR修复的基因如ATM、ATR、PALB2和FANC等亦可发生变异而降低HR修复能力,这一现象被称为“BRCAness”。存在BRCAness的肿瘤对PARP抑制剂也较敏感,这在理论上扩宽了PARP抑制剂的应用范围。因此,这为非BRCA突变的乳腺癌患者应用PARP抑制剂提供了理论依据。一种行之有效的方式为筛选能降低HR修复效率的已知药物,而后与PARP抑制剂联合使用[8]。以此为切入点,本研究使用可诱导双链断裂继而检测DNA修复能力的See-Saw 2.0系统筛选了240种小分子抑制剂,发现约20个药物能在一定程度上抑制乳腺癌细胞HR修复,其中效果比较显著的药物包括硝呋齐特。因硝呋齐特已被临床用于治疗结肠炎和腹泻,且有研究显示,硝呋齐特是一种STAT3抑制剂[9-10]。此外,有研究报道[11-12]靶向STAT3可增加奥拉帕利敏感性,因此本研究选择硝呋齐特进一步研究,结果发现,硝呋齐特能增加奥拉帕利所致的DNA损伤程度并降低DNA的修复能力,细胞增殖及克隆形成实验也显示,硝呋齐特对奥拉帕利有增敏效应。虽然本研究仅为表型上的初步探索,但仍有一定临床意义:首先,硝呋齐特的确能增加奥拉帕利的敏感性;其次,选用的MCF-7细胞及U2OS细胞为BRCA野生型,说明硝呋齐特的作用不受BRCA突变状态的影响;此外,因硝呋齐特已用于临床,这种老药新用的策略为药物开发节省了研究成本。综上,硝呋齐特作为一种奥拉帕利的潜在增敏剂,值得进一步研究探索。

