42例原发性中枢神经系统淋巴瘤患者预后影响因素分析
李盼盼,张 卓
大连医科大学附属第二医院肿瘤放疗科,辽宁 大连 116023
原发性中枢神经系统淋巴瘤(primary central nervous system lymphoma,PCNSL)是一种罕见侵袭型非霍奇金淋巴瘤,占所有非霍奇金淋巴瘤的1%,占原发性颅内肿瘤的3%,病理学类型90%以上为弥漫大B细胞淋巴瘤[1]。近年来发病率不断上升,与脑外淋巴瘤相比预后更差。本研究旨在探讨与原发性中枢神经系统弥漫大B细胞淋巴瘤预后相关的临床及病理学因素。
1 资料和方法
1.1 一般资料
选取自2013年6月—2021年5月在大连医科大学附属第二医院收治的42例PCNSL患者。所有患者均通过立体定向导航脑组织穿刺活检或局部肿瘤切除明确病理学类型为弥漫大B细胞淋巴瘤。均于治疗前行颅脑MRI增强、血清乳酸脱氢酶(lactate dehydrogenase,LDH)、血常规、肝肾功、免疫组织化学检查,部分患者行PET/CT检查。排除其他部位淋巴瘤转移所致的继发性中枢神经系统淋巴瘤。
1.2 疗效评价
疗效评价采用2005年国际原发中枢神经系统淋巴瘤协作组(International PCNSL Collaborative Group,IPCG)提出的PCNSL疗效评估标准,具体评价标准如下:
完全缓解(complete response,CR):MRI强化病灶消失或基本消失;部分缓解(partial response,PR):MRI强化病灶缩小50%;疾病稳定(stable disease,SD):MRI强化病灶无明显变化,无其他新发病灶出现;疾病进展(progressive disease,PD):MRI强化病灶增大25%,或出现新发病灶[2]。
1.3 观察指标
中位无进展生存期(progression-free survival,PFS):定义为疾病确诊时间至第一次发生疾病复发/进展或死亡时间(完全数据)或末次随访的时间(截尾数据);中位总生存期(overall survival,OS):定义为疾病确诊时间至患者死亡(完全数据)或末次随访的时间(截尾数据)。截尾数据为随访截止日期仍健在、失访或死于其他原因的患者。其他观察指标还包括1年和2年的PFS率和OS率。
1.4 随访
通过门诊复查或电话联系的方式,了解患者生存时间及生存状况。随访时间为5~88个月,随访时间截止至2021年5月或患者死亡。至随访终点,42例患者中有23例(54.8%)死亡,其中21例死于肿瘤进展或复发,2例死于其他原因,19例(45.2%)仍存活。
1.5 统计学处理
所有数据采用SPSS 26.0软件进行统计分析,生存分析采用 Kaplan-Meier 法,log-rank检验比较组间差异。COX比例风险回归模型进行多因素生存预后分析。P<0.05为差异有统计学意义。
2 结果
2.1 临床特征
42例患者中位发病年龄为61(13~75)岁。19例患者行腰椎穿刺脑脊液(cerebrospinal fluid,CSF)检查,未发现CSF播散,其中有13例蛋白升高。颅脑增强MRI常为单个或多发肿块,多呈明显强化,周围可见水肿带(图1)。单发病灶15例,多发病灶27例。累及脑组织深部(脑室、小脑、脑干、丘脑、胼胝体、基底节)24例。
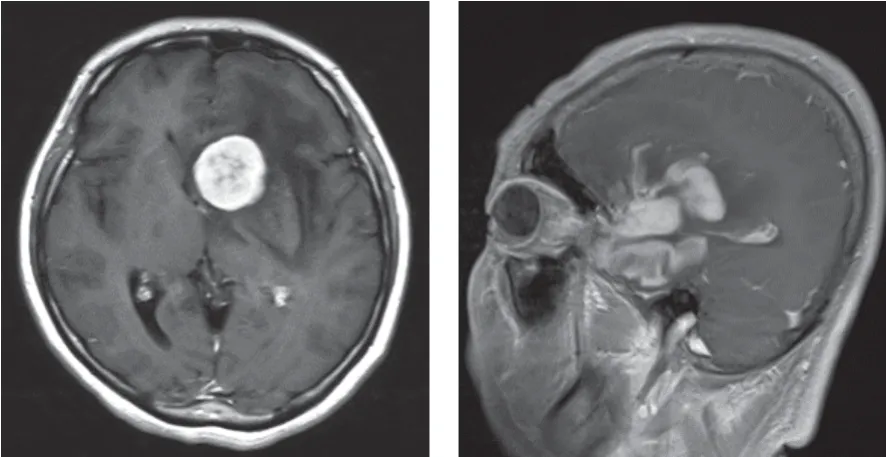
图1 PCNSL患者治疗前颅脑增强MRI图像Fig.1 Brain enhanced MRI images of PCNSL patients before treatment
2.2 免疫组织化学检测
根据病理学Hans分型,非生发中心B细胞型(non-germinal center B-cell-like lymphoma,non-GCB)30例,生发中心B细胞型(germinal center B-cell-like lymphoma,GCB)12例。免疫组织化学法检测CD20、CD10、BCL-6、MUM-1、BCL-2、C-MYC的蛋白水平及Ki-67增殖指数,CD10、BCL-6和MUM-1的阳性临界值定义为30%以上细胞着色,C-MYC的临界值为40%以上,BCL-2的临界值为70%以上,Ki-67增殖指数的临界值为90%以上[3]。
2.3 治疗方式
42例患者均接受含有HD-MTX(≥2 g/m2)方案化疗,联合的药物包括利妥昔单抗(rituximab)、替莫唑胺(temozolomide,TMZ)、阿糖胞苷(cytrarabine,Ara-C)等。11例接受MTX单药化疗,31例接受MTX联合其他药物化疗。其中应用R-M方案(HD-MTX+利妥昔单抗)9例,R-MT方案(HD-MTX+利妥昔单抗+替莫唑胺)9例,MT方案6例,R-MA方案(利妥昔单抗+HD-MTX+阿糖胞苷)5例,MA方案2例。共有23例患者使用了利妥昔单抗,有19例接受了鞘内化疗(MTX 15 mg+阿糖胞苷30 mg+地塞米松5 mg;21 d为1个周期)。化疗后20例(47.6%)获得CR,5例(11.9%)获得PR,11例(26.2%)获得SD,6例(14.3%)获得PD。8例在化疗缓解后采用全脑放疗(whole brain radiation therapy,WBRT),照射技术采用三维适形或调强放疗,全脑剂量DT 36~40 Gy,残留病灶同步加量DT 10~15 Gy。关于WBRT晚期神经毒性,因受到随访时间的限制,仅收集1例WBRT治疗5年后出现言语欠清、记忆力下降。4例采用自体造血干细胞移植(autologous stem cell transplantation,ASCT)治疗。ASCT预处理方案有3例采用BEAM方案(卡莫司汀、依托泊苷、阿糖胞苷、马法兰),1例采用CBV方案(甲氨蝶呤、卡莫司汀、依托泊苷)。移植后不良反应主要为骨髓抑制、发热、腹泻、黏膜炎,其中有1例重症肺炎经治疗后好转。
2.4 生存预后分析
全组患者中位PFS为21个月,中位OS为34个月,1年PFS率为63.7%,2年PFS率为47.0%;1年OS率为70.8%,2年OS率为55.6%(图2、3)。单因素生存分析:影响PFS的因素是:MTX单药/多药化疗、是否应用鞘内化疗、是否联合利妥昔单抗。影响OS的因素包括美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分、C-MYC、BCL-2及C-MYC双表达、MTX单药/多药化疗、是否应用鞘内化疗、是否联合利妥昔单抗(表1)。多因素分析结果显示,利妥昔单抗是影响患者PFS的独立危险因素(表2)。ECOG评分、利妥昔单抗是影响患者OS的独立预后因素(表3)。
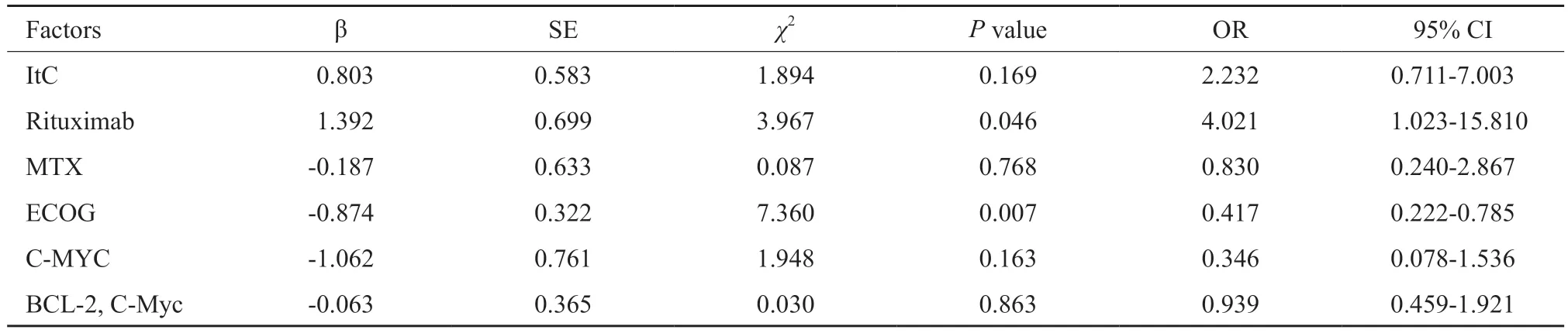
表3 42例PCNSL患者OS多因素分析Tab.3 Multivariate analysis of OS in 42 PCNSL patients
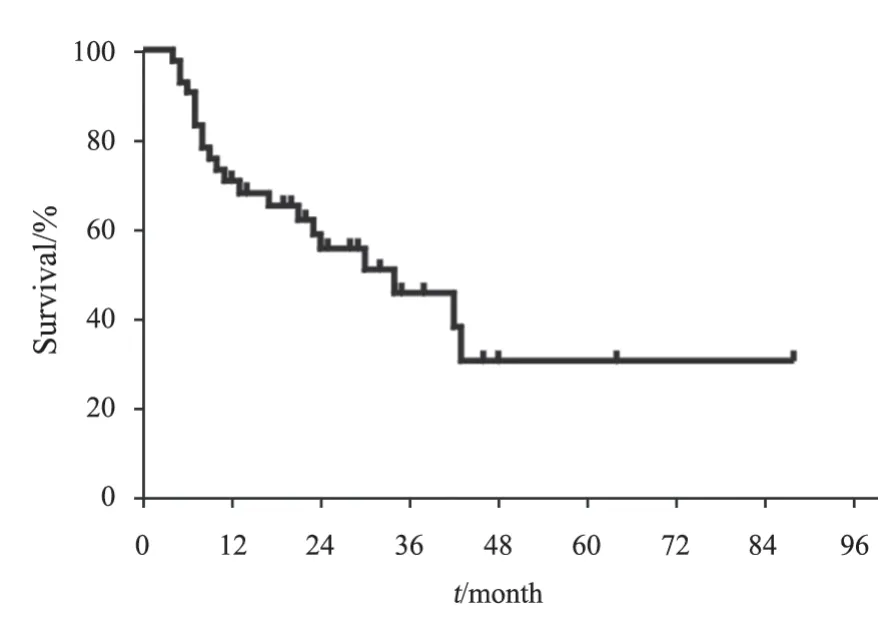
图2 42例PCNSL患者OS生存曲线Fig.2 OS survival curve of 42 PCNSL patients
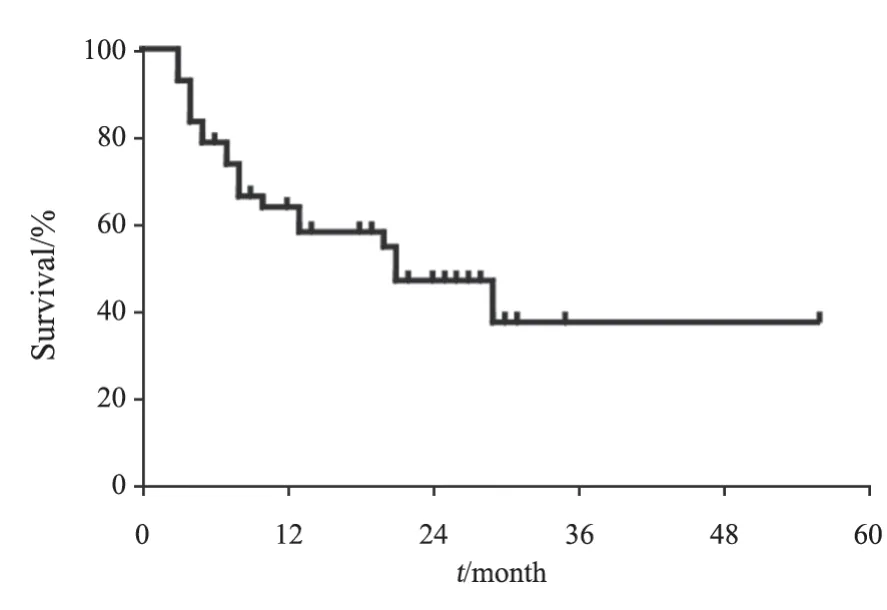
图3 42例PCNSL患者PFS生存曲线Fig.3 PFS survival curve of 42 PCNSL patients
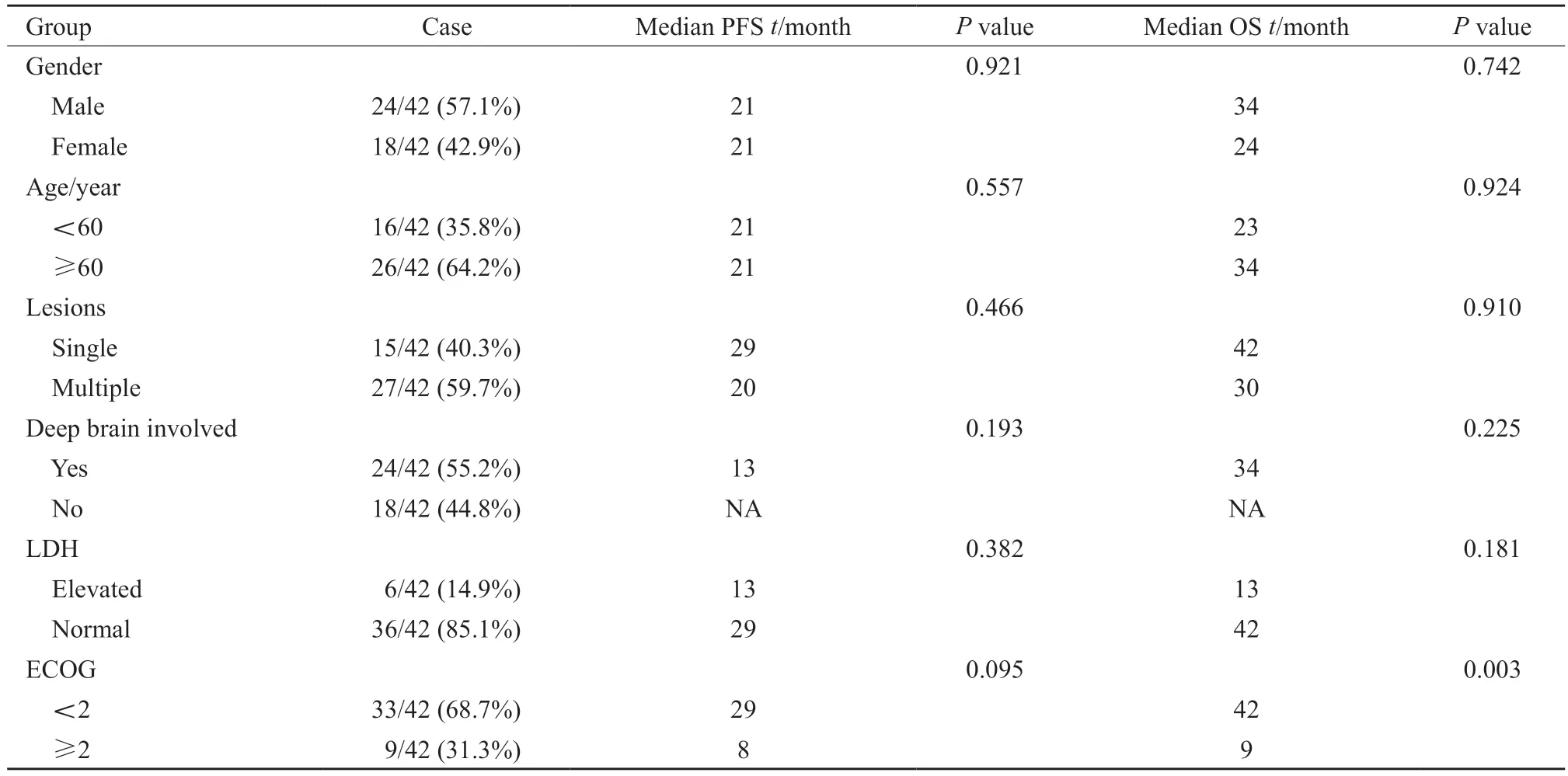
表1 42例PCNSL患者临床特征及单因素分析Tab.1 Clinical characteristics and univariate analysis of 42 PCNSL patients
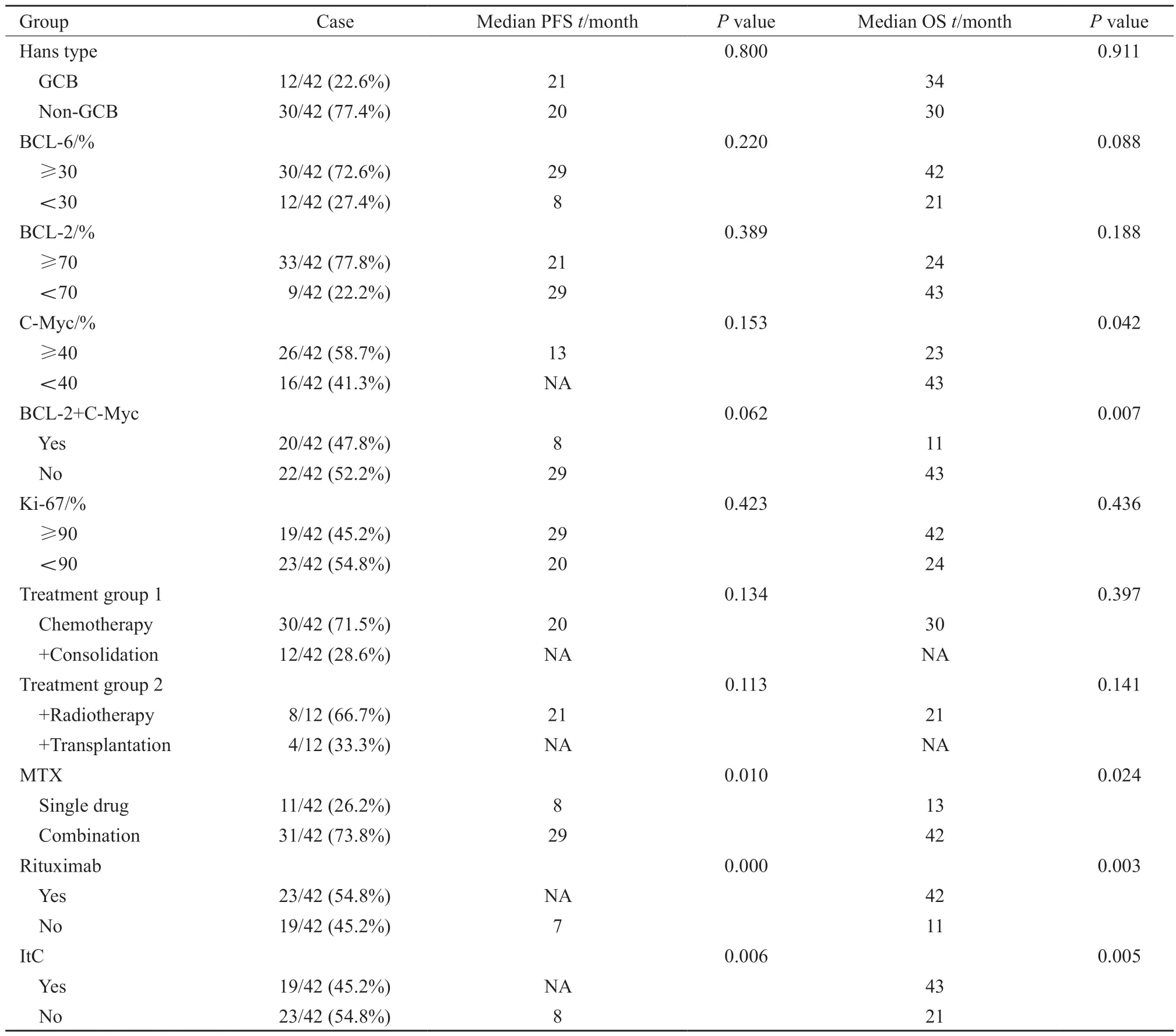
续表 1
3 讨 论
PCNSL可发生于任何年龄段,多发于中老年人,男性多于女性。本组患者中男女比例为1.33∶1.00,中位发病年龄61岁,与既往报道大致相同。PCNSL的具体发病机制尚不明确,人免疫缺陷病毒感染、器官移植后应用免疫抑制剂等引起的免疫缺陷是发生PCNSL的不良因素。
PCNSL的病理学形态可分为GCB型和non-GCB 型,其中non-GCB占大多数,既往报道两型之间预后无差别[4],在本研究中也未发现起源细胞与预后之间的相关性,这与以前的报道一致。
PCNSL绝大多数来源于B淋巴细胞,通常表达成熟B细胞标志物。近年,诸多研究认为系统性弥漫大B细胞淋巴瘤中BCL-2、C-MYC基因变异及相关蛋白表达均与不良预后相关[5]。而在PCNSL中也有相关文献报道BCL-2/C-MYC蛋白表达与PCNSL患者不良预后相关[6-7]。Hatzl等[7]进一步发现,BCL-2和C-MYC蛋白双表达是预测PCNSL不良结局的有效指标。关于 BCL-6是否与预后相关,各文献报道不同,甚至出现相互矛盾的结果。有研究表明,BCL-6表达与较短的PFS相关,而与OS不相关[9]。而Chen等[10]则报道,BCL-6蛋白表达与更长的PFS(P=0.006)和OS(P=0.05)相关。此外,有学者提出,高Ki-67(≥90%)是PCNSL患者不良OS的独立预后因素[11]。本组研究显示,C-MYC(+)、BCL-2和C-MYC双表达与较差的OS(P=0.009)相关,与上述研究部分相符。但BCL-6、BCL-2、Ki-67与预后均无相关性。因本研究是一项回顾性研究,抗体的使用及患者之间的治疗方式并不完全相同,且免疫组织化学表达分级高度依赖于观察者,而定义阳性的最佳免疫组织化学临界值也是一个持续争论的问题。因此,需要进一步的前瞻性研究来确定具有指导PCNSL危险分层的预后标志物,以便制定更合适的治疗方案。
PCNSL目前尚无标准治疗方案,单纯的手术切除肿瘤对于PCNSL患者并没有明显的生存获益,以HD-MTX为基础的联合化疗已经成为首选治疗手段,巩固治疗主要包括WBRT及ASCT。
MTX是治疗PCNSL最有效的药物,能透过血脑屏障。单一MTX化疗的效果有限,缓解率低,要进一步提高疗效,需要联合利妥昔单抗、阿糖胞苷、替莫唑胺等药物[12]。
Schmitt等[13]证实,利妥昔单抗联合以MTX为基础的化疗可改善PCNSL患者的PFS,但并未改善OS。IELSG32随机试验结果显示,在标准MTX及阿糖胞苷基础上加用利妥昔单抗和塞替派,客观缓解率(objective response rate,ORR)提高了34%,2年PFS率提高了25%,2年OS率提高了27%[14]。本研究的生存分析显示,在MTX为基础的化疗中加入利妥昔单抗可以延长患者的PFS及OS,与以往报道部分相符。说明利妥昔单抗在PCNSL患者中的临床应用价值是值得肯定的。
有报道MTX联合阿糖胞苷(MA方案)可显著改善疗效。IELSG20试验中,79例PCNSL患者给予MA方案和单用MTX的CR率分别为46%vs18%(P=0.006);ORR率分别为69%vs40%,(P=0.009)[15]。替莫唑胺可透过血脑屏障,且毒性较小,尤其对于老年患者具有良好的耐受性。Wang等[16]比较MT(MTX+替莫唑胺)和MA化疗方案在41例PCNSL患者中的疗效和毒性,两组的ORR相当。本研究中有15例患者应用替莫唑胺,7例应用阿糖胞苷,均较MTX单药化疗获得更高的PFS及OS,也证明替莫唑胺和阿糖胞苷与MTX联合在PCNSL患者治疗中有较好的疗效。
PCNSL患者脑膜受累很常见,实际临床中预防性鞘内化疗经常与全身化疗联合使用。Taguchi等[17]研究显示,接受预防性鞘内化疗(MTX、阿糖胞苷、甲泼尼龙)的患者与未鞘内预防的患者在2年PFS率及中位OS等方面并没有显示出生存获益。然而,Pels等[18]研究发现,当从最初的化疗方案中省略鞘内化疗时,早期复发率增加,这与相同方案但使用鞘内化疗所获得的结果相反。本组病例单因素分析结果显示,全身化疗基础上加入鞘内注射能有效延长患者的PFS及OS。关于预防性鞘内化疗的疗效及常规应用,仍需进一步研究证实。
WBRT与ASCT是PCNSL两种有效的巩固治疗手段,对于防治复发及延长生存具有重要意义。IELSG32Ⅱ期研究显示,WBRT和ASCT组患者的2年PFS率为80%vs69%,差异无统计学意义。两种巩固疗法的耐受性都很好,但接受ASCT治疗的患者的血液学毒性更常见,尤其对于>70岁的患者[19]。Houillier等[20]研究显示,ASCT组超过一半的患者在治疗后3年内认知功能稳定或改善,而大多数WBRT组的患者的认知功能下降。综上,WBRT和ASCT作为诱导化疗后的巩固治疗都是可行和有效的,但ASCT较少引起患者认知功能障碍,为其优势。实际治疗方案应根据患者的年龄、体能状态、合并症以及对诱导化疗的耐受性等具体情况而选择。本研究中,与未接受巩固治疗的患者相比,接受巩固治疗患者的中位PFS及OS较高,但差异无统计学意义。进一步的亚组分析显示,ASCT组的中位PFS及OS较WBRT组高,但差异无统计学意义。分析得出此结果的原因可能是样本量偏少及随访时间的限制。
国际结外淋巴瘤研究组(International Extranodal Lymphoma Study Group,IELSG)明确了5项与PCNSL预后相关的指标,其中包括年龄(≥60岁),ECOG评分(≥2),血清LDH水平升高,CSF蛋白浓度升高以及是否累及深部脑区(即脑室周围区,基底节,脑干,小脑)。将该预后评分模型分为三个风险组:低风险组(0~1分),中风险组(2~3分),高风险组(4~5分),两年总体存活率分别为80%,48%和15%[21]。由于本研究仅部分患者接受CSF蛋白检测,该预后评分不适用本组病例资料。本研究分析结果显示,ECOG评分≥2与较低的OS相关,而年龄、血清LDH水平、是否累及深部脑区与预后不相关。由于本组病例数较少,可能影响结果而导致与其他研究报告不一致。
尽管近年来,在治疗PCNSL方面取得了重大进展,但PCNSL患者的预后仍然很差,早期诊断和及时采取有效治疗是提高生存期的关键。有关PCNSL的预后标志物,尚需深入研究。目前治疗这种疾病仍然具有挑战性,有待进一步探索。

