多酚复合普鲁兰酶改性藕粉的慢消化特性及结构表征
樊律廷,叶 沁,卢文静,谌 迪,肖朝耿*,孟祥河
(1 浙江工业大学食品科学与工程学院 杭州 310014 2 浙江省农业科学院食品科学研究所 杭州 310021)
淀粉是日常生活所需碳水化合物的主要来源。根据在体外试验中消化的速度和程度,淀粉一般分为三大类:1) 快消化淀粉(rapidly digestible starch,RDS),即前20 min 在口腔和肠道消化中的部分;2) 慢消化淀粉(slowly digestible starch,SDS),20~120 min 在小肠消化的部分;3) 抗性淀粉(resistant starch,RS),不能在小肠中吸收,主要在大肠中发酵[1-2]。近年来,随着糖尿病和肥胖在世界范围的流行,低血糖指数(Glycemic Index,GI)膳食成为防治糖尿病和肥胖的新热点[3]。SDS 和RS 作为功能食品原料被广泛应用于各种面制品中,以降低食物的GI[4-5],而藕粉作为杭州西湖的特产,因低GI 的特点而越来越受到人们的喜爱,然而藕粉的直链淀粉含量高,容易在加工过程中发生回生,从而影响藕粉的商业价值[6]。为了进一步发挥藕粉慢消化性对肥胖人群和高血糖人群友好的优势以及抑制其加工过程中的回生,本文对藕粉进行改性研究。
近年的研究表明,多酚在结构上存在羟基,可与多糖、蛋白质等相互作用,这为多酚改性淀粉提供了可能[7-8]。基于多酚的化学结构,将其分为黄酮类、酚酸类和非黄酮非酚酸类多酚化合物[9]。多酚不仅可作为一种功能性成分进行添加,也可通过与淀粉的相互作用改变淀粉的结构特性来影响淀粉的消化特性和餐后血糖反应[10]。多酚的加入可以抑制淀粉的回生和老化[11-12],改善淀粉的性质,提高其在食品加工中的商业价值。普鲁兰酶是一种脱支酶,作用于α-1,6 糖苷键,可产生更多的游离淀粉链[13]。目前对多酚复合普鲁兰酶改性淀粉的研究还较少。为进一步提高多酚和淀粉的结合效率,本文以藕粉为原材料,选取食品加工中常用的4 种类型的多酚:茶多酚(黄烷醇类)、原花青素(黄烷醇类)、苹果多酚(酚酸类)、白藜芦醇(芪氏)与普鲁兰酶复合改性藕粉,测定改性前、后藕粉的理化性质、结构特性以及SDS 含量的变化,研究多酚复合普鲁兰酶对藕粉慢消化淀粉形成及结构性质的影响,为多酚与普鲁兰酶协同改性淀粉结构,降低淀粉消化速率提供理论依据。
1 材料与方法
1.1 材料与试剂
藕粉,杭州采芝斋食品有限公司;普鲁兰酶,上海源叶生物科技有限公司;茶多酚、白藜芦醇、苹果多酚、原花青素纯度均大于95%,上海麦克林生化科技有限公司;其它试剂均为分析纯。
1.2 主要仪器与设备
VERTEX70 红外光谱仪,德国BRUKER 公司;Hitachi TM3000 扫描电子显微镜,日本日立公司;Bruker D 8 型X-射线衍射仪 (XRD),德国BRUKER 公司;Scientz-18N 冷冻干燥机,宁波新芝冻干设备股份有限公司;ZBRTE-718 恒温振荡器,常州智博瑞仪器。
1.3 试验方法
1.3.1 样品的制备
1.3.1.1 普鲁兰酶改性藕粉样品制备(PLRS) 将2.5 g 藕粉分散到100 mL 柠檬酸缓冲液(pH 4.4)中得到淀粉悬浮液,加入30 颗玻璃珠100 ℃,160 r/min 水浴振荡30 min 后冷却至58 ℃,按12 U/g淀粉添加普鲁兰酶,在58 ℃条件下160 r/min 水浴振荡1 h,酶解结束后沸水浴灭活10 min,冷却至室温后在4 ℃回生48 h,冷冻干燥后将样品研磨过100 目筛,置于干燥器中待用。
1.3.1.2 多酚和普鲁兰酶复合改性藕粉样品制备(多酚-PLRS:茶多酚-PLRS、白藜芦醇-PLRS、原花青素-PLRS、苹果多酚-PLRS) 其它步骤同1.3.1.1 节,在酶解结束后按藕粉质量10%的比例分别添加茶多酚、白藜芦醇、原花青素、苹果多酚至淀粉液,沸水浴160 r/min 振荡30 min,冷却至室温后再回生干燥并收集。
1.3.1.3 多酚改性藕粉样品制备(多酚-LRS:茶多酚-LRS、白藜芦醇-LRS、原花青素-LRS、苹果多酚-LRS) 将2.5 g 藕粉分散到100 mL 蒸馏水中得到淀粉悬浮液,加入30 颗玻璃珠100 ℃,160 r/min 水浴振荡30 min 后按藕粉质量10%的比例分别添加茶多酚、白藜芦醇、原花青素、苹果多酚至淀粉液,沸水浴160 r/min 振荡30 min,冷却至室温,冷冻干燥后将样品研磨过100 目筛,置于干燥器中待用。
1.3.2 红外光谱测定 采用傅里叶红外光谱仪对所制备的藕粉样品进行测定,参照肖遥等[14]的方法:将藕粉样品和溴化钾以1∶300 的比例混合置于玛瑙研钵中,在红外灯下研磨均匀,压片后进行扫描。测定条件:扫描波长范围400~4 000 cm-1,扫描次数32,分辨率4 cm-1。
1.3.3 X-射线衍射测定 所制备的藕粉样品采用X-射线衍射仪进行测定,参照Han 等[15]的研究。测定条件:X-射线发生器管压40 kV,电流40 mA,发射狭缝0.25 nm,铜Kα 射线,扫描角度2θ=5~45°,扫描速度2°/s,扫描方式为连续扫描。数据采用Jade 6 进行处理。
1.3.4 扫描电子显微镜(SEM) 取适量的淀粉样品黏在导电胶带上,对样品进行镀金处理,使用扫描电子显微镜,观察样品的微观形貌。
1.3.5 慢消化淀粉含量测定 采用Englyst 等[16]方法和Miao 等[1]的方法稍作修改,取40 mg 样品加入3 mL 0.2 mol/L 醋酸钠缓冲液于25 mL 锥形瓶中,加5 颗玻璃珠,沸水浴10 min,冷却至室温后,于37 ℃160 r/min 的条件下水浴振荡5 min后加入1 mL 混合酶液(290 U/mL 猪胰α 淀粉酶和15 U/mL 葡萄糖糖苷酶)。在水解20 min 和120 min 时分别取0.1 mL 上清液于离心管中,加0.9 mL 无水乙醇灭酶并 离心 (4 000 r/min,15 min),离心后,采用3,5 二硝基水杨酸(DNS)法测定上清液中的葡萄糖含量,测3 次取平均值。
1.3.6 数据处理 试验数据采用origin 9.0,SPSS 22.0 和Jade 6 软件进行分析,试验结果以“平均值±标准偏差”表示。
2 结果与分析
2.1 多酚对藕粉红外光谱的影响
采用傅里叶红外光谱研究多酚对藕粉分子结构的影响,结果如图所示。
对于淀粉的红外光谱,3 384 cm-1附近的吸收峰和分子间氢键数量呈正相关,1 047 cm-1附近的吸收峰与淀粉颗粒结构中的结晶区密切相关[17],1 022 cm-1附近的吸收峰与淀粉颗粒结构中的非结晶区相关,1 047 cm-1,1 022 cm-1吸收峰强度的比值R1047/1022能够反映淀粉的晶体结构(短程有序结构),比值越大,有序度越高[18],而995 cm-1和1 022 cm-1吸收峰的比值R995/1022反映的是淀粉的螺旋结构[19-20],比值越大,形成的双螺旋结构越多。
如图1、图2所示,与原藕粉相比,多酚作用的过程中没有新峰出现,即没有产生新的化学键,可知多酚和淀粉是通过非共价相互作用(氢键)相结合的。图中3 384 cm-1处的吸收峰强度减弱,主要是由于羟基数的减少,多酚和淀粉链之间形成氢键,这也可能是结晶区较PLRS 显著升高的原因。与结晶区相关的R1047/1022值如表所示,PLRS以及多酚-PLRS 的R1047/1022值较原淀粉显著降低(P<0.05),R1047/1022值的大小排序为原藕粉>PLRS>多酚-PLRS,韩雪琴[10]的研究也表明添加多酚后的复合物的R1047/1022值低于原淀粉。从表中得知,淀粉结晶区在淀粉的脱支再回生过程中显著降低(P<0.05),多酚在此基础上的作用使得结晶度显著升高(P<0.05),原因可能是多酚和淀粉之间氢键的形成。
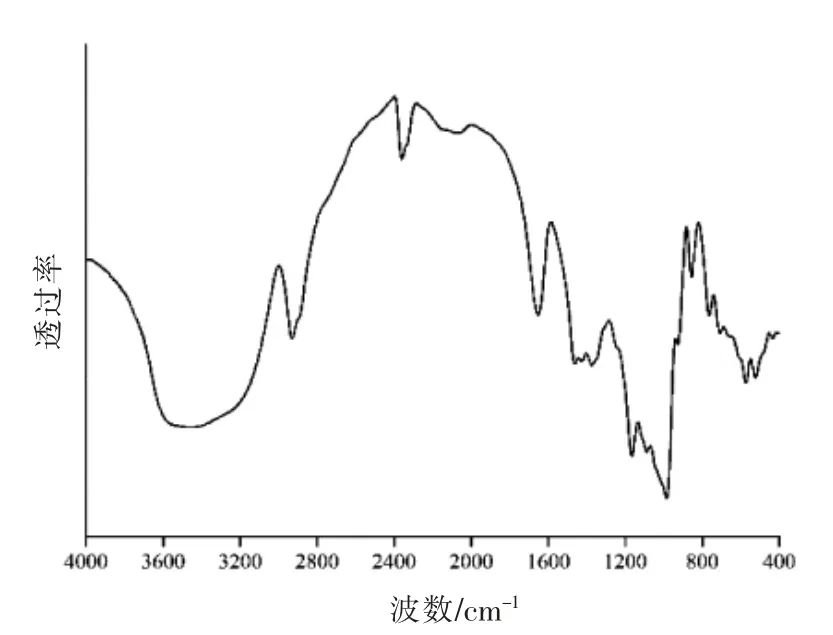
图1 原藕粉红外光谱图Fig.1 FT-IR spectra of native lotus root starch
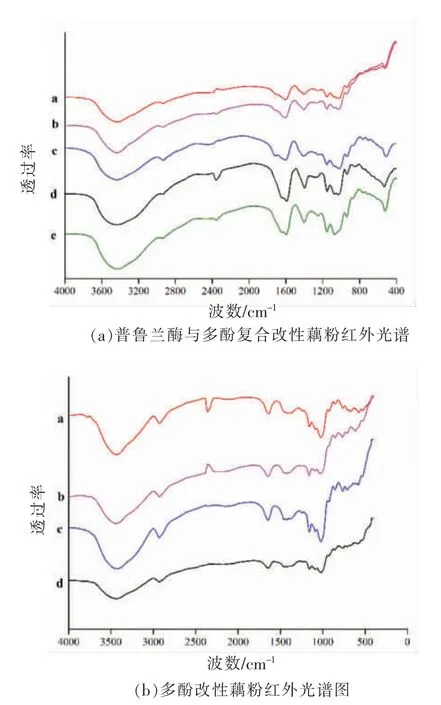
图2 改性藕粉的红外光谱图Fig.2 FT-IR spectra of modified lotus root starch
R995/1022反映的是淀粉的螺旋结构。由表中可知,在普鲁兰酶作用后再回生的样品,淀粉的螺旋结构显著增加,而经原花青素、茶多酚、苹果多酚作用后再回生的样品的螺旋程度相较于仅使用酶作用的样品显著降低(P<0.05),可知这3 种多酚一定程度上阻碍了淀粉回生,抑制了回生过程中螺旋结构的形成。而与白藜芦醇作用后样品的R995/1022值高于其它样品,对回生的抑制作用不明确,这可能是由于白藜芦醇本身不溶于水以至于在水相中难以和淀粉结合[21]。
对比红外光谱图中加酶与不加酶R995/1022值的区别虽不显著,但多酚-LRS 的R995/1022值低于多酚-PLRS,表明酶和多酚复合改性的藕粉形成了更多的双螺旋,脱支酶的加入使多酚和淀粉的结合效率升高。
2.2 多酚对藕粉X 射线衍射图谱的影响

表1 多酚和普鲁兰酶对莲子淀粉分子有序结构R1047/1022 与R995/1022 值的影响Table 1 Effects of polyphenols and pullulanase on the ordered structure of R1047/1022 and R995/1022 values of lotus root starch
为研究莲藕淀粉与多酚复合对莲藕淀粉晶体结构的影响,采用X 射线衍射仪测定莲藕淀粉、多酚与莲藕淀粉的复合物的衍射图谱。淀粉的晶型分为A 型、B 型、C 型和V 型,C 型是A、B型结晶的混合[22-23],配体进入淀粉的螺旋空腔形成V 型结晶[24]。A 型结晶在15°,17°,19°,23°处有衍射峰,B 型结晶在5.6°,17°,22°,24°处有衍射峰,V型结晶的出峰位置为7°,13.1°,20°[25]。
如图2和表2所示,原藕粉在17.0°,23.0°附近有强衍射峰,在15.0°和26.6°附近有较弱的反射强度,表明原藕粉的晶型为A 型,改性后的淀粉衍射峰发生了显著变化,在衍射角22.0°和24.0°附近出现衍射峰,说明藕粉的晶型由A 型转变为C 型,且淀粉原有的特征峰变成了相对平缓的“馒头峰”,表明淀粉的结晶度下降,表2也显示改性后淀粉结晶度显著下降,形成了短程有序结构,而多酚-PLRS 与PLRS 相比结晶度有不同程度的升高,其中原花青素和白藜芦醇较为显著。在2.1 节中提到,多酚可以抑制淀粉的回生,而回生会引起结晶度的升高,但从表2可以看出,多酚作用后结晶度反而升高了,推测这可能是由于多酚和淀粉之间形成的氢键对结晶度的影响大于多酚对回生的抑制作用,因而结晶度整体呈上升趋势,这与2.1 节的结论相符合。而多酚-PLRS 并没有出现V型结晶的衍射峰,表明没有形成V 型结晶,这可能是由于选取的这几种多酚分子质量较大无法进入淀粉的螺旋腔体。
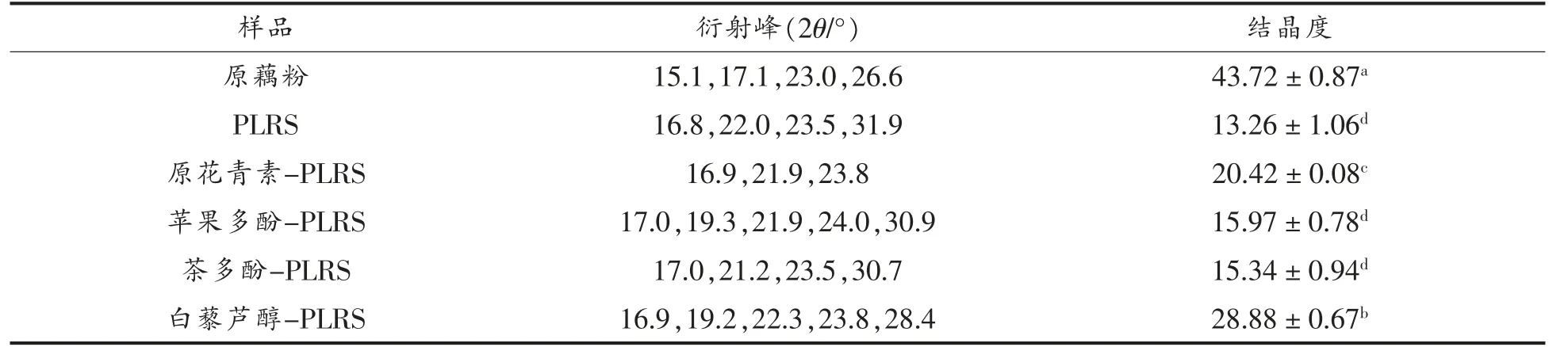
表2 多酚对藕粉结晶度的影响Table 2 Effect of polyphenols on the crystallinity of lotus root starch
2.3 多酚对藕粉微观结构的影响
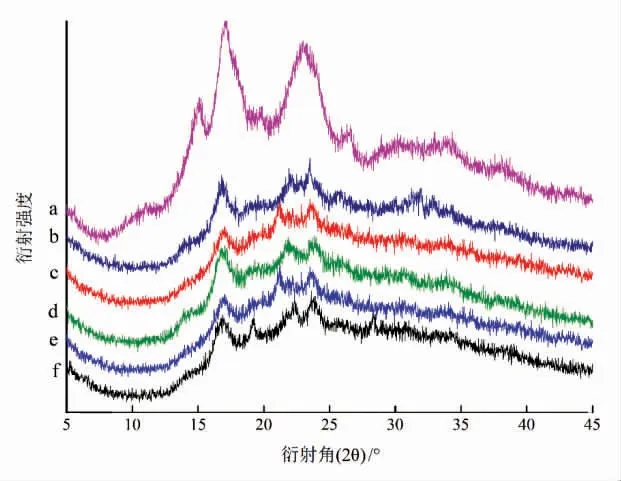
图3 多酚对藕粉X 射线衍射图谱的影响Fig.3 Effect of polyphenols on the XRD spectra of lotus root starch
用扫描电镜观察多酚作用前后淀粉的微观结构,结果如图4所示。未经改性的原藕粉颗粒呈长条状,尺寸较小,大小不一,但表面光滑且完整圆润,较为分散。图4b 为PLRS 的微观形态,可以看出藕粉的原有结构被完全破坏,改性后的藕粉颗粒结构破碎,呈不规律的块状,且颗粒间有聚集情况,大小不均,表面粗糙,存在深浅不一的孔洞。图4c~4f 是多酚-PLRS 的微观结构,苹果多酚-PLRS(c)多呈块状结构,颗粒棱角较尖锐,可以看出颗粒相对于单酶作用的样品表面虽然粗糙程度有所降低,但表面的孔洞更加细密且开始出现裂纹。茶多酚-PLRS (d) 较PLRS 表面粗糙程度进一步升高,出现“疙瘩”状的突起,更加疏松。白藜芦醇-PLRS(e)呈薄厚不均的片层结构,表面有细密的孔洞。而原花青素-PLRS(f)表面较之茶多酚-PLRS、白藜芦醇-PLRS 更为粗糙,孔洞更深,表面分布着细小的碎片。可以看出,改性后的淀粉有不同程度的孔洞出现,可能是糊化后淀粉结构的破坏加上冷冻干燥过程中水分的蒸发形成的疏松多孔的结构[26]。总体来说,多酚复合物中,茶多酚-PLRS 和原花青素-PLRS 表面更为粗糙,可能是由于这两者不同程度阻碍了淀粉回生过程中结构的重组,使其结构更为疏松。而观测到苹果多酚-PLRS、白藜芦醇-PLRS 的表面相较于PLRS 的粗糙程度有所缓和,而在XRD 和红外的结果分析表明这两者对回生也存在抑制作用,推测可能是两者对淀粉回生的抑制作用不明显。

图4 多酚对藕粉微观结构的影响Fig.4 Effect of polyphenols on microstructure of lotus root starch
2.4 多酚对藕粉慢消化特性的影响
如表3所示,对比不同样品的SDS 含量,PLRS 的SDS 含量和原藕粉相比从16.44%增加到18.05%,增加了9.79%。而藕粉经脱支与多酚作用改性后,SDS 含量也有不同程度的增加,这是由于藕粉与多酚的相互作用降低了藕粉的消化性[27-28]。其中,苹果多酚-PLRS、茶多酚-PLRS 和原花青素-PLRS 的SDS 含量和原藕粉相比显著增加(P<0.05),分别增加了18.57%,38.75%和29.92%,而白藜芦醇-PLRS 的SDS 相对于原藕粉没有显著变化。结合2.1 节、2.3 节的结果可以推测,白藜芦醇和淀粉可能没有发生相互作用,而其它3 种淀粉在淀粉脱支后抑制了淀粉的回生,与淀粉链以氢键的形式连接,虽然抑制了重结晶形成更紧密的结构,但是氢键的作用对SDS 的影响更显著,使其整体SDS 含量仍然呈上升趋势。苹果多酚-PLRS、茶多酚-PLRS 和原花青素-PLRS 的SDS 含量和PLRS 相比也有不同程度的升高,分别增加了8.42%,26.37%,18.34%,而白藜芦醇和PLRS相比反而下降,可以得知,苹果多酚、茶多酚和原花青素三者与普鲁兰酶对淀粉的改性有协同作用,其中茶多酚-PLRS 的SDS 含量最高,达到22.81%,原花青素-PLRS 其次,为21.36%,而白藜芦醇与普鲁兰酶则没有协同作用。
表3显示,淀粉在未脱支的情况下直接与多酚进行作用的效果较差,多酚-LRS 的SDS 含量和原藕粉相比均有不同程度的下降。赵蓓蓓[29]研究发现多酚与淀粉的复合物消化率低于原淀粉,与本试验结果不符。本试验中多酚-LRS 的SDS含量的下降可能是由于未经脱支的藕粉与多酚的结合效率低,形成的氢键少,以至于改性中糊化-冷冻干燥的过程对淀粉结构的影响大于藕粉和多酚之间形成氢键的影响,试验结果的不同可能是由于试验原料以及淀粉的结构不同。表格横向比较可以看出,茶多酚-PLRS 和原花青素-PLRS 的SDS 含量远高于茶多酚-LRS 和原花青素-LRS,苹果多酚和白藜芦醇则不显著,推测这两种多酚本身与藕粉的结合度不高,因此受脱支酶的影响较小,而茶多酚-PLRS 与茶多酚-LRS 相比SDS含量增加了36.42%,原花青素-PLRS 与原花青素-LRS 相比增加了53.01%,说明原花青素和普鲁兰酶的协同作用较好。
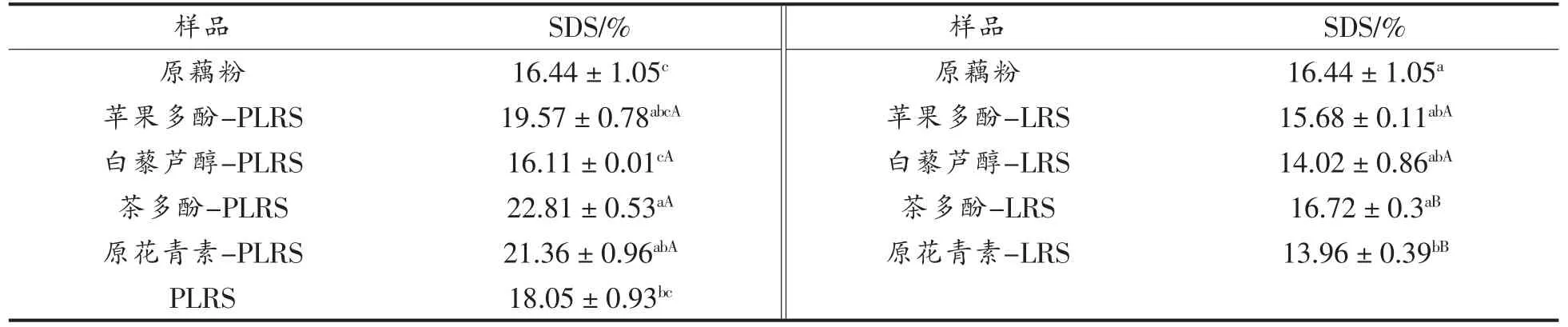
表3 多酚对藕粉SDS 含量的影响Table 3 Effect of polyphenols on the SDS content of lotus root starch
部分多酚在淀粉脱支后和淀粉的作用进一步提高了淀粉的SDS 含量,这些多酚与普鲁兰酶有协同作用,脱支后的淀粉形成了更多的短直链,为多酚与淀粉的结合提供了更多的结合位点,试验选取的几种多酚中,茶多酚与原花青素对淀粉SDS 含量的增益效果相对较好。
3 结论
本文研究发现茶多酚、原花青素、苹果多酚与脱支后的藕粉以氢键的形式相互结合,多酚的加入阻碍了淀粉的回生,不仅改变了藕粉的结构特性,还影响了藕粉的餐后血糖反应,增加了藕粉的SDS 含量,其中茶多酚和原花青素对藕粉SDS 含量的影响相对更显著,而白藜芦醇与藕粉的结合程度较低,红外和XRD 的结果显示,白藜芦醇对藕粉脱支后回生的抑制效果不明显,且藕粉SDS含量没有显著升高,表明白藜芦醇并不适用于淀粉改性。此外,普鲁兰酶和多酚有一定协同作用,脱支后形成的短直链产生更多羟基使其与多酚的结合位点增加,形成了更多的氢键,因而SDS 含量较多酚与藕粉直接作用显著升高。综上所述,茶多酚-PLRS 和原花青素-PLRS 的各方面表现较好,SDS 含量分别达到了22.81%和21.36%,因此在4种多酚中,茶多酚和原花青素比较适合与普鲁兰酶复合用于淀粉改性,为藕粉改性提供了新的参考。

