黄曲霉毒素M1与赭曲霉毒素A对小鼠肠道内微生物菌群结构的影响
杨丽婷 高亚男 杨 雪 刘华伟 王加启 郑 楠*
(1.青岛农业大学食品科学与工程学院,青岛 266109;2.中国农业科学院北京畜牧兽医研究所,北京 100193;3.青岛农业大学动物科技学院,青岛 266109)
霉菌毒素主要是由曲霉菌、青霉菌和镰刀菌产生的一系列有毒性的次级代谢产物,常污染食品、饲料等。根据联合国粮食及农业组织和世界卫生组织的调查,全球约25%的农作物(坚果、谷物、大米等)会受到霉菌毒素的污染,其中黄曲霉毒素(aflatoxins, AFs)是较频繁检出的一类,人或动物摄入后会引起不同程度的毒性作用[1-2]。据统计,黄曲霉毒素B1(aflatoxin B1,AFB1)在所有AFs中毒性最强[3]。牛奶中常检测到黄曲霉毒素M1(aflatoxin M1,AFM1)是因为奶牛所摄入的是受AFs污染的饲料,随后AFB1被机体肝脏微粒体细胞色素P450代谢转化为AFM1而分泌到乳汁中[4-5]。赭曲霉毒素(ochratoxin,OT)是曲霉属中的赭曲霉和青霉属中的纯绿青霉分泌的产物,包含7种结构类似物,OTA是其中之一,它分布最广且毒性最强,常出现在谷物和谷物衍生产品[6]。目前许多研究中已经发现AFM1与OTA在食品、饲料中共存的现象[7-10],这表明人类和动物易同时暴露于AFM1和OTA中,对健康有着直接或者间接的影响。
物理、化学、免疫以及微生物屏障共同组成了生物体内的肠道屏障,是阻碍霉菌毒素以及其他污染物进入机体的第1道防线[11]。微生物屏障指肠道微生物区多样性的相对稳态,肠道中微生物数量可达到宿主体细胞数量的10倍,总体基因组数能达到150倍[12]。研究表明,肠道微生物的多样性以及丰度从十二指肠到结肠末端在逐渐增加[13],专性厌氧菌对维持肠道内环境稳态有着至关重要的作用,如果其稳定性遭到破坏,机体就会产生系列反应,引发肠道疾病[14]。凡纳滨对虾摄入被AFB1污染的饲料后导致虾肠道内菌群结构发生改变[15]。不同浓度的AFB1灌胃小鼠后,其肠道内细菌多样性降低[16-17]。先前研究表明,霉菌毒素OTA的摄入会改变肠道内环境稳态,降低有益菌种罗伊氏乳杆菌(Lactobacillusreuteri)表达丰度[18]。这表明霉菌毒素的摄入会影响到人和动物体内肠道菌群的结构、多样性、丰度等,进而破坏肠道内环境稳态,引发肠道疾病。近年来,霉菌毒素AFM1与OTA联合作用与人们“牛奶+谷物(面包)”的膳食模式息息相关,AFM1与OTA联合摄入对肠道菌群结构的影响尚不清楚,因此研究AFM1与OTA联合处理对小鼠肠道内微生物菌群结构的影响具有重要意义。
16S rRNA测序技术常被用于细菌的鉴定和分类,此技术在霉菌毒素对肠道微生物多样性影响的研究领域应用广泛,例如范彩云等[19]利用16S rRNA测序技术发现AFB1、OTA、玉米赤霉烯酮(ZEN)3种毒素的联合作用都能对肠道微生物丰富度带来不同程度的影响:AFB1+OTA+ZEN>AFB1+OTA>AFB1+ZEN>AFB1。目前国内外研究霉菌毒素对肠道菌群结构的影响多集中于AFB1,对AFM1的研究较少,本实验室前期利用AFB1+AFM1饲喂小鼠研究了其对肠道菌群结构的变化[20],但是单独AFM1与OTA处理对小鼠肠道微生物菌群结构的影响研究报道相对较少,另外也未见报道AFM1与OTA联合处理对肠道微生物区系影响的研究。综上所述,为了解析AFM1与OTA对小鼠肠道内微生物菌群结构(不同水平表达丰度与多样性)的影响,采用AFM1、OTA单独及联合灌胃小鼠的反复攻毒试验,采用16S rRNA对ICR小鼠结肠内容物进行微生物多样性分析,以明确AFM1和OTA单独或联合处理对小鼠肠道微生物菌群结构是否存在差异。
1 材料与方法
1.1 试验材料
AFM1与OTA粉末均购自中国青岛某科技有限公司,纯度>99%,1%二甲基亚砜(DMSO)购自中国国药集团,AFM1与OTA粉末均用1% DMSO溶解,用生理盐水稀释至目标浓度进行灌胃。对所提取的DNA进行PCR扩增:用341F上游引物和806R下游引物对V3~V4可变区进行PCR扩增。
1.2 试验动物
试验选用48只ICR雄性、4周龄SPF级别健康小鼠(购自北京维通利华实验动物技术有限公司)于平台饲养,过程中严格遵循动物饲养管理条例。饲养条件为:常规鼠用生长饲料自由进食、自由饮水,环境温度(22±1) ℃,湿度(50±5)%,光照与黑暗环境每12 h交替1次。
1.3 试验处理及样品采集
小鼠经过1周适应期后,正式进行毒素灌胃试验。试验分为4组,每组12只,共48只ICR小鼠。毒素灌胃剂量是根据实验室前期急性毒性经口试验确定的[20],前期研究使用3.5 mg/kg(半数致死剂量的1/20)AFM1为试验剂量[21-22]。在后期研究中发现,OTA与AFM1具有相似毒性,所以本试验AFM1与OTA最终采用3.5 mg/kg BW作为试验剂量[23]。对照组灌胃1% DMSO溶液,AFM1组灌胃3.5 mg/kg BW AFM1,OTA组灌胃3.5 mg/kg BW OTA,AFM1+OTA组灌胃3.5 mg/kg BW AFM1+3.5 mg/kg BW OTA,每只小鼠的灌胃体积均为200 μL,灌胃周期为35 d。第35天灌胃结束后采用颈椎脱臼法处死小鼠,立即收集12只小鼠结肠段于液氮中速冻10 min,接着放入-80 ℃冰箱中保存。
1.4 结肠内容物细菌多样性检测
采用16S rRNA测序技术对结肠内容物细菌多样性进行检测。根据结肠内容物基因组DNA试剂盒HiPure Stool DNA Kits(中国上海信裕生物技术有限公司)提取样品中的总DNA,过程参照试剂盒说明书进行操作。DNA浓度和纯度的检测采用NanoDrop1000仪检测,A260/A280比值在1.8~2.0表示DNA质量检测合格。随后采用1.0%琼脂糖凝胶电泳检测DNA完整性。对提取的DNA进行PCR扩增。用上游引物序列:3′-CCTACGGGNGGCWGCAG-5′;下游引物序列:3′-GGACTACHVGGGTATCTAAT-5′对V3~V4可变区进行PCR扩增。扩增程序:预变性(95 ℃,3 min)、变性(95 ℃,30 s)、退火(55 ℃,30 s)、延伸(72 ℃,30 s),27个循环后再72 ℃延伸10 min。扩增体系为20 μL:4 μL 5×FastPfu缓冲液,2 μL 2.5 mmol/L dNTPs,0.8 μL引物(5 μmol/L),0.4 μL FastPfu聚合酶,10 ng DNA模板,ddH2O 补充至20 μL。按照Novaseq 6000系统的PE250平台模式(中国广州基迪奥生物科技有限公司)进行测序。对低质量Reads进行过滤,然后将双端Reads拼接为Tag,再对Tag进行低质量过滤,得到Clean Tag。接下来基于Clean Tag,使用Usearch软件进行聚类,去除聚类过程中检测到的嵌合体Tag,获得操作分类单元(OTU)的丰度和OTU代表序列。将具有高度相似性(97%)的序列归为1个OTU,对获得的有效Tag序列进行聚类,从而对小鼠结肠内容物OTU进行比较分析。运用BLAST比对程序在RDP数据库进行物种分类学分析,估算出样品6个α多样性值。
1.5 数据处理
利用单因素方差分析对各组细菌群落组成进行差异性分析。利用多组组间差异性检验(Welch’st-test检验)的方法筛选属水平下不同试验组的差异菌。物种丰度图和物种堆叠图用的是R包的GGPLOT2绘制,P<0.05代表显著差异,结果表示为平均值±标准差。
2 结果与分析
2.1 AFM1与OTA对小鼠体重的影响
小鼠在适应期结束后1 d开始对小鼠进行体重称量,体重变化如表1所示。从表1中可以看出,与对照组相比,初始体重在AFM1组与OTA组中均无显著性差异(P>0.05)。AFM1组和AFM1+OTA组中小鼠体重显著下降出现在霉菌毒素处理7 d之后(P<0.05)。灌胃21 d后,相比于对照组,AFM1组、OTA组、AFM1+OTA组小鼠体重均显著降低(P<0.05)。灌胃35 d时,AFM1组、OTA组、AFM1+OTA组小鼠体重均显著低于对照组(P<0.05)。
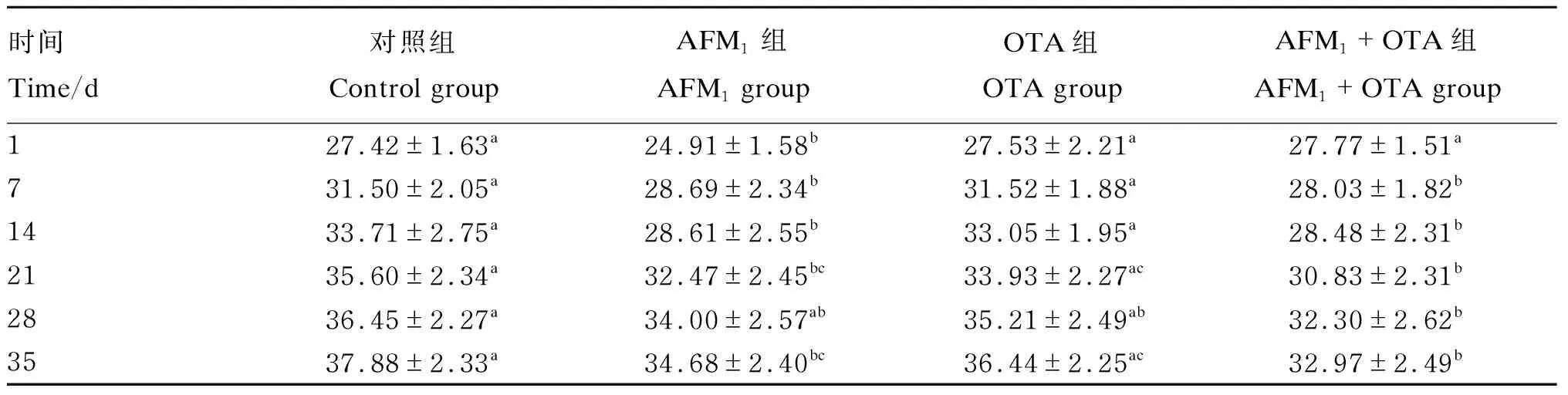
表1 AFM1和OTA对小鼠体重的影响Table 1 Effects of AFM1 and OTA on body weight of mice (n=12) g
2.2 各组间小鼠肠道内容物OTU比较分析
由图1所示,与对照组相比,AFM1组中有1 032个共有OTU,特有532个OTU;OTA组中有1 095个共有OTU,特有669个OTU;AFM1+OTA组中有1 065个共有OTU,特有967个OTU。这表明AFM1+OTA组比AFM1组、OTA组小鼠肠道微生物变化更加显著。
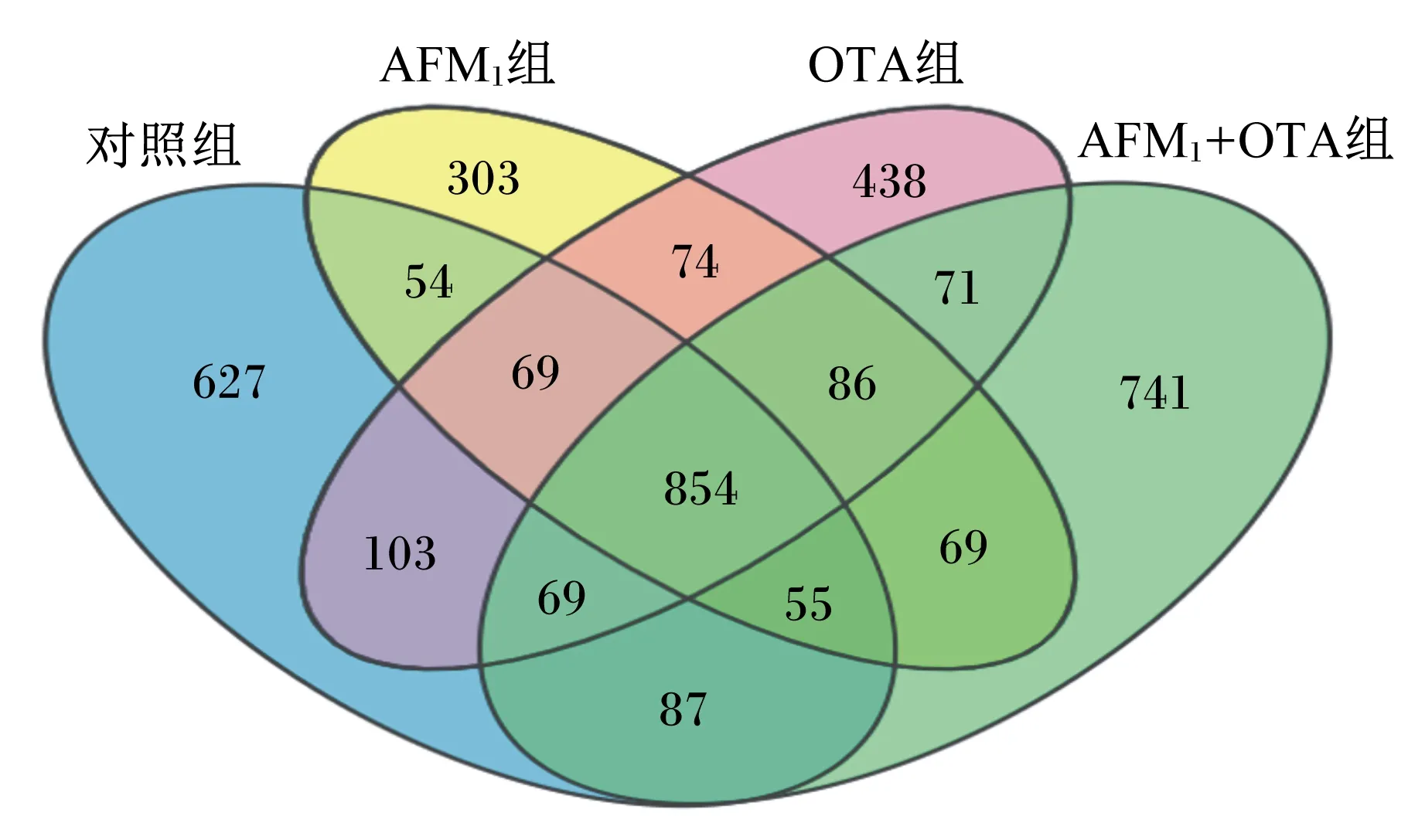
图1 对照组及试验组OTU韦恩图Fig.1 Venn analysis of OTU in control group and experimental groups
2.3 各组间小鼠结肠内容物α多样性分析
由表2可知,AFM1组、OTA组、AFM1+OTA组之间Chao1指数和Ace指数存在显著性差异(P<0.05),但是OTA组与AFM1+OTA组之间无显著性差异(P>0.05),这表明与对照组相比,小鼠肠道菌群的丰富度和多样性在霉菌毒素处理之后都发生了变化。

表2 霉菌毒素处理对小鼠结肠内容物α多样性指数的影响Table 2 Effects of mycotoxin treatment on α diversity indexes of colonic contents in mice (n=12)
2.4 各组间小鼠结肠内容物菌群结构组成分析
由图2可知,在门水平上,AFM1组、OTA组、AFM1+OTA组与对照组小鼠结肠内容物菌群结构组成无显著差异(P>0.05),小鼠肠道细菌群落90%以上为优势菌群,分别为厚壁菌门、拟杆菌门、变形菌门、蓝细菌门和疣微菌门。与对照组相比,AFM1组、OTA组、AFM1+OTA组中的厚壁菌门相对丰度降低,所占比例从50.58%(对照组)下降到36.87%(AFM1组)、45.93%(OTA组)及39.67%(AFM1+OTA组);而拟杆菌门相对丰度增加,所占比例从23.81%(对照组)上升到41.98%(AFM1组)、29.23%(OTA组)及31.05%(AFM1+OTA组);变形菌门相对丰度略有上升,所占比例从7.89%(对照组)上升到9.09%(AFM1组)、9.79%(OTA组)及11.36%(AFM1+OTA组)。相比于对照组,AFM1组和OTA组中有2种细菌相对丰度降低,分别是蓝细菌门和疣微菌门,而在AFM1+OTA组中这2种细菌相对丰度升高。为进一步探究,采用霉菌毒素处理后影响肠道菌群的前20个门水平上的相对丰度来制作门水平物种丰度图,得到图3。从图中可以看出,变形菌门在AFM1组、OTA组、AFM1+OTA组中相对丰度增加,而厚壁菌门在AFM1组、OTA组、AFM1+OTA组中相对丰度降低。

Unclassified:未分类的;Other:其他;Chloroflexi:绿屈挠菌门;Patescibacteria:髌骨细菌门;Planctomycetes:浮霉菌门;Deferribacteres: 脱铁杆菌门;Actinobacteria:放线菌门;Verrucomicrobia:疣微菌门;Cyanobacteria:蓝细菌门;Proteobacteria:变形菌门;Bacteroidetes:拟杆菌门;Firmicutes:厚壁菌门。图2 各组小鼠肠道细菌门水平相对丰度Fig.2 Relative abundance of intestinal bacteria of mice at phylum level in each group

Bacteroidetes:拟杆菌门;Patescibacteria:髌骨细菌门;Tenericutes:软壁菌门;Proteobacteria:变形菌门;Gemmatimonadetes:芽单胞菌门;Cyanobacteria:蓝细菌门;Verrucomicrobia:疣微菌门;Kiritimatiellaeota:赤铁矿菌门;Actinobacteria:放线菌门;Planctomycetes:浮霉菌门;Chlamydiae:衣原体;Firmicutes:厚壁菌门;Chloroflexi:绿屈挠菌门;Deferribacteres:脱铁杆菌门;Acidobacteria:酸杆菌门;Spirochaetes:螺旋体门;Deinococcus-Thermus:异常球菌-栖热菌门;Fibrobacteres:纤维杆菌门;Fusobacteria:梭杆菌门图3 各组小鼠肠道细菌门水平丰度图Fig.3 Abundance map of intestinal bacteria of mice at phylum level in each group
在科水平上,AFM1组、OTA组、AFM1+OTA组与对照组小鼠结肠内容物菌群结构组成也无较大差异,由图4可知,与对照组相比,Muribaculaceae在AFM1组、OTA组、AFM1+OTA组中相对丰度均增加,AFM1组显示相对丰度最高(33.09%),高于OTA组(21.88%)和AFM1+OTA组(21.79%),而乳杆菌科和普雷沃氏菌科相对丰度在AFM1组、OTA组、AFM1+OTA组中均降低。毛螺旋菌科相对丰度占比无明显变化。疣微菌科相对丰度在对照组、AFM1组、OTA组、AFM1+OTA组中变化不一致,前2组中相对丰度无变化,后2组中相对丰度增加。为进一步探究,采用霉菌毒素处理后影响肠道菌群的前20个科水平上的相对丰度来制作门水平物种丰度图,得到图5。从图中可以看出,AFM1+OTA组中相对丰度增加的细菌分别是疣微菌科和肠杆菌科。

Unclassified:未分类的;Other:其他;Bacteroidaceae:拟杆菌科;Enterobacteriaceae:肠杆菌科;Rikenellaceae:理研菌科;Rhizobiaceae:根瘤菌科;Akkermansiaceae:艾克曼菌科;Prevotellaceae:普雷沃菌科;Lactobacillaceae:乳杆菌科;Ruminococcaceae:瘤胃菌科;Lachnospiraceae:毛螺旋菌科。图4 各组小鼠肠道细菌科水平相对丰度Fig.4 Relative abundance of intestinal bacteria of mice at famliy level in each group

Rhizobiaceae:根瘤菌科;Erysipelotrichaceae:韦荣球菌科;Bifidobacteriaceae:双歧杆菌科;Ruminococcaceae:瘤胃菌科;Enterobacteriaceae:肠杆菌科;Akkermansiaceae:艾曼菌科;Rikenellaceae:理研菌科;Rhodanobacteraceae:罗丹诺杆菌科;Lachnospiraceae:毛螺旋菌科;Burkholderiaceae:伯克氏菌科;Clostridiaceae_1:梭菌科_1;Prevotellaceae:普雷沃氏菌科;Bacteroidaceae:拟杆菌科;Micrococcaceae:微球菌科;Dermabacteraceae:皮杆菌科。图5 各组小鼠肠道细菌科水平丰度图Fig.5 Abundance map of intestinal bacteria of mice at famliy level in each group
由图6可知,在属水平上,40~60%为未知菌。与对照组相比,毛螺菌属相对丰度在AFM1组、OTA组、AFM1+OTA组中均下降,所占比例从9.13%(对照组)降至8.07%(AFM1组)、7.88%(OTA组)及7.61%(AFM1+OTA组),同时,乳酸菌属相对丰度在AFM1组、OTA组、AFM1+OTA组中也下降,所占比例从14.08%(对照组)降至7.37%(AFM1组)、7.48%(OTA组)及3.03%(AFM1+OTA组)。艾克曼菌属相对丰度在AFM1组和OTA组中下降,但在AFM1+OTA组中上升。为进一步探究,采用霉菌毒素处理后影响肠道菌群的前20个门水平上的相对丰度来制作门水平物种丰度图,得到图7。从图中可以看出,AFM1+OTA组中,相对丰度降低的细菌分别是乳酸菌属和拟普雷沃菌属。

Unclassified:未分类的;Other:其他;Prevotellaceae_UCG-001:普雷沃氏菌属_UCG-001;Ruminiclostridium:瘤胃梭菌属;Bacteroides:拟杆菌属;Alloprevotella:拟普雷沃氏菌属;Akkermansia:艾克曼菌属;Lactobacillus:乳杆菌属;Lachnospiraceae_NK4A136_group:毛螺菌属NK4A136群。图6 各组小鼠肠道细菌属水平相对丰度Fig.6 Relative abundance of intestinal bacteria of mice at genus level in each group

Lachnospiraceae_NK4A136_group:毛螺菌属NK4A136群;Lactobacillus:乳杆菌属;Anaerotruncus:厌氧棍状菌属;Prevotellaceae_UCG-001:普雷沃氏菌属_UCG-001;Alloprevotella:拟普雷沃氏菌属;Bacteroides:拟杆菌属;Brachybacterium:短状杆菌属;Akkermansia:艾克曼菌属;Ruminococcaceae_UCG-014:瘤胃菌科属_UCG-014;Blautia:劳特氏菌;Rikenellaceae_RC9_gut_group:理研菌科RC9肠道群;Bifidobacterium:双歧杆菌属;Ruminiclostridium:瘤胃梭菌属;Ruminococcus_1:瘤胃球菌属_1;Oscillibacter:颤杆菌克属。图7 各组小鼠肠道细菌属水平丰度图Fig.7 Abundance map of intestinal bacteria of mice at genus level in each group
2.5 各组间小鼠结肠内容物差异菌群筛选结果分析
采用Welch’st-检验筛选得到了门、科和属水平下不同组的差异菌群并对其进行分析(图8~图10),结果以P<0.05为阈值。

Chloroflexi:绿屈挠菌门;Acidobacteria:酸杆菌门;BRC1:BRC1门;95% confidence intervals:95%置信区间;Mean abundance:物种丰度均值;Diff in mean proportions:组间丰度差值。图8 各组小鼠肠道细菌门水平差异菌群Fig.8 Difference flora of intestinal bacteria of mice at phyla level in each group

Propionibacteriaceae:丙酸杆菌科;Sphingobacteriaceae:鞘脂杆菌科;Erysipelotrichaceae:韦荣球菌科;95% confidence intervals:95%置信区间;Mean abundance:物种丰度均值;Diff in mean proportions:组间丰度差值。图9 各组小鼠肠道细菌科水平差异菌群Fig.9 Difference flora of intestinal bacteria of mice at family level in each group

Ruminococcaceae_UCG-014:瘤胃菌科属_UCG-014;Methylobacterium:甲基杆菌属;Eubacterium_brachy_group:短优杆菌属群;Clostridium_sensu_stricto_1:梭状芽胞杆菌属;Candidatus_Saccharimonas:候选单胞生糖菌属;Brevundimonas:短波单胞菌属;Eubacterium_coprostanoligenes_group:真杆菌属群;Vibrio:弧菌属;Veillonella:韦荣氏球菌属;Intestinibacter:肠杆菌属;95% confidence intervals:95%置信区间;Mean abundance:物种丰度均值;Diff in mean proportions:组间丰度差值。图10 各组小鼠肠道细菌属水平差异菌群Fig.10 Difference flora of intestinal bacteria of mice at genus level in each group
由图8可知,在门水平,与对照组相比,AFM1组、OTA组、AFM1+OTA组相对丰度显著降低(P<0.05)的细菌分别为:绿屈挠菌门、酸杆菌门、BRC1门、绿屈挠菌门细菌。
由图9可知,在科水平,与对照组相比,Muribaculaceae和Saccharimonadaceae、韦荣球菌科3种细菌相对丰度均显著增加(P< 0.05),前2种细菌相对丰度的变化出现在AFM1组中,而后1种细菌相对丰度的变化出现在OTA组中;丙酸杆菌科、柄杆菌科、鞘脂杆菌科、丙酸杆菌科这4种细菌相对表达丰度均显著下降(P<0.05),同样,前2种细菌相对丰度的变化出现在AFM1组中,而后2种细菌相对丰度的变化出现在OTA组中;AFM1+OTA组中无显著差异细菌。
由图10可知,在属水平,与对照组相比,AFM1(灌胃3.5 mg/kg BW AFM1)处理后,表达丰度显著升高(P<0.05)的细菌为瘤胃菌科属_UCG-014、候选单胞生糖菌属、梭状芽胞杆菌属、和短优杆菌属;表达丰度显著降低(P<0.05)的细菌为甲基杆菌属和短波单胞菌属。在OTA组(灌胃3.5 mg/kg BW OTA)中,相对丰度显著升高(P<0.05)的细菌为瘤胃菌科属、真杆菌属、短优杆菌属、Family_XIII_AD3011_group。AFM1+OTA(混合灌胃3.5 mg/kg BW AFM1+3.5 mg/kg BWOTA)处理后,相对丰度显著升高(P<0.05)的细菌为梭状芽胞杆菌属、肠杆菌属、短优杆菌属和韦荣氏球菌属;相对丰度显著下降(P<0.05)的细菌只有弧菌属。
3 讨 论
近年来随着研究的不断深入,肠道菌群与人类健康之间的关系备受关注。肠道菌群被证明能够结合、转化、降解和转移霉菌毒素[24-26],许多外部环境因素影响着其多样性、形态结构和丰度[27],并且在调节机体生理和病理生理的变化中有着不可或缺的作用[28]。健康的肠道微生物可以调节肠道感染,维持免疫系统活跃度,在肠道中发挥着至关重要的作用[29]。肠道菌群失衡可导致全身免疫系统过度活跃,从而引发宿主炎症和自身免疫性疾病[30-31]。目前的研究报道表明,肠道微生物的变化从某种角度上反映着动物是否健康,微生物菌群结构的变化可能诱发某些疾病[32-33]。
霉菌毒素摄入机体后最终会影响肠道原有的微生物屏障功能。本研究从门、科、属水平对各组间小鼠肠道内容物菌群结构组成分析可知,AFM1和OTA单独及联合处理并未使小鼠肠道菌群多样性发生明显变化。霉菌毒素组与对照组相比优势菌群无明显差异,但是霉菌毒素组造成了菌种相对表达丰度的变化。门水平上,与对照组相比,厚壁菌门细菌在单独或联合霉菌毒素处理组中相对表达丰度均下降,这与小鼠体重下降趋势一致。先前研究表明,厚壁菌门相对丰度的下降与体重有关[34],但另外一项研究中,厚壁菌门与拟杆菌门相对丰度在高体重生长猪和低体重生长猪之间无显著差异[35]。这表明霉菌毒素处理与体重之间存在联系,而本研究结果显示霉菌毒素处理之后小鼠体重明显下降。研究报道短时间暴露在ZEN中并未引起肠道菌群结构(多样性)发生显著变化[36],这与本研究结果一致。研究报道,肉鸡摄入脱氧雪腐镰刀菌烯醇(DON)污染的饲料或用ZEN、DON处理小鼠等,肠道中3种细菌,如厚壁菌门、拟杆菌门、变形菌门相对丰度均会发生变化,但变化情况不同[37-39]。这些不一致性可能是由于动物类型和年龄、霉菌浓度、毒素条件(自然污染或纯化粉末)、处理时间、天气条件和膳食组成的变化所造成的。在科水平,先前研究报道短期ZEN暴露明显引起肠道乳杆菌相对丰度减少[36],这与本研究霉菌毒素处理导致乳杆菌科的相对丰度降低结果一致。另一研究中表明,小鼠在经过DON处理后毛螺旋菌科相对丰度增加[40]。而本研究中3个霉菌毒素处理组中毛螺旋菌科相对丰度未发生变化,瘤胃球菌科以及肠杆菌科这2种细菌在小鼠肠道内相对丰度增加。所以,AFM1和OTA这2种霉菌毒素可能会通过增加致病菌数量来损伤小鼠微生物屏障。在属水平,霉菌毒素处理后会降低有益菌种相对丰度,这与前人研究OTA进入肠道后会改变肠道稳态,还会降低有益菌种相对丰度[18]结果一致。但研究报道OTA在对大鼠进行28 d灌胃后,其肠道微生物菌群结构发生改变,乳酸菌属相对丰度增加[41],这与本研究结果相反。这表明AFM1和OTA这2种霉菌毒素可能会通过降低益生菌相对丰度来损伤小鼠微生物屏障。通过对各组小鼠肠道内微生物菌群结构的分析可知,无论是门水平、科水平还是属水平,与对照组相比,霉菌毒素处理组并未使肠道微生物多样性发生显著变化,但不同的霉菌毒素处理造成了不同门、科及属水平菌群相对丰度的差异变化。
α多样性指数常用来反映肠道菌群的多样性和丰富度。Chao1、Sobs、Ace指数越大说明肠道菌群的丰富度越高,物种越丰富,而Simpson指数则反映的是多样性,其值越大说明群落多样性越低,Shannon指数刚好相反。对本试验中48个样本的α多样性分析结果表明,虽然AFM1与OTA单独及联合处理未显著影响小鼠肠道微生物群落丰富度和多样性,但与对照组相比,小鼠肠道细菌相对丰度有增加趋势。研究表明,黄曲霉毒素会导致原生动物瘤胃菌群失调,从而对纤维素利用率、挥发性脂肪酸含量、酶活性等产生影响,最终会影响奶牛的产奶量和进食量[42],因此,推测AFM1与OTA联合处理可能是通过肠道微生物来影响动物健康的。在本试验中,Shannon指数和Simpson指数在不同组间差异性均不显著,这可能与本试验采用霉菌毒素处理时间相关,因为肠道菌群在肠道中的定植需要较长一段时间。
4 结 论
在本试验条件下,利用16S rRNA测序分析发现,虽然AFM1和OTA单独及联合处理并未使小鼠肠道菌群总体丰度和多样性明显发生变化,但在菌群总体相对丰度上,AFM1和OTA单独及联合处理在门、科、属水平上存在差异。AFM1和OTA单独及联合处理增加了影响小鼠肠道健康的致病菌相对丰度,降低了保护小鼠肠道健康的益生菌相对丰度,从而改变了肠道微生物菌群结构,进一步损伤肠道微生物屏障,这表明AFM1和OTA这2种霉菌毒素可能破坏了小鼠肠道微生物屏障。

