尺寸均一微球制剂的研究进展
韦祎,马光辉
(中国科学院过程工程研究所生化工程国家重点实验室,北京 100190)
引 言
微球是20世纪末发展起来的新型给药技术,一般直径为1~250μm,其中小于500nm的称为纳米微球[1-2]。利用生物可降解型聚合物制备微球给药系统,可以解决蛋白多肽类药物在胃肠道环境下不稳定,难以口服;注射时因其在体内循环时间短需频繁给药,患者顺应性差的难题[3-10],达到长效缓释和减少给药次数的目的。另外,难溶化学药物往往需要以油作为载体,注射时易造成注射部位的疼痛且难以在体内保持稳定的血药浓度。因此,通过用微球包埋这类药物制备缓释注射制剂,使药物在患部缓慢释放,减轻不良反应和减少给药次数[11-15]。此外,基于纳微球的靶向制剂设计,为高效低毒的抗肿瘤药物递送提供了崭新的手段[16-22],有助于克服直接给药过程中的弊端。纳微球还被应用于疫苗制剂中,用于增强抗原免疫后的应答水平[23-30]。
然而,传统的微球制备方法包括机械分散法[31]、喷雾法等[32-33],存在着单位产品的耗热量大、设备的热效率低、微球产品易吸附于干燥器室壁上,造成收率较低等问题。同时,大多微球市售制剂在生产过程中因为粒径不够均一,需要进行筛分,造成原料的浪费;上述方法制备的微球即使筛分后,大小仍参差不齐、粒度分布较宽,这不仅导致产品批次间制备重复性不佳,且粒径不均一会制约微球构效关系的研究,严重影响应用效果,带来不可预料的不良反应。因此,尺寸均一、可控的微球产品是医药制剂的关键核心。本团队研制的微孔膜乳化技术顺利解决了高端均一纳微球产品的制备技术瓶颈,技术和装备成熟,可以提高原料药利用率、降低成本浪费、减少有机试剂的使用,更加高效绿色。本文将对本团队基于微孔膜乳化制备均一载药微球的相关研究进行总结,介绍均一微球的重要性和制备新技术;系统阐述微球制剂在长效缓释、疫苗递送、抗肿瘤药物递送中的应用研究,以及微球的均一性在应用中的重要作用。
1 制备均一载药物微球的新技术
本团队成功发展了可制备均一生物颗粒的膜乳化过程和装备,应用于医药、生物分离介质、细胞培养微载体等领域[34-44]。制备乳液的膜乳化技术分为直接膜乳化技术(direct membrane emulsification)和快速膜乳化技术(premix membrane emulsification),下面对这两种膜乳化技术原理进行介绍。
1.1 直接膜乳化技术
直接膜乳化的原理如图1(a)所示,分散相即内水相或者内油相在储存罐中受气体压力作用,缓慢通过膜孔,在该过程中,乳滴在膜孔出口处受到连续相搅拌时的曳力、乳滴浮力、界面张力和膜压力,在这四种力的作用下,乳液在膜孔口上由小变大,逐渐生长形成均一乳滴。在这个过程中,分散相和连续相的成分、过膜压力均可以影响乳液在膜表面的行为,如乳滴生长速度、脱离时间等;而膜孔径决定了乳滴最终离开膜表面时粒径的大小[45]。因此可对膜孔径、过膜压力以及分散相和连续相的组成进行适当调控制备出为膜孔径2~10倍的均一粒径乳滴[46]。

图1 直接膜乳化技术(a)及快速膜乳化技术(b)示意图Fig.1 Schematic representation of direct membrane emulsification(a)and premix membrane emulsification(b)
在直接膜乳化过程中,因分散相需要在膜表面有足够的界面张力,才能在膜孔口上生长出液滴,故分散相不能润湿膜孔。因此一般O/W型乳液滴的制备采用亲水性膜,而W/O型乳液滴制备采用疏水性膜。本团队分别采用亲水性的微孔膜和疏水性的微孔膜,成功地制备了尺寸均一可控的聚乳酸(PLA)微球、聚乳酸-羟基乙酸共聚物(PLGA)微球、琼脂糖微球、葡甘聚糖微球、壳聚糖微球和温度-pH双重敏感的壳聚糖季铵盐微球等[47-51]。直接膜乳化操作方式可以很好地控制乳滴的粒径,制备过程温和,但乳液滴形成速率 缓 慢,其 通 量 一 般 在0.01 ~0.1m3/(m2·h)范围内[52]。
1.2 快速膜乳化技术
快速膜乳化法是首先通过常规的乳化方式如机械搅拌、均质等方法制备所需要的预乳液,然后将预乳液通过较高的氮气压力迅速压过膜孔形成最终乳液滴[53]。其原理如图1(b)所示,与直接膜乳化的原理不同,快速膜乳化是较大的液滴在膜孔口处受到压力发生形变,生成小且均一的液滴。所受压力越大,乳液受到的挤压越剧烈,形成的乳液滴尺寸越小。因此,选择合适的压力可以制备出具有目标粒径、尺寸均一的微球。由于在该技术中,均一乳滴的形成并非是在膜孔口生长脱落,而是乳液破碎,所以得到的乳液粒径尺寸比膜孔径小(为膜孔径的1/3~1/2)。该方法相比于直接膜乳化技术,效率明显提高,乳液过膜的通量一般大于1m3/(m2·h)[54]。本团队采用快速膜乳化技术成功地制备了尺寸均一可控的聚乳酸-聚乙二醇共聚物(PELA)微球、聚乳酸-羟基乙酸共聚物(PLGA)微球和壳聚糖微球等[12,14,55-60]。
为了尽可能地避免制备过程中人为操作因素造成的误差以及杂质、细菌的污染,本团队研发了自动化膜乳化设备,已用于企业的中试和生产。图2为商品化膜乳化设备,分别可以单次处理500ml以及15L体系的乳液,可以满足实验室规模、小试规模及中试生产规模的需求,设备上还可配有控温系统,温度调节0~150℃。

图2 商品化膜乳化设备Fig.2 Commercially availabl membrane emulsification equipment
2 均一微球包埋药物的重要性
2.1 绿色环保、降低成本
利用膜乳化技术生产均一粒径微球可以显著降低原辅料成本,更符合绿色化工的需求。由于目前商品化微球制剂的制备多为传统包埋方法,为了获得稳定乳液,需要在外水相中添加大量的乳化剂[61],尤其是对于机械搅拌法制备微球,需要较高浓度的乳化剂(2%~10%(质量))来维持油水界面的稳定性[62-64];而对于膜乳化技术,因其制备的乳液均一、稳定,所需的乳化剂用量较低,外水相中添加1%~1.5%(质量)的乳化剂即可较好地稳定油水界面[38,55,65]。产品的后清洗次数随之减少,在“三废”的处理上更简单快捷。
另外,常规方法制备的微球大小参差不齐、粒度分布较宽,注射给药时易堵塞针头。为了解决这个难题,研究者将制备好的载药微球经过一定尺寸的筛网进行筛分,以获得理想尺寸的载药微球,导致原料药和辅料的浪费,成本增加;同时,基于膜乳化技术制备粒径均一微球整个过程平缓温和,产热量较少,对微球所包埋的活性物质损失较少。总体而言,可以节省约40%的原辅料,进一步降低原辅料成本。另外,在工艺成本方面,膜乳化技术制备的微球粒径均一,省去了筛分及后续筛网清洁、再生的处理工艺,简化了整体流程,显著降低均一微球生产的工艺成本。
2.2 利于规模放大、批次间重复性好
尺寸均一特性是微球放大生产的重要保障,只有保证批次间良好的重复性,才能保证缓释制剂的治疗效果的重复性。当进行微球制剂放大制备时,传统搅拌方法面临的粒径制备重复性问题会更加突出,而膜乳化技术对均一微球的制备具有良好的可控性。本团队成功发展了膜乳化技术大规模制备医用缓释微球,批次间重复性好,并将技术产业化[49,66]。在GMP实验室大规模生产的十余批微球,其批次间的粒径大小标准偏差在5%以下,进一步证明膜乳化技术对微球粒径控制的稳定性。目前采用膜乳化技术已研发制备出了多种药物(如醋酸曲普瑞林、艾塞那肽、膜融合抑制剂等多肽类药物,罗哌卡因、紫杉醇等小分子难溶性药物)的微球制剂[67-69]。
2.3 利于研究构效关系
利用传统方法制备的微球大都粒径分布较宽,微球大小参差不一,会制约对微球构效关系的研究。当利用微球进行免疫学效应的研究时,不均一微球会导致抗原在体内分布不规律,实验结果的波动性显著放大[70-72]。同时,也有相关文献表明微球作为药物载体,其粒径不仅影响其释放速度,而且会影响其在体内分布和吸收,从而影响最终的治疗效果[39,73]。例如,Wei等[74]在制备出三种粒径均一的壳聚糖微球(2.1 ,7.2 ,12.5 μm)的基础上,进行动物口服给药研究,研究了粒径对其在消化道内分布的影响。结果如图3所示,粒径对壳聚糖微球在消化道内的分布有显著影响,小粒径的微球(2.1 μm)在回肠和结肠分布数量最多,表明其能较多地通过回肠和结肠吸收。
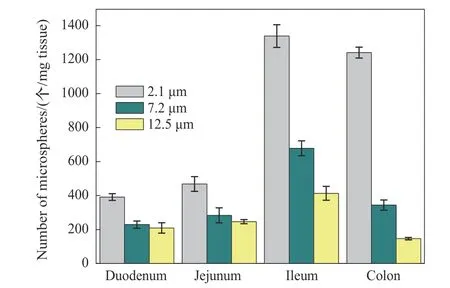
图3 三种粒径的壳聚糖微球在消化道的分布[74]Fig.3 Distribution of chitosan microspheres with different diameters in gastrointestinal(GI)tract[74]
3 均一载药微球的应用
3.1 缓释微球制剂
3.1.1 多肽药物 在制备多肽载药微球时,由于多肽分子量小,亲水性强,在W/O/W型复乳液制备阶段内水相药物极易向外水相逃逸,造成包埋率低。因此研究者们针对多肽药物的特性进行研究,制备出高包埋率和高药物活性的载药微球。Qi等[38,58,75]以艾塞那肽为模型药物,利用溶剂挥发结合快速膜乳化法制备出粒径均一的艾塞那肽微球。对超声(UMS)和均质(HMS)两种初乳制备方法进行了比较,并对药效学进行了分析。图4表明,UMS和HMS两种载药微球的粒径均一,均在20μm左右,粒径分布系数Span值小于0.7,包埋率分别为98%和91%;UMS内部紧密孔小,药物分布均匀,HMS内部疏松孔多,药物分布零散。动物药效实验中艾塞那肽注射液组每日注射2次,连续注射14d;微球组只第1d注射1次,其药物剂量与艾塞那肽溶液组的总剂量相当。实验结果显示,艾塞那肽溶液组的降血糖率在前14d明显升高,但当第14d停止给药以后,血糖恢复到对照组(生理盐水组)水平。两种初乳制备法的艾塞那肽微球在前14d均有明显的降血糖效果;而HMS组在14d后药效逐渐减弱,UMS组则在30d内始终保持一定的降血糖率水平(图5)。另外,在微球粒径相同、尺寸均一的基础上,Qi等[75]首次研究了阳离子(Ca2+、Mn2+和Zn2+)对艾塞那肽的酰化抑制作用,创新性地采用石英晶体微天平(QCMD)分析酰化抑制的微观机理,结果表明Zn2+抑制作用最强,Mn2+作用较弱,Ca2+不起作用。

图4 UMS微球表面形貌(a)和内部结构(b)的SEM图(标尺:10μm)以及药物内部分布共聚焦图(c)(标尺:50μm)HMS微球表面形貌(d)和内部结构SEM图(e)(标尺:10μm)以及药物内部分布共聚焦图(f)(标尺:50μm)[38]Fig.4 Surface morphology(a)and crossing-section(b)SEM images of UMS(scale bar:10μm),CLSM images for distribution of Super Fluor488SE labeled exenatide within UMS(c)(scale bar:50μm),surface morphology(d)and crossing-section(e)SEM images of HMS(scale bar:10μm),CLSM images for distribution of Super Fluor488SE labeled exenatide within HMS(f)(scale bar:50μm)[38]
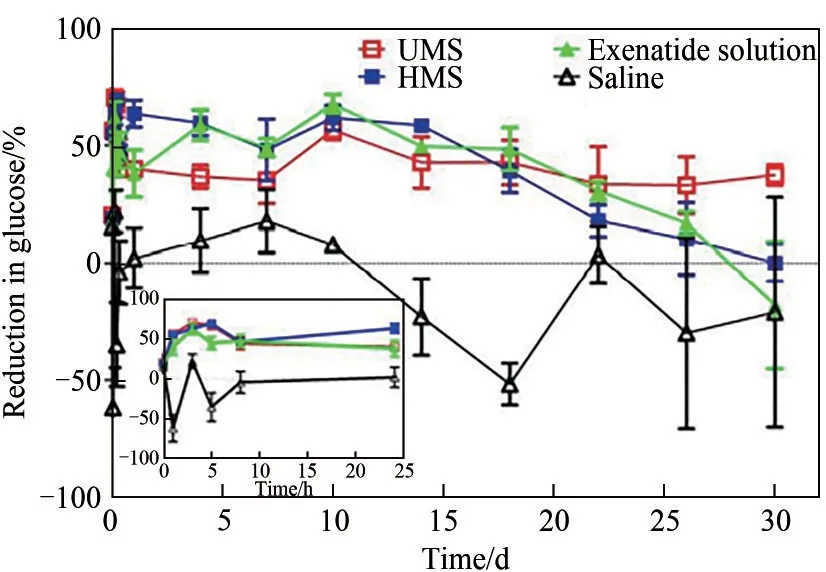
图5 UMS、HMS、艾塞那肽溶液和生理盐水的降血糖率随时间变化曲线(插图表示24h内降血糖率随时间的变化)[38]Fig.5 Reduction in blood glucose vs time profiles of UMS,HMS,exenatide solution and saline(the insert presents the reduction in blood glucose vs time within24h)[38]
杨柳青等[76]以胸腺法新为模型药物,通过优化内水相体积、油相乳化剂浓度、PLGA浓度、分子量和外水相pH,利用快速膜乳化结合溶剂挥发法制备得到了平均粒径24μm且粒径均一(Span值为0.6 )的载胸腺法新微球,包埋率大于80%。在粒径可控基础上,考察了PLGA分子量对药物释放的影响。结果显示,随着PLGA分子量升高,微球的突释率降低,整个释放过程更接近零级释放。并且由于膜乳化技术的制备过程简便温和,克服了传统方法对药物分子结构的影响,显著提高了药物的实际使用效率。图6表明胸腺法新微球能持续释放药物,且在体外释放过程中药物能够保持良好的活性,实现了长效稳定释放。
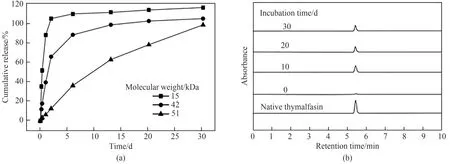
图6 不同PLGA分子量所制备的微球的体外释放曲线(a)和不同释放时间后药物的高效液相色谱(b)[76]Fig.6 Cumulative drug release profiles in vitro of microspheres prepared with different molecular weights of PLGA and HPLC(a),chromatograms of drugs in release media of microspheres in different incubation times(b)[76]
Jin等[55]用PLGA包埋人类免疫缺陷病毒(HIV)膜融合抑制剂LP-98,使用快速膜乳化技术结合溶剂挥发法,考察了预复乳方式、过膜压力、外水相稳定剂浓度、油相PLGA浓度、内水相药物浓度、初乳制备方式等因素对微球性质的影响,最终制备出粒径为14μm、Span<0.9、载药量>8%、包埋率>95%的均一膜融合抑制剂缓释微球(LP-98-PLGA microspheres)[图7(a)]。体内药代动力学分析显示,所制备的微球可在大鼠体内持续释放24d[图7(b)]。3.1.2 蛋白药物缓释微球 蛋白类药物分子量高,结构复杂,在剧烈的制备条件下易变性失活,稳定性差,从而降低药效甚至对机体产生毒副作用。膜乳化过程温和,可以解决这个问题。本团队Zhang等[77]以胰岛素为模型药物,采用快速膜乳化技术和两步固化工艺制备出平均粒径约7.5 μm、粒径分布窄(Span值为0.731 )、球形度好的口服海藻酸钙-壳聚糖微球。该方法能够温和地制备具有均一尺寸的乳液,从而保留胰岛素的免疫活性,使其在胃肠道有效吸收。在糖尿病大鼠实验中,制备的载胰岛素口服微球具有持续的降血糖效果(图8)。
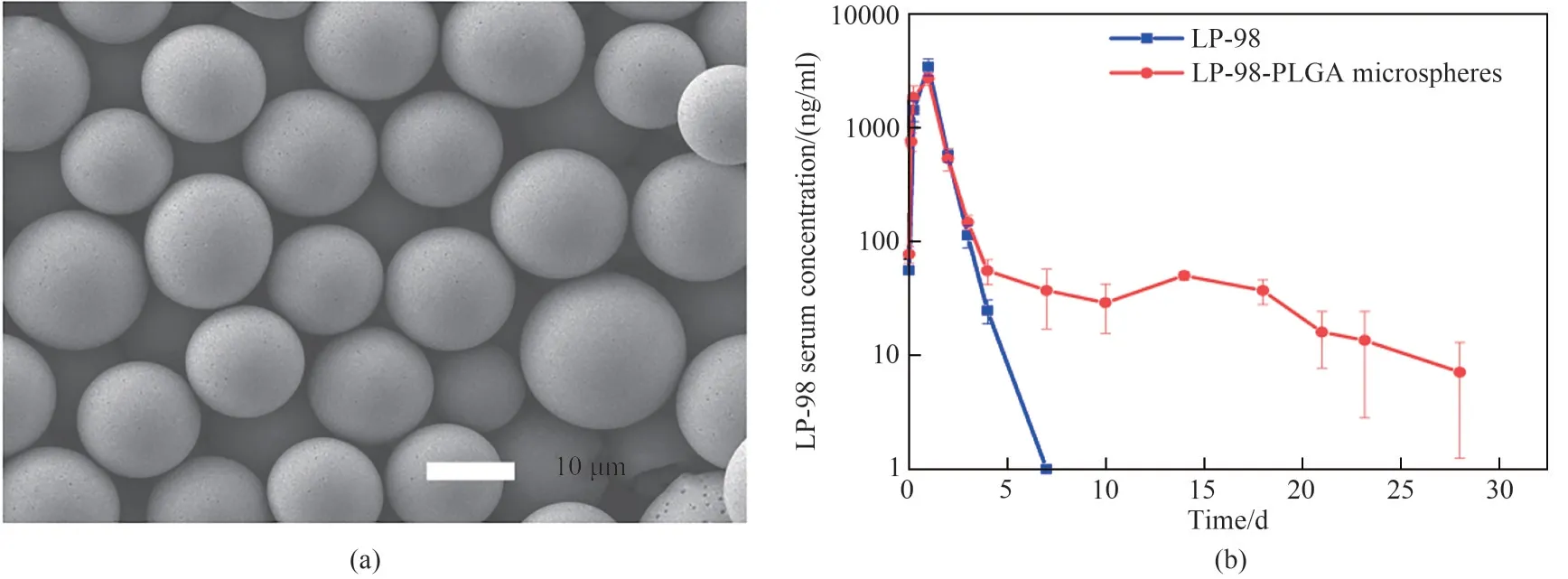
图7 LP-98-PLGA微球的电镜图(a);LP-98和LP-98-PLGA微球影响下的LP-98血清浓度随时间的变化曲线(b)[55]Fig.7 SEM images of LP-98-PLGA microspheres with narrow size distribution(a),LP-98serum concentration vs time profiles of LP-98and LP-98-PLGA microspheres(b)[55]
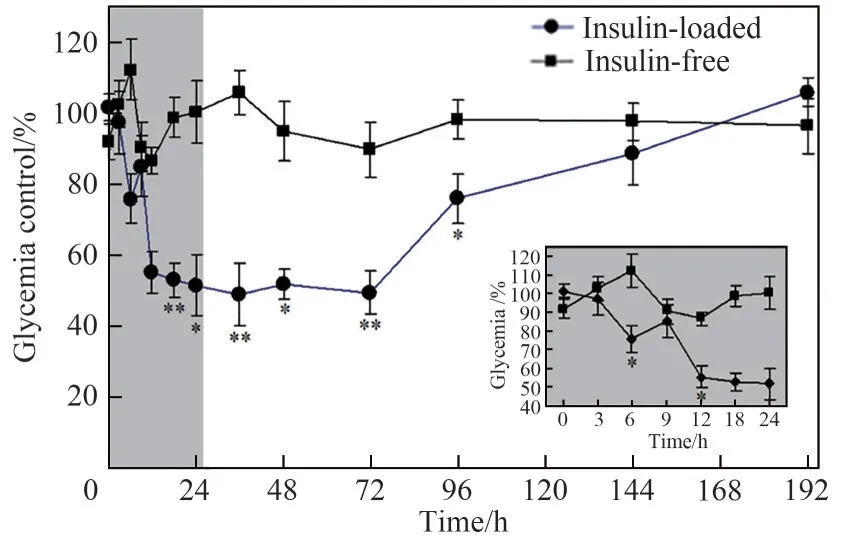
图8 糖尿病大鼠口服不含胰岛素和含胰岛素(100IU/kg)藻酸盐-壳聚糖微球后的血糖浓度(与不含胰岛素的微球有统计学上的显著差异:*p<0.05 ;**p<0.01 )[77]Fig.8 The serum glucose concentration after oral administration of insulin-free and insulin-loaded(100IU/kg)alginate-chitosan microspheres to STZ-induced diabetic rats(statistically significant difference from insulin-free microspheres:*p<0.05 ;**p<0.01 )[77]
Wei等[13-14,66,78]以重组人生长激素(rhGH)为模型蛋白类药物,采用复乳液法结合快速膜乳化技术制备了粒径分布窄的重组人生长激素聚乳酸-聚乙二醇共聚物(PELA)微球。基于微球尺寸均一可控,设计了PEG与PLA质量比分别为1∶9(PELA-1)、1∶14(PELA-2)和1∶19(PELA-3)的PELA共聚物载rhGH缓释微球,比较了材料亲疏水性对微球体外释放的影响。从图9可见,亲水性较强的PELA-1微球在66d内总共释放了79.8%的重组人生长激素,而亲水性较弱的PELA-2和PELA-3微球在同一时期分别释放了约76.1%和20.1%,且观察到PELA-3微球有40d的显著平台期[78]。3.1.3 小分子药物缓释微球 与蛋白多肽类药物不同,小分子药物由于分子量小,在微球制备过程中易快速逃逸,导致包埋率降低。为了解决这个问题,本团队通过快速膜乳化技术,得到粒径均一的乳滴,避免了固化过程中的奥斯瓦尔德熟化,保证了载药微球的高包埋率。Li等[12,35]以罗哌卡因(RVC)为模型药物,采用乳化法结合膜乳化技术制备出平均粒径17μm,Span值小于0.6 ,包埋率大于80%的均一载药微球(图10,RVC HCl solutim为罗哌卡因盐酸盐溶液,Blank-MS代表空白微球)。在粒径均一可控基础上考察不同端基(羟基、羧基、酯基)的PLGA对微球载药的影响。大鼠药效学实验表明,羟基端载罗哌卡因微球表现出最佳的长效镇痛效果。
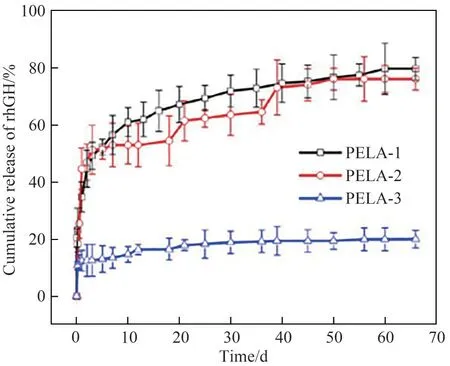
图9 三种PELA微球的体外累积释放图[78]Fig.9 Cumulative release profiles of rhGH from three PELA microspheres[78]
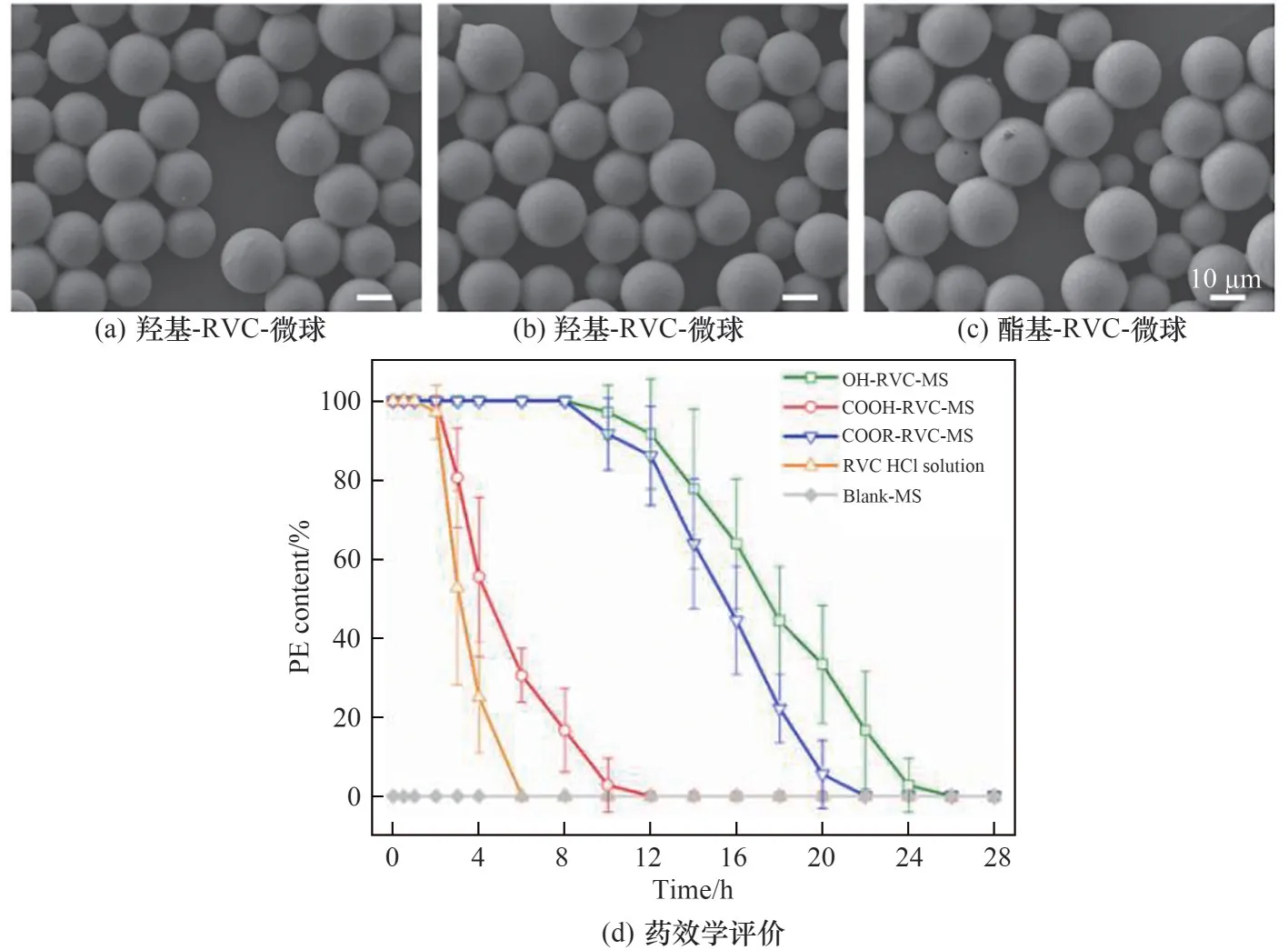
图10 不同PLGA端基制备的罗哌卡因微球扫描电镜图和药效学评价[35]Fig.10 SEM images of OH(a),COOH(b),COOR-RVC-microspheres(c)and pharmacodynamics study of ropivacaine loaded microspheres prepared by different PLGA terminal group(d)[35]
3.2 均一载药微球在疫苗制剂中的应用
随着生物技术的发展,成分明确、安全稳定的新型亚单位疫苗开始出现,但其免疫原性减弱,必须要添加佐剂(免疫增强剂)或采用抗原递送系统才能获得强的免疫应答。微球同自然界中的细菌、病毒等尺寸或维度相近,更容易被机体识别为外源性物质,具有增强机体免疫应答的效果。本团队Liu等[79]通过快速膜乳化技术制备出均一粒径的水/油(W/O)型疫苗制剂,水相为抗原溶液,油相为油佐剂,研究证实粒径均一的乳液制剂比粒径分布宽的制剂具有更强的免疫应答。在此工作基础上,Zhang等[28]以PLGA作为微球骨架材料,采取相同的制备方法,制备了负载咪喹莫特(imiquimod,IMQ),粒径约为1μm的均一微球(IMQ-MPs)作为疫苗佐剂。将空白微球(MPs)和IMQ-MPs与细胞共同孵育12h,结果表明IMQ-MPs促进细胞摄取抗原的能力明显强于MPs,并且可以更好地增强骨髓树突状细胞(BMDCs)和腹腔巨噬细胞(pMΦs)分泌炎症因子的能力,这主要源于IMQ-MPs在被摄取之后,伴随着微球骨架的降解持续释放IMQ,促进细胞的活化。
Liu等[80]以PLGA为材料,以鸡卵清白蛋白(OVA)为模型抗原,采用复乳-溶剂去除法结合快速膜乳化技术,并在内水相中添加碳酸氢铵,制备得到粒径约为900nm、尺寸均一的胞内pH敏感型纳米微球。研究发现,在模拟胞质环境(pH7.4)中,抗原释放量24h内不足10%,而在模拟胞内内涵体、溶酶体的弱酸环境下(pH5.0 ~6.5 ),24h内抗原的释放量超过85%。这主要是由于纳微球在溶酶体的酸性环境中(NH4)2CO3与H+反应释放出NH3和CO2,气体冲破颗粒外壳的同时进一步增加溶酶体内部气压,进而将溶酶体胀破,使抗原从溶酶体逃逸到细胞质,从而诱导细胞免疫应答。
3.3 均一载药微球在恶性肿瘤治疗中的应用
目前大多数传统的抗肿瘤药物治疗缺乏特异性,在人体内生物利用度不高,在给药时需要大剂量,以增加到达肿瘤部位的概率。基于肿瘤血管的EPR效应(enhanced permeability and retention effect),可以实现药物的被动靶向,因此纳米微球(NP)制剂被认为是最有希望向肿瘤组织有效递送药物的方式之一[81]。然而,不均一的粒径和低载药率会影响临床治疗效果[82-83]。针对以上问题,马宇峰等[84]在装载紫杉醇(PTX)的羧甲基壳聚糖球(CNP)表面上修饰三(2-氨基乙基)胺(TAEA),TAEA可以使CNPs表面富含氨基,从而带有充足的正电荷;在此基础上进一步偶联2,3-二甲基马来酸酐(DMMA),DMMA可以使CNPs表面富含羧基,纳米微球PTX-CNP:TAEA:DMMA表面由正电荷转为负电荷,并通过快速膜乳化技术实现纳米微球的尺寸均一性(150nm,多分散指数PDI<0.1 )。结果表明该输送体系的初始负电荷有助于降低巨噬细胞对纳米微球摄取量,从而避免被内皮网状系统识别和吞噬,实现在血液中的长循环。而达到肿瘤部位后,在肿瘤组织的微酸性环境下,连接DMMA的酰胺键易被水解,从而使微球带有的正电荷暴露出来,正电荷促进载药纳米微球被肿瘤细胞的吞噬,这种肿瘤微酸环境响应的智能正负电荷翻转体系(PTX-CNP:TAEA:DMM纳米微球),显著提高了对肿瘤细胞的杀伤效率,半抑制浓度从11.3 Mg/ml降低至4.09 μg/ml。
另外Lv等[85]还利用油/水/油(O/W/O)复乳法结合快速膜乳化技术制备了粒径均一的纳米微球。并利用纳米微球表面的羧基引入具有隐形效果的聚乙二醇(PEG)链和靶向肿瘤细胞的三肽序列(RGD),制备兼具隐形和靶向能力的紫杉醇纳米给药载体(RGDPEG-CNP:PTX)。实验结果显示,该粒径均一的纳米微球给药制剂可以提高药物生物利用度以及抗肿瘤效果,并且具有较低的毒副作用(图11)。
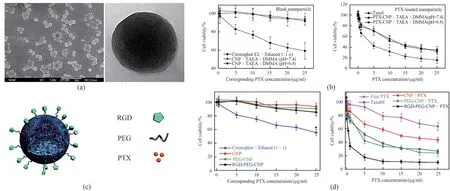
图11 羧甲基壳聚糖载紫杉醇纳米球的扫描及透射电镜照片(左:扫描电镜;右:透射电镜)(a);空白纳米球和羧甲基壳聚糖载紫杉醇纳米球对小鼠肺癌细胞LLC的细胞毒性对比(b)[84];RGD-PEG-CNP:PTX的示意图(c);不同PTX制剂对LLC的细胞毒性(d)[85]Fig.11 SEM and TEM of carboxymethyl chitosan-loaded paclitaxel nanospheres(left:SEM;right:TEM)(a),comparison of cytotoxicity of blank nanospheres and carboxymethyl chitosan-loaded paclitaxel nanospheres against LLC(b)[84],schematic diagram of RGD-PEG-CNP:PTX(c),cytotoxicity of different PTX formulations against LLC(d)[85]
在此研究基础上,Fu等[83]结合快速膜乳化技术制备出粒径在100nm左右的均一粒径的壳聚糖纳米微球(CNPs),结合O/W/O复乳法和程序升温固化的方式实现阿霉素(DOX)、PTX与Fe2O3纳米晶体的共封装,制备出CNP:Fe/P/D;将磷脂聚乙二醇马来酰亚胺(DSPE-PEG-MAL)按1∶5的比例与RGD在PBS缓冲液混溶,25℃下反应2h得到DSPE-PEGMAL-RGD;将CNPs:Fe/P/D和红细胞膜混合通过聚碳酸酯多孔膜10次实现共融合,并在上述共融合的过程中加入DSPE-PEG-MAL-RGD,嵌插在红细胞膜磷脂上,构建出仿生程序性靶向纳米给药系统RH-CNP:Fe/P/D(图12)。均一粒径的CNPs内部同时装载着疏水性的紫杉醇、阿霉素以及氧化铁纳米晶Fe3O4,在Fe3O4介导的磁靶向作用和RGD介导的主动靶向作用下将抗癌药物高效递送到肿瘤组织附近,发挥杀伤作用。实际结果显示,利用RHCNP:Fe/P/D治疗的小鼠三周存活率达到100%,远高于其他对照组,显示出良好的抗肿瘤效果。
4 结 论
本文对制备均一载药微球的新技术进行了介绍,对均一载药微球包埋药物的重要性进行了阐述,并对均一微球制剂在长效缓释、疫苗、恶性肿瘤治疗中的应用进行了总结,得出以下结论。
(1)根据制备乳液过程的原理,膜乳化技术可分为直接膜乳化和快速膜乳化。其中,直接膜乳化适合制备粒径较大的微球,快速膜乳化适合制备粒径较小的微球。本团队研制出的创新型膜乳化装备形成了系列化产品,实现了创新技术和装备的商品化和推广应用。
(2)尺寸均一的载药微球在制备和应用上均有重要作用。首先,尺寸均一的微球在制备过程中乳化剂用量较低,更加绿色环保;且不需要额外的微球筛分步骤,减少了原辅料的浪费。其次,均一的微球批次间重复性好,易于规模放大,本团队最早使用该技术进行均一微球制剂的规模化生产。另外,微球的均一性是研究其构效关系的重要前提,保证实验结果可靠。
(3)均一载药微球在医药领域有着重要应用。缓释微球在制备过程中,根据装载药物的特性,可采取不同的微球材料和包埋策略。均一微球作为药物和疫苗载体,不仅保证了实验结果的可靠性,也提高了生物利用度和成药性。另外,均一纳微球应用到肿瘤药物的递送系统中,可提高抗肿瘤药的靶向性,显著增强疗效,减轻不良反应。膜乳化技术作为制备均一粒径微球的关键技术,具有显著的优势,为了更好地发展膜乳化技术,推广其在大规模均一微球上的生产应用,仍要面临以下挑战:①需进一步开发商品化缓释材料,美国食品药品监督管理局(FDA)批准用于临床的生物可降解高分子聚合物材料种类和规格有限,且大都被国外所垄断;②需深入研究蛋白质和相应材料的作用关系,不同的蛋白质表现出不同的结构、性质以及稳定性,深入了解缓释材料和不同蛋白质之间的作用关系可以显著提高包埋效率并保护蛋白的生物活性;③需开发多样化的缓释辅料,微球剂型在临床应用中,控制突释效应和药物的释放速率也是一大挑战,事实上,本团队前期已有很多研究工作关于降低药物的突释效应,如利用聚乳酸-聚乙二醇共聚物(PLA-PEG)代替PLA或PLGA,但仍需要开发更多样化的缓释辅料,改善微球释放效果,提高药物的生物利用度。

