不同温度胁迫对青鳉鳃凋亡的影响
胡玲红,王映,王化敏,陈良标,3*
(1.海洋生物科学国际联合研究中心,上海 201306;2.水产种质资源发掘与利用教育部重点实验室,上海 201306;3.上海海洋大学 水产科学国家级实验教学示范中心,上海 201306)
鱼类是一种水生变温脊椎动物,水温变化与鱼类的生存息息相关,鱼类生存的环境温度是影响鱼类代谢、发育、生长等生理活动最重要的非生物因素[1]。鱼类有其适宜的生存温度范围,过高或过低都会破坏鱼类机体的稳态,并使鱼类产生应激反应以重新建立稳态,但持续的应激状态会使机体的防御系统遭到破坏,最终导致鱼类死亡[2-3]。
鳃是鱼类的主要呼吸器官,具有气体交换、离子平衡、调节渗透压等功能。有研究表明,鱼鳃在鱼类响应环境的变化时具有重要意义[4]。Sollid等[4]研究发现,欧洲鲫Carassiusauratus在冷应激和缺氧条件下鳃的形态会发生变化,认为主要是由细胞增殖减少和细胞凋亡诱导造成的[5]。Hu等[6]对斑马鱼Daniorerio和尼罗罗非鱼Oreochromisniloticus在8 ℃下低温胁迫12 h的鳃组织凋亡情况研究发现,在所检测的8个器官中鳃的凋亡最为明显,这提示鳃是鱼类感知外界变化最敏感的器官。
细胞凋亡是由基因控制的细胞自我消亡过程,对于机体维持稳态和正常生理功能具有重要意义[7]。研究表明,热应激会导致细胞线粒体中过氧化物含量升高,使细胞内活性氧(ROS)含量升高,导致细胞产生氧化损伤[8]。斑马鱼卵巢在热应激下能诱导卵母细胞凋亡[9]。银汉鱼Odontesthesbonariensis雄性生殖细胞在热应激下凋亡细胞增加,半光氨酸蛋白酶(caspase)活性达到峰值,最终导致不育[10]。低温胁迫可能导致ROS增加,当ROS含量超出生物体应对这些物质的能力时,机体会发生氧化应激[11]。低温胁迫下,尼罗罗非鱼和斑马鱼鳃组织发生凋亡[12],斜带石斑鱼Epinepheluscoioides和暗纹东方鲀Takifuguobscurus肝脏凋亡途径被激活并诱导caspase家族、B淋巴细胞瘤2基因(bcl2)、bax等凋亡基因表达发生变化[13-14]。
青鳉Oryziaslatipes是一种常见的模式生物鱼类[15],具有体型较小、性别差异明显、时代周期短、胚胎时期对环境比较敏感等特性。目前,对于青鳉的研究主要集中在环境毒理、发育生长,以及温度对其摄食和生理变化等方面[16-20]。赵艳民等[17]研究发现,水中铜含量过高对日本青鳉肝脏组织造成了明显损伤。林晶等[20]研究发现,河流汞污染会严重影响青鳉的早期生长发育。王润萍等[19]研究发现,高于31 ℃或低于15 ℃的温度胁迫对青鳉摄食行为和生理变化会产生极大影响。而青鳉在温度胁迫响应方面的研究尚未见报道。本研究团队Hu等[6]曾发现,斑马鱼在极限温度8 ℃胁迫12 h时鳃发生了明显的凋亡,但是青鳉在极限温度胁迫时鳃是否发生凋亡还未知。本研究中,为探究温度对鳃凋亡的影响,首先对青鳉的温度耐受性进行了测定,在低温和高温分别选择两个温度点进行胁迫,并通过TUNEL(原位末端标记法)染色法观察不同温度胁迫时青鳉鳃组织凋亡情况,再通过流式细胞术测定不同温度胁迫下鳃细胞的ROS含量和凋亡率,同时检测了青鳉鳃的凋亡相关基因(caspase家族基因、p53、bcl2)在不同温度胁迫下的表达变化,以期为鱼类响应温度胁迫研究提供基础数据。
1 材料与方法
1.1 材料
试验采用日本青鳉HdrR品系,为4月龄性成熟个体,饲养在26 ℃循环水箱系统中,光暗循环时间为14 h∶10 h。试验中涉及的所有动物试验都遵照上海海洋大学动物实验委员会的规定严格执行。
1.2 方法
1.2.1 青鳉的温度耐受性试验 试验设3组,1个低温组(4 ℃)、1个高温组(40 ℃)和1个常温(26 ℃)对照组,低温或高温组从常温组26 ℃开始,以1 ℃/h的速度进行梯度降温或升温[6],每组设置3个平行,每个平行放20尾鱼,并置于恒温培养箱中,每2 h观察记录一次鱼的死亡情况并计算死亡率,试验共进行29 h,以试验鱼死亡率达到50%的水温作为临界温度。
1.2.2 鳃组织凋亡及基因表达试验设计 试验设5组,2个高温组(35、40 ℃)、2个低温组(10、4 ℃)和1个常温(26 ℃)对照组,高温组或低温组从26 ℃开始,以1 ℃/h的速度进行梯度升温或降温[6],每组设置3个平行,每个平行放3尾鱼,并置于恒温培养箱中,胁迫12 h后采样。
1.2.3 组织切片和TUNEL染色样本的采集 从胁迫12 h的每一个温度组各选取同时期性成熟青鳉3尾,用MS-222溶液(Thermo Fisher)麻醉后,立即解剖取其鳃组织并放入体积分数为4%的多聚甲醛溶液(生工生物工程(上海)股份有限公司)中固定过夜,梯度乙醇脱水后用二甲苯透明1 min,浸蜡3 h后包埋,利用Leica切片机以5 μm厚度对鳃组织进行切片,切片在37 ℃烘片机上过夜。随后取切片进行TUNEL染色,具体操作参考TUNEL FITC Apoptosis Detection Kit(南京诺唯赞生物科技股份有限公司)的步骤,将处理好的切片使用 Leica 激光共聚焦显微镜进行拍照。
1.2.4 鳃细胞的获取 从胁迫12 h的每一个温度组各取3尾青鳉鳃组织,用PBS冲洗,将组织加至含有500 μL胶原酶(1 mg/mL)的1.5 mL离心管中,置入37 ℃培养箱中消化组织30 min。然后用移液枪轻轻吹打分散细胞,用40 μm孔径的细胞滤网过滤悬浊液。以400g离心10 min并弃上清,加10%的胎牛血清(Gibco)培养基重悬细胞,获得鳃组织单细胞悬液。
1.2.5 流式细胞术检测鳃细胞凋亡 将获得的鳃组织单细胞悬液用1 mL PBS洗涤,以800 r/min离心5 min,重复洗一次。加入100 μL 1×Binding buffer(上海索莱宝生物科技有限公司)重悬细胞,试验组均加入5 μL Annexin V-FITC和5 μL PI(均为上海索莱宝生物科技有限公司产品),对照组分别单染、双染和空白,轻轻混匀。过程中避光,室温放置10 min,加入500 μL 1×Binding buffer,轻轻混匀,用BD Accuri C6流式细胞仪(美国Becton Dickinson公司)检测分析。
1.2.6 流式细胞术检测鳃细胞ROS 将获得的鳃组织单细胞悬液置于1.5 mL离心管中,用1 mL PBS洗涤,以800 r/min离心5 min,重复洗一次。用1 mL PBS重悬,之后加入1 μL DCFH-DA (碧云天生物科技有限公司)配成工作液,避光,室温下放置30 min (隔5 min轻轻混匀一次),以800 r/min离心5 min去除DCFH-DA 工作液,再用PBS洗涤细胞3次,最后用500 μL PBS重悬细胞,使用BD Accuri C6流式细胞仪进行检测。
1.2.7 RNA提取和定量PCR试验 从胁迫12 h的每个温度组各取3尾鱼,立即解剖取其鳃组织,放入装有Trizol reagent(Thermo Fisher)的2 mL管中,用组织振碎仪(美国MP Biomedicals)打碎组织,严格按照Trizol reagent的操作说明提取鳃的总RNA,使用反转录试剂盒(南京诺唯赞生物科技股份有限公司)将各个样品的RNA反转录成cDNA。从NCBI数据库中下载差异基因的序列,使用Primer 3.0软件设计特异性引物(表1),用于荧光定量分析(RT-PCR)。以cDNA为模板,EF-1α为试验内参,并使用Vazyme ChamQ Universal SYBR qPCR Master Mix试剂盒(南京诺唯赞生物科技股份有限公司),采用CFX96 Real-Time PCR Detection System(Bio-Rad)仪器进行实时荧光定量检测。反应体系(共20 μL):SYBR qPCR Master Mix 10 μL,上、下游引物各0.4 μL,cDNA模板2 μL,ddH2O 7.2 μL。反应程序:95 ℃下预变性30 s;95 ℃下变性10 s,60 ℃下退火30 s,共进行40个循环;最后在72 ℃下延伸5 min。融解反应:95 ℃下 15 s,60 ℃下 60 s(数据采集),95 ℃下 15 s。每个样品设3个平行试验以减小误差,采用2-△△ct法计算目的基因的相对表达量。
1.3 数据处理
试验数据用 Graph Pad Prism 8.0软件进行分析,采用单因素方差分析法进行差异显著性检验,显著性水平设为0.05,极显著性水平设为0.01。
2 结果与分析
2.1 青鳉的温度耐受性生存曲线
通过逐步降温和升温试验观察青鳉状态和存活情况。在降温试验中,当温度从最适温度26 ℃降到10 ℃时,鱼停留在底部,游动缓慢,摄食减少;当温度逐步降到4 ℃时,鱼开始停止摄食,并聚集在一起,开始出现死亡。在升温试验中,当温度从最适温度26 ℃升至35 ℃时,鱼频繁游动,摄食也明显减少;当温度继续升至40 ℃时,鱼反应激烈,间歇性上下蹿动,鳃部明显发红,身体渐渐失去平衡,开始出现死亡。以26 ℃为对照,在低温4 ℃和高温40 ℃胁迫下,每2 h记录青鳉死亡数,结果发现,在4 ℃和40 ℃胁迫12 h时,死亡率均接近50%(图1),以试验鱼达到半致死率的水温作为临界水温,青鳉的耐受温度范围为4~40 ℃。
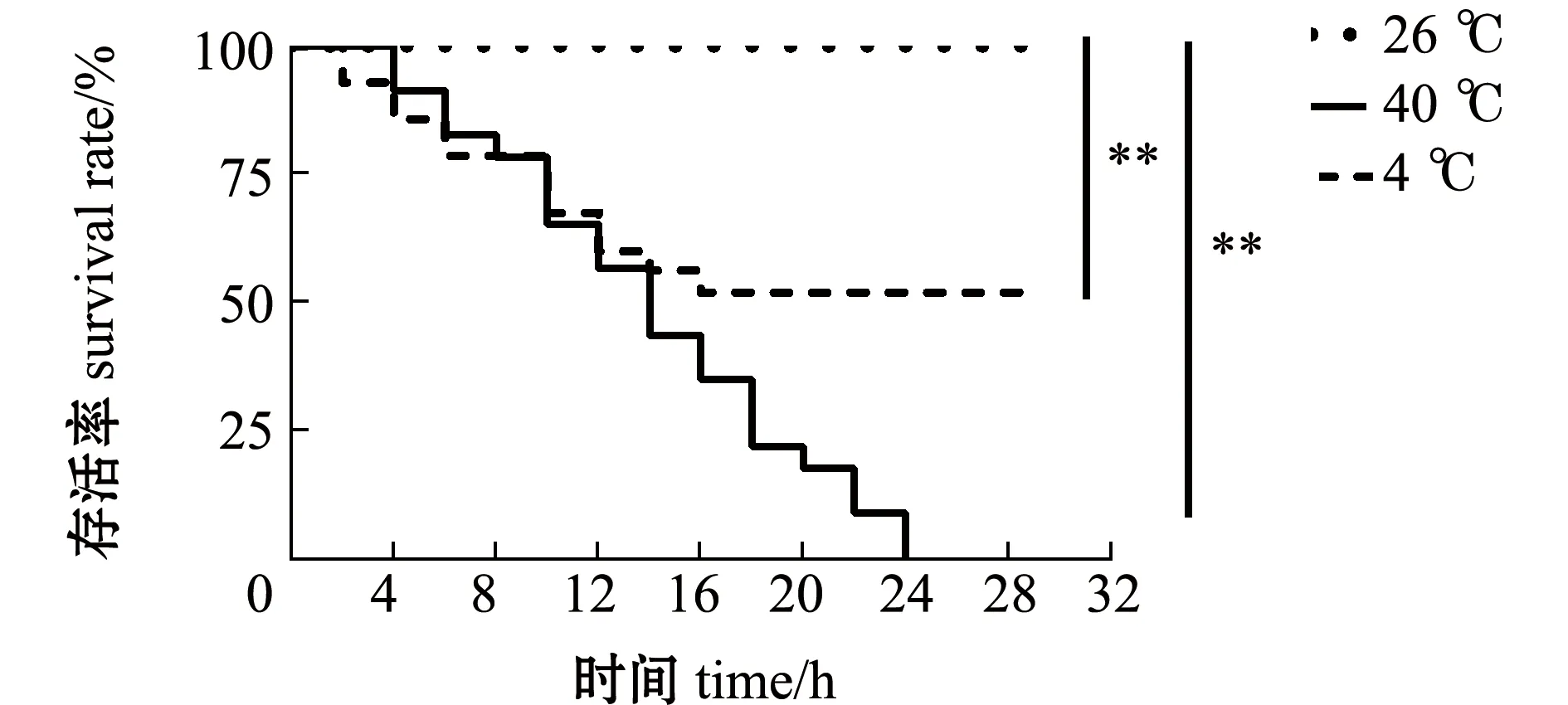
*表示与对照组(26 ℃)有显著性差异(P<0.05);**表示与对照组有极显著性差异(P<0.01),下同。* means significant difference compared with the control (26 ℃)(P<0.05); ** means very significant difference compared with the control (P<0.01),et sequentia.图1 青鳉的温度耐受性生存曲线Fig.1 Survival curve of medaka tolerance to temperature
2.2 不同温度胁迫下青鳉鳃组织凋亡情况
通过TUNEL染色法检测鳃组织的凋亡情况。从图2可见:以最适温度26 ℃的青鳉鳃组织作为对照,高温胁迫12 h时,35 ℃组鳃组织切片上出现零星的绿色荧光,表现出少量的凋亡,40 ℃组鳃组织切片上出现较多绿色荧光,表现出大量凋亡;低温胁迫12 h时,10 ℃组鳃组织几乎无凋亡,4 ℃组鳃组织凋亡最为明显。由此可知,高温和低温胁迫时均会使青鳉鳃组织产生凋亡,并分别在极限温度40 ℃和4 ℃胁迫12 h时凋亡极其显著。
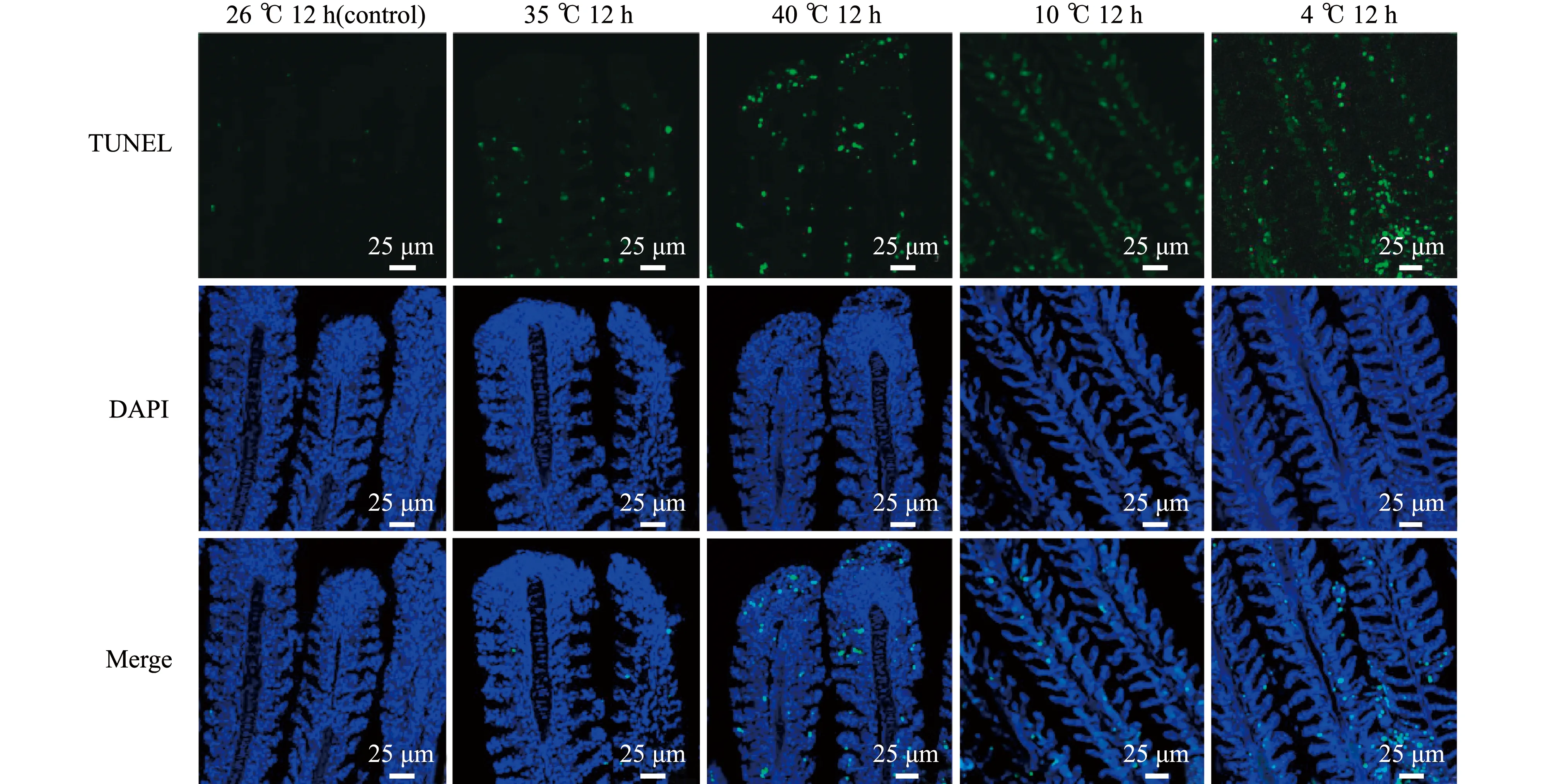
图2 不同温度胁迫下青鳉鳃组织凋亡情况(TUNEL染色)Fig.2 Apoptosis of the gill of medaka exposed to different temperature stresses(TUNEL stain)
2.3 不同温度胁迫下青鳉鳃细胞凋亡情况
通过流式细胞术检测不同温度胁迫下青鳉鳃细胞的凋亡情况,结果如图3(a)~(e)所示。从图3(f)可见:以最适温度26 ℃组青鳉鳃细胞作为对照,高温胁迫12 h时,35 ℃和40 ℃组鳃细胞凋亡均表现出极显著性升高(P<0.01),凋亡率分别为15.7%和21.78%;低温胁迫12 h时,10 ℃组鳃细胞凋亡显著升高(P<0.05),凋亡率为7.06%,而4 ℃组鳃细胞凋亡极显著升高(P<0.01),凋亡率为24.79%。这与青鳉鳃组织TUNEL染色凋亡的检测结果一致。
2.4 不同温度胁迫下青鳉鳃细胞ROS含量
通过流式细胞术检测不同温度胁迫下青鳉鳃细胞的ROS含量。从图4可见:以26 ℃组为对照,在高温胁迫12 h时,35 ℃组青鳉鳃细胞ROS的平均荧光强度(MFI)显著升高(P<0.05),40 ℃组鳃细胞ROS的MFI极显著升高(P<0.01);在低温胁迫12 h时,10 ℃组青鳉鳃细胞ROS的MFI显著升高(P<0.05),4 ℃组青鳉鳃细胞ROS的MFI极显著升高(P<0.01)。这表明,高温和低温胁迫均会引起青鳉鳃细胞ROS含量的积累。
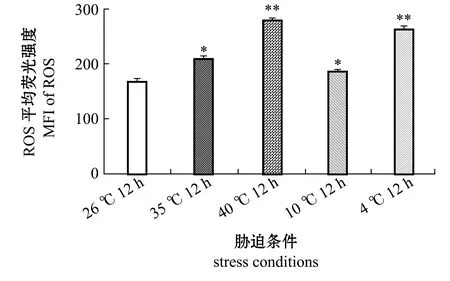
图4 不同温度胁迫下青鳉鳃细胞的ROS含量Fig.4 ROS content in medaka gill cells at different temperature stresses
2.5 不同温度胁迫对青鳉鳃组织凋亡相关基因表达的影响
2.5.1 高温胁迫下青鳉鳃组织凋亡相关基因表达情况 从图5可见:高温胁迫12 h时,35、40 ℃组青鳉鳃组织的p53基因表达量均显著高于26 ℃组(P<0.05),caspase3和caspase9基因表达量极显著高于26 ℃组(P<0.01);35、40 ℃组青鳉鳃组织的caspase1基因表达量均显著低于26 ℃组(P<0.05),40 ℃组青鳉鳃组织的bcl2基因表达量显著低于26 ℃组,而35 ℃组青鳉鳃组织的bcl2基因表达量较26 ℃组有下降趋势但无显著性差异(P>0.05)。这表明,高温胁迫12 h时,青鳉鳃组织的促凋亡基因(caspase3、caspase9、p53)表达均显著上升,而抑凋亡基因(caspase1和bcl2)表达有下降趋势。
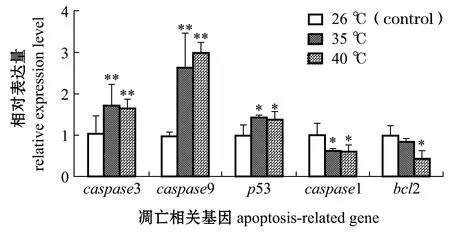
图5 高温胁迫12 h时青鳉鳃凋亡相关基因的表达量Fig.5 Expression levels of apoptosis-related genes in gills under heat stress for 12 hours
2.5.2 低温胁迫下青鳉鳃组织凋亡相关基因表达情况 从图6可见:低温胁迫12 h时,4 ℃组青鳉鳃组织的caspase3、caspase9和p53基因表达量均极显著高于26 ℃组(P<0.01),而10 ℃组青鳉鳃组织的caspase3、caspase9和p53基因表达量较26 ℃组有上升趋势,但无显著性差异(P>0.05);4 ℃组青鳉鳃组织的caspase1和bcl2基因表达量均极显著高于26 ℃组(P<0.01),而10 ℃组青鳉鳃组织bcl2基因表达量显著低于26 ℃组,10 ℃组青鳉鳃组织的caspase1基因表达量较26 ℃组有下降趋势,但无显著性差异(P>0.05)。这表明,低温胁迫12 h时,10 ℃组青鳉鳃组织对凋亡基因的表达影响不大,4 ℃组青鳉鳃组织的凋亡相关基因均表现为极显著上升。

图6 低温胁迫12 h时青鳉鳃凋亡相关基因的表达量Fig.6 Expression levels of apoptosis-related genes in gills under cold stress for 12 hours
3 讨论
水温对鱼类的生长、摄食、生理代谢有重要影响,也是影响鱼类生存的重要环境因子。鳃是鱼类最重要的功能器官,主要参与机体的呼吸、渗透和氮气排泄过程,有利于维持体内的稳态平衡[21]。本研究团队前期对低温应激下斑马鱼和罗非鱼鳃差异凋亡进行了研究,表明鳃组织在冷耐受极限时起到重要作用[6]。前期研究表明,斑马鱼耐温性为7~40 ℃,是探究基础高温响应分子机制较好的试验对象[22]。本研究中,首先对青鳉耐受温度进行了测定,耐受温度为4~40 ℃;之后对高温和低温胁迫下青鳉鳃的凋亡情况进行了研究,发现在低温和高温胁迫下均引起了青鳉鳃发生凋亡和ROS水平的升高,同时凋亡相关基因也发生一定的变化。
3.1 温度胁迫诱导细胞ROS的产生及细胞凋亡
高温、寒冷、低氧等多种外界刺激因子均会诱导ROS的上调进而导致细胞凋亡[23]。研究表明,寒冷诱导大鼠肝细胞凋亡的主要机制是铁离子和ROS的生成[24]。低温刺激使斑马鱼ZF4细胞体内积累大量ROS,导致细胞受到氧化损伤[25]。热应激下ROS产生过多会破坏线粒体膜,最终导致细胞凋亡[26]。本研究中使用流式细胞术对各温度组鳃细胞进行ROS检测,发现无论高温还是低温均发生了ROS的积累,且在极限温度4 ℃和40 ℃胁迫12 h时检测到大量的ROS,这表明,高温和低温胁迫均会促使细胞ROS含量的上升。通过TUNEL染色和流式细胞术对青鳉鳃凋亡检测也发现,高温和低温胁迫会导致青鳉鳃发生凋亡,且在4 ℃和40 ℃胁迫12 h时凋亡极其显著,凋亡率分别为24.79%和21.78%。本研究中发现,在温度胁迫下青鳉鳃细胞ROS的上升趋势与鳃细胞的凋亡程度是相对应的关系,可以推测ROS在温度胁迫诱导凋亡中发挥着重要作用,可能是温度胁迫诱导青鳉鳃细胞产生大量的ROS,从而介导鱼鳃发生细胞凋亡,最终导致鱼体不耐受极限温度而死亡。
3.2 温度胁迫对凋亡相关基因表达的影响
caspase家族基因在细胞凋亡过程中占据着重要地位,直接参与早期凋亡、信号传递和晚期凋亡效应[27]。bcl2是一种原癌基因,具有抑制细胞凋亡的作用[28]。p53是一种抑癌基因,其能激活很多p53靶基因,间接参与DNA损伤的修复,以及细胞衰老、分化和细胞凋亡的调控[29]。凋亡的两种途径——外部死亡受体途径和内在的线粒体途径被广泛认可。其中,内在的线粒体途径是由线粒体中细胞色素c的释放引发的,细胞色素c可以通过含有细胞色素c/Apaf-1/caspas9的凋亡小体来激活下游效应子caspase9和caspase3。caspase3的激活导致一系列蛋白质的裂解,如核小体质之间的蛋白、铁蛋白,并导致细胞凋亡[30]。研究表明,冷应激通过caspase依赖性途径诱导细胞凋亡[31]。高温胁迫阻碍Hela细胞周期,促使p53表达上调,诱导bax基因表达,抑制bcl2基因表达,从而导致细胞凋亡[32]。本研究中,高温胁迫下,青鳉鳃的caspase3、caspase9和p53基因表达随温度的升高显著升高,而caspase1和bcl2基因表达则随温度的升高而显著降低。这表明,高温胁迫导致青鳉鳃细胞发生凋亡,也产生大量的ROS,其凋亡途径可能通过内在的线粒体途径。低温胁迫下,青鳉鳃的caspase1、caspase3、caspase9和p53的表达在4 ℃胁迫12 h时均显著升高,在10 ℃胁迫12 h时未明显升高,bcl2基因的表达在低温胁迫下呈先降低后升高的趋势。这表明,低温10 ℃胁迫12 h时,虽出现少量凋亡但凋亡相关基因表达变化不大,而在临界温度4 ℃胁迫12 h时出现显著性凋亡,且其促凋亡基因和抑凋亡基因均显著升高,这与高温胁迫下凋亡基因表达有所差异,可能是青鳉响应低温与高温的凋亡机制有所不同,这还需进一步探究。
4 结论
1)青鳉对温度的耐受范围较广,其极限耐受温度范围为4~40 ℃。
2)在高温35、40 ℃与低温10、4 ℃胁迫12 h时,青鳉鳃细胞ROS含量与正常温度(26 ℃)相比均出现显著升高。这表明,高温或低温胁迫均会使青鳉鳃发生不同程度的氧化应激。
3)温度胁迫显著影响凋亡相关基因的表达,最终导致青鳉鳃细胞发生明显的凋亡,且在极限温度40、4 ℃胁迫12 h时凋亡极其显著。这表明,在极限温度胁迫下鳃的凋亡程度影响鱼的存活时长,本研究结果可为今后探索鱼类在极限温度下的致死机制研究提供基础数据。

