Mhem/M(Hb)型巨噬细胞极化在动脉粥样硬化病变中的作用
罗之晟 王超 刘家汝 关秀茹
(哈尔滨医科大学附属第一医院检验科,黑龙江 哈尔滨150001)
动脉粥样硬化(atherosclerosis,AS)是大部分心脑血管疾病的病理基础,包括冠心病、心肌纤维化、脑软化以及外周血管疾病等,其发病率呈上升趋势,是全球健康的重大威胁[1]。AS的主要特征是血管内膜的内皮损伤、脂质渗入和炎性反应等共同作用形成纤维斑块,导致管腔变硬、狭窄,引发相应器官的缺血性改变。其中炎性机制贯穿了AS病变起始、进展和并发症形成的全过程,而单核巨噬细胞是其中起关键作用的炎性细胞。巨噬细胞具有高度的可塑性即巨噬细胞的极化,在斑块形成过程中微环境的改变进而刺激巨噬细胞的分化,表达不同的表型[2]。M1型巨噬细胞主要是在斑块早期表达CD36、清道夫受体吞噬脂质,主要发挥促炎作用;M2型巨噬细胞主要是在斑块进展期进行纤维修复、稳定斑块,主要发挥抗炎作用[3]。除了以上两种主要的表型,越来越多的研究发现在斑块中还存在其他表型。比如,由趋化因子4诱导产生,高表达基质金属蛋白酶7和钙结合蛋白(S100A8)的促炎表型M4型[4];Mox型,由氧化磷脂诱导并过表达以核因子E2相关因子2(Nrf2)介导的氧化还原调节基因的促炎表型,主要分泌白介素(IL)-1β等促炎因子以及表现为较低的吞噬和趋化能力[5];另外,还有一种Mhem/M(Hb)型巨噬细胞[Mhem/M(Hb)]。
Mhem/M(Hb)是一种出血相关的新巨噬细胞表型,是对AS斑块内出血所产生的适应性反应机制[6]。而斑块内出血是进展期AS严重继发性病变之一,是促进斑块进展和不稳定性的主要因素。因此,探究Mhem/M(Hb)在斑块内出血所发挥的作用有望成为稳定斑块的替代靶标,并通过调控巨噬细胞极化参与抗AS的治疗[7]。现就Mhem/M(Hb)的自身特点及其在斑块中的来源分布进行阐述,并对比分析其在斑块中所发挥的作用。
1 Mhem/M(Hb)的概念和表达特征
Mhem/M(Hb)是一种针对斑块内出血的特异性替代性活化巨噬细胞亚群,其特征是高表达CD163,在血红蛋白(Hb)-结合珠蛋白(Hp)复合物或血红素(Heme)刺激时巨噬细胞极化形成。主要出现在有内出血的斑块、新生血管和铁负荷等区域,是对相应微环境改变所做出的应答反应[8]。这种亚群是Boyle等[6]在出血性AS斑块中的巨噬细胞表型检查中首次发现,并称为出血性巨噬细胞亚群(HA-mac);随后,其进一步发现HA-mac不同于M1、M2,是一种抵抗AS巨噬细胞状态,因而重新命名为Mhem[9]。同年,Finn等[10]进一步研究分析,发现这一新型巨噬细胞亚群并不是IL-4和出血所诱导形成,而是在血红蛋白复合物刺激作用下分化形成,因此也称为M(Hb)。
Mhem/M(Hb)的主要特征表现在其分子表达上,并发挥着特异性的功能。在AS斑块内,Mhem/M(Hb)的分子表达包括清道夫受体(CD163)、甘露糖受体(CD206)以及人白细胞抗原[6]等,以高表达CD163为主要特征,因此也被称为CD163+型巨噬细胞[11]。CD163也称为M130蛋白,是结合血红蛋白复合物的内吞受体。其结构由9个半胱氨酸丰富的细胞外结构域、1个跨膜段和1个带有内吞信号的胞质内结构组成,特异性表达于单核细胞系细胞中,并高表达于吞噬组织的巨噬细胞中[12]。CD163首次发现是Law等[13]用四种不同的单克隆抗体(Ki-M8、BerMac3、GHI/61和SM4)定义的一种新型人巨噬细胞相关抗原,并命名为M130。Kristiansen等[14]研究发现,Hp-Hb复合物的摄取受体与巨噬细胞特异性表达的急性期调控CD163蛋白相同,表现为结合和清除Hb复合物的功能,这也是CD163首次发现和研究最多的功能。后来,CD163被鉴定为红细胞黏附受体和肿瘤坏死因子样弱凋亡诱导因子(TWEAK)的受体,以及包括细菌和病毒在内的不同病原体的受体,是一种多功能受体并发挥多种作用[15]。
2 Mhem/M(Hb)的来源和分布
Mhem/M(Hb)主要通过吞噬破碎红细胞所释放的Hb/Heme极化而来。在AS斑块早期,动脉内皮受损,脂质沉积,血管中小部分衰老或异常的红细胞渗入内皮;在AS斑块进展期,斑块内新生血管脆弱,通透性低,血管内红细胞渗出,当斑块进一步进展破裂时,形成斑块内出血,大量红细胞释放聚集,斑块碎片以及聚集的红细胞形成血肿或血栓,闭塞管腔或随血流阻塞其他血管[16];同时,在高氧化应激的斑块微环境中,红细胞破碎分解成富含胆固醇的膜脂和Hb,与巨噬细胞活化结合进一步加重斑块中氧化应激和脂质过氧化[17]。其中Hb富含亚铁离子,可氧化生成非氧结合高铁血红蛋白以及过氧化物质等,发生芬顿反应进一步生成氧化自由基,对相应组织造成损伤[18]。
因此,为了中和被释放的Hb毒性,血清中急性反应蛋白Hp以高亲和力与Hb快速结合[14],形成Hb-Hp复合物,刺激巨噬细胞表达CD163受体,在CD163受体的介导下,内吞Hb-Hp复合物,调控相应基因网络,诱导一系列基因的表达差异,极化形成一种新的巨噬细胞亚群。与经典的巨噬细胞相比,Mhem/M(Hb)表现为细胞更小,形态更长,并能诱导一系列不同于M1、M2的基因,调控大约700个独特基因,其中表达的血红素氧合酶-1(HO-1)、三磷酸腺苷结合盒转运体、载脂蛋白E(ApoE)和肝X受体(LXR)等显著增加[19]。
Bengtsson等[20]评估了包含200个颈动脉斑块的大队列中CD163的表达,发现CD163高表达多见于斑块肩区和斑块中心,在斑块表面出现较少;CD163+巨噬细胞首次在斑块内出血区域描述,除此以外,其他富含红细胞如新生血管、铁负荷等区域,也有大量的Mhem/M(Hb)聚集,而在钙化、富含胶原蛋白和CD68表达的区域Mhem/M(Hb)明显减少。
3 Mhem/M(Hb)在斑块中发挥的作用
巨噬细胞具有高度的可塑性,可极化形成多种不同的表型。但这些表型并不是固定的,也不能提前划分为预先分类好的亚群,而是根据所处的微环境以及已激活的细胞内信号通路发挥不同的功能[21]。而Mhem/M(Hb)从首次发现并提出至今,它在AS斑块中发挥的作用存在明显的争议。
3.1 Mhem/M(Hb)的抗AS作用
Boyle等[6]在2009年出血性AS斑块的巨噬细胞表型检查中首次发现一种新的出血性巨噬细胞群(HA-mac),在斑块中发挥抗炎抗氧化的保护作用。通过研究在连续尸检中收集到的斑块,发现并证明了这一亚群可快速清除Hb-Hp复合物,减少活性氧和氧化应激,同时运用非线性建模的方法验证了IL-10/CD163正反馈回路机制,不断自分泌细胞因子(IL-10)而发挥抗炎作用。2012年其在此基础上继续研究,主要探究了Mhem在基因转录水平上的调控,并首次将脂质和铁处理相互联系[9]。Heme刺激转录因子抗体-1(ATF-1)依赖的基因调控网络,共诱导LXR-β和HO-1,共同协调细胞铁的运载和脂质外排[19,22]。同年,Finn等[10]进一步发现了M(Hb)可以通过调节铁代谢以及活性氧(ROS)的生成来减少细胞内胆固醇含量,从而抑制泡沫细胞的形成。其分子机制是巨噬细胞在Hb的刺激下,通过上调膜铁转运蛋白的表达,减少细胞内铁含量,进而产生的ROS减少,这一过程同时激活肝LXR-α介导的胆固醇外流蛋白三磷酸腺苷结合盒转运体A1表达增加以及下调参与脂蛋白摄取的清道夫受体,减少细胞内胆固醇含量。除了直接研究Mhem/M(Hb)在体内外的分子机制与作用外,Gutiérrez-Muoz等[23]探究了缺乏CD163+巨噬细胞对小鼠动脉粥样斑块的影响。通过运用ApoE/CD163双缺陷小鼠模型,与正常对照组相比,实验组表现出更不稳定的斑块表型,脂质含量、斑块大小和促炎细胞因子表达增加,从反面验证了Mhem/M(Hb)的保护作用。
另一方面,CD163作为Mhem/M(Hb)特征性的分子表达,除了作为膜受体介导内吞血红蛋白复合物,研究发现它在人外周血单核细胞的表达较低,而在炎症消退的巨噬细胞中表达明显增高[24],并且在抗AS中也发挥了相应的作用。CD163是肿瘤坏死因子家族分泌的促炎细胞因子TWEAK的清除受体,抑制TWEAK诱导的炎症反应以及炎性细胞的增殖和迁移[25],并与TWEAK相互作用调节缺血损伤后的组织再生[26]。除此以外,CD163已被证明可从细胞表面分裂并脱落,形成一种在血浆中循环的可溶性CD163(sCD163)。Aristoteli等[27]首次证明严重冠状动脉粥样硬化患者血浆中sCD163水平升高,血浆中sCD163水平与冠状动脉疾病的程度相关,可能成为第一类与冠状动脉粥样硬化检测相关的巨噬细胞特异性生物标志物。不仅如此,sCD163也反映了涉及CD163+巨噬细胞的系统性红斑狼疮相关AS炎症[28]。除了在动脉粥样斑块中,CD163+巨噬细胞已被鉴定为肿瘤相关巨噬细胞,与多种恶性肿瘤的不良预后以及转移有关[29]。在巨噬细胞活动相关的炎症性疾病中,可见sCD163血浆浓度升高,是巨噬细胞活化的标志之一,有望成为一个潜在的炎症生物标志物[30]。因此,具有多功能作用的CD163是靶向巨噬细胞的一个良好的药物传送载体[31],比如,CD163作为抗体药物偶联物提高糖皮质激素类药物的抗炎作用[32],用于多种炎症性疾病的治疗。
3.2 Mhem/M(Hb)的促AS作用
随着对Mhem/M(Hb)的深入研究,近来也有研究发现CD163+巨噬细胞可以促进斑块内血管生成、渗漏以及炎症反应,并且与斑块的不稳定有关,表现为促AS的作用,与之前的研究存在争议。Guo等[33]首次研究发现,Mhem/M(Hb)可通过细胞内铁代谢的变化抑制脯氨酰羟化酶2的活性,导致缺氧诱导因子1α(HIF1α)和血管内皮生长因子-A(VEGF-A)/血管内皮生长因子受体2(VEGFR2)信号通路代谢障碍,因此,在斑块内CD163高表达区域,斑块内微血管数量及内皮通透性明显增加;同时周围内皮细胞血管细胞黏附分子(VCAM)表达增加,招募更多的炎性细胞,形成恶性循环促进斑块的进展。并且有研究发现,具有毒性作用的多氯联苯可能是通过Nrf2/HO-1通路促进巨噬细胞向Mhem/M(Hb)的极化进而发挥促AS的作用,间接说明了Mhem/M(Hb)促AS的作用[11]。
除此以外,CD163+巨噬细胞也与易损斑块表型相关,促进斑块的不稳定性。在一个包含200个颈动脉内膜切除术切除斑块的大型队列中进行评估和分析发现[20],CD163蛋白和mRNA在有症状患者斑块和易损指数高的斑块中的表达均较高,并且一些其他的促炎因子和斑块不稳定因子的表达也在Mhem/M(Hb)中发现。比如,斑块不稳定性独立预测因子脂蛋白相关磷脂酶A2 (Lp-PLA2),通过特异性水解低密度脂蛋白中的氧化磷脂产生两种促炎介质,在容易破裂的晚期斑块中,CD163+巨噬细胞通常共表达Lp-PLA2[34];软骨寡聚基质蛋白(COMP)是一种细胞外的基质蛋白,与胶原蛋白、弹性蛋白等形成厚的纤维帽呈负相关,而CD163与COMP共定位并呈正相关,间接促进斑块的不稳定性[35]。并且有学者通过基因表达综合基因芯片分析,鉴定了不稳定斑块与稳定斑块之间的差异表达基因。其中,中心基因之一CD163出现明显上调,可能参与促进斑块的不稳定性[36]。
3.3 小结
Mhem/M(Hb)作为一种出血相关的替代性活化巨噬细胞,一方面,Mhem/M(Hb)能促进胆固醇外流阻止泡沫细胞的分化,形成IL-10/CD163正反馈回路机制[10];另一方面,通过非脂质驱动因素,Mhem/M(Hb)促进血管生成、内皮通透性[33],并共表达一些促炎因子和斑块不稳定因子,增加斑块的进展和易碎性[20]。因此,Mhem/M(Hb)在AS斑块中表现为双向调节作用(图1)。
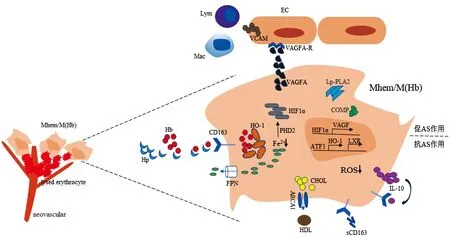
注:neovascular:新生血管;lysed erythrocyte:破裂红细胞;Mac:巨噬细胞;Lym:淋巴细胞;EC:内皮细胞;HDL:高密度脂蛋白。图中抗AS调节作用包括ATF1/HO-1/LXR,增加铁外排和胆固醇外流,减少ROS的产生;分泌IL-10,与CD163形成正反馈通路。促AS调节作用有HIF1α/VAGF/VCAM,增加内皮脆性和通透性,同时招募更多的炎性细胞;CD163与斑块不稳定因子Lp-PLA2、COMP共定位。
4 结语
巨噬细胞极化与AS斑块形成、进展以及不稳定性密切相关,其中Mhem/M(Hb)在AS斑块中表现为双向调节的作用,因此无法定义Mhem/M(Hb)是一种抗AS/促AS的细胞。无可厚非的是,充分利用已发现的内在联系和信号通路,并相应地调节这些分子的表达,从而达到所期望的效果,是目前研究的热点以及有效的治疗方向。一方面,利用Mhem/M(Hb)在斑块中的具有保护作用的机制通路,比如,从葡萄糖苷橄榄苦苷中提取的活性分子Oleacein,通过增加巨噬细胞CD163和IL-10的表达促进Mhem/M(Hb)极化,从而发挥抗炎和抗AS 的作用[37]。另一方面,抑制Mhem/M(Hb)在斑块中发挥促AS斑块进展的关键分子的表达,比如,HIF1α/VEGF-A通路等。总而言之,探究AS斑块中Mhem/M(Hb)的极化开启了研究AS机制和治疗的一扇窗,需继续深入研究与发现。

