蠋蝽病毒Arma chinensis virus-1基因组克隆及序列分析
孙梅雪,张长华,高 强,李 炜,贾芳曌,徐蓬军*,任广伟*
1.中国农业科学院烟草研究所,山东省青岛市科苑经四路11号 266101
2.贵州省烟草公司遵义市公司,贵州省遵义市汇川区人民路341号 563000
3.山东临沂烟草有限公司沂水分公司,山东省沂水县长安中路 276400
蠋蝽(Arma chinensis),又名蠋敌,隶属半翅目(Hemiptera)蝽科(Pentatomidae)益蝽亚科(Asopinae)蠋蝽属(Arma),其成虫和若虫均可捕食黏虫、刺蛾、叶甲、蚧壳虫和蚜虫等40 余种常见害虫[1]。蠋蝽分布较广,国内主要分布于黑龙江、北京、云南、贵州等近20 个省份[2-4]。蠋蝽的食性广、适应性强,可人工规模化饲养,是害虫生物防治的一类重要天敌资源。
蠋蝽最初用于林业害虫的防治,且防效较好[5-6]。近年来,贵州省烟草公司遵义市公司率先建立了蠋蝽繁育基地,构建了蠋蝽规模化繁育技术体系。该技术体系现已成为烟草行业绿色防控重大专项推荐的关键技术之一,并在全国主要烟区进行了示范推广。目前,在蠋蝽的生物学特性[7]、捕食能力、人工饲料和规模化繁育技术等方面已有较为完善的研究。唐艺婷等[8]研究表明蠋蝽5 龄若虫和雌虫对斜纹夜蛾具有较好的捕食能力。人工饲料在蠋蝽规模化饲养过程中起着至关重要的作用,邹德玉等[9-10]通过对饲喂人工饲料的蠋蝽和饲喂柞蚕蛹的蠋蝽分别进行转录组测序分析,发现了一些与营养相关的代谢途径和差异表达基因,获得了更多关于人工饲料配方的信息反馈。就饲养密度而言,雷庭等[11]研究表明室内饲养蠋蝽应严格控制饲养密度,密度过高会导致种群自残,产卵前期推迟,产卵量降低。然而,蠋蝽规模化繁育时常出现蠋蝽因染病导致个体大量死亡的问题,严重威胁蠋蝽的规模化生产及推广应用,但有关蠋蝽病原物方面的研究还鲜见报道。为此,本研究中采用高通量测序技术在蠋蝽体内鉴定出一种新病毒,将其命名为Arma chinensis virus-1(AcV-1),并分析了AcV-1 的基因组序列,旨在明确其基因组结构特征及遗传进化情况,为蠋蝽病原物防控提供依据,从而提高蠋蝽成活率,为蠋蝽规模化繁育提供技术支撑。
1 材料与方法
1.1 材料
供试蠋蝽样品于2019 年5 月采自贵州省烟草公司遵义市公司天敌繁育基地(27.45°N,106.53°E)。收集的蠋蝽样本(200 头)包括若虫和成虫(每个时期各100 头),样本保存于中国农业科学院烟草研究所。
1.2 方法
1.2.1 文库的构建
每10 头蠋蝽为一组,在液氮下混合研磨,每组取0.1 g 粉末置于1.5 mL 无菌无酶离心管中,加入1 mLReagent(美国Thermo Fisher 公司),剩余粉末储存于-80 ℃冰箱备用。加入TRIzol™Reagent 的样品4 ℃12 000 r/min 离心5 min,将每份样品中的50 μL 上清液混合在一起提取总RNA。用Oligo(dT)(美国Thermo Fisher 公司)提取mRNA,然后在片段化缓冲液(美国Thermo Fisher 公司)中将mRNA 剪切成短片段。随后,使用TruSeq RNA Sample Prep Kit(美国Thermo Fisher 公司),参照其说明书,用合适的插入片段[约(200±50)bp]构建文库。使用Illumina HiSeq™仪器(美国Illumina 公司)对样品进行RNA-seq 分析[12]。
1.2.2 组装和注释
使用Illumina HiSeqTM仪器进行测序时,选择成对末端和读取长度为150 nt 的选项,而不选用链特异性选项。使用Trinity 2.0.6 修剪接头,舍弃低质量读取并使用清晰高质量读取从头组装[13],使用BLASTx(E-value ≤1×10-5)将组装的重叠群与非冗余蛋白质数据库、STRING、Swissprot 和KEGG 比对,进行功能注释。
1.2.3 病毒检测、基因组扩增
(1)RNA 提取和反转录
取储存于-80 ℃冰箱的蠋蝽粉末样品0.1 g 于1.5 mL 无菌无酶离心管中,加入TRIzol™Reagent混匀,用于提取总RNA,具体操作参照说明书进行。提取的RNA 用50~100 μL DEPC 水溶解,检测RNA 浓度和纯度后,置于-80 ℃冰箱中保存。
(2)AcV-1 基因组扩增
根据RNA-Seq 得到的AcV-1 基因组已知序列,设计7 对特异性引物(表1),以反转录产物cDNA 为模板进行PCR 扩增,各片段扩增体系:TaKaRa LA Taq 0.5 μL、10×LA Taq Buffer II(Mg2+Plus)5 μL、dNTP Mixture(2.5 mM each)8 μL、上下游引物各1 μL、cDNA 2 μL、ddH2O 32.5 μL,总体积50 μL。扩增条件:94 ℃5 min;94 ℃30 s,55 ℃30 s,72 ℃1.5 min,循环35 次;72 ℃7 min。AcV-5R 和AcV-3F1/AcV-3F2分别用于5′和3′cDNA 末端快速扩增(Rapid amplification of cDNA ends,RACE),使用SMARTer®RACE 5′/3′Kit(美国TaKaRa 公司),按照产品说明进行实验。上述PCR 产物于1.0%琼脂糖凝胶中电泳检测,目的片段参照EasyPure®Quick Gel Extraction Kit[全式金(北京)生物技术有限公司]说明进行切胶回收。回收目的片段与载体pEASY-T1 25 ℃连接30 min,热激法转化大肠杆菌DH5α感受态细胞,涂布于含氨苄青霉素(Ampicillin,Amp)的培养基过夜培养,挑取平板上的克隆进行菌落PCR,将PCR 结果中大小正确条带对应的菌液样品送上海派森诺生物科技股份有限公司进行序列测定。

表1 AcV-1 基因组扩增引物Tab.1 Amplificɑtion primers used for AcV-1 genome
1.2.4 基因组结构分析及系统发育分析
序列测定完成后,根据扩增引物去除两端的载体序列,通过拼接获得AcV-1 的基因组序列。使用ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)搜索病毒基因组的ORF,用Clustal W软件来比对核苷酸序列和氨基酸序列,用NCBI 保守域搜索预测保守域。使用BLAST(http://www.ncbi.nlm.nih.gov/BLAST/)进行序列多重比对及同源性分析。将获得的新病毒基因组序列与双顺反子病毒科(Dicistroviridae)目前接受的15 种双顺反子病毒的相应氨基酸序列进行比对,用MAGE-X软件进行聚类分析并构建系统发育树[14],采用邻接 法(Neighbor-joining,NJ)分别构建ORF1 和ORF2 预测氨基酸的系统发育树,距离模型选择差异位点比例(p-distance),并使用自举法(Bootstrap)1 000 次进行稳定性检验;采用最大似然法(Maximum likelihood,ML),以隶属伴生豇豆病毒科(Secoviridae)的水稻东格鲁球状病毒(Rice tungro spherical virus)、欧防风黄点病毒(Parsnip yellow fleck virus)和隶属传染性软腐病病毒科(Iflaviridae)的褐飞虱蜜露病毒-2(Nilaparvata lugens honeydew virus-2)为外群(Outgroup),构建保守结构域RdRp 的系统发育树,其可信度使用1 000 次自举重复验证。
2 结果及分析
2.1 蠋蝽中AcV-1 高通量测序
RNA-Seq 数据提交到NCBI Sequence Read Archive(SRA)数据库(登录号:SRR10098905)。通过RNA-seq获得了60亿个碱基,总共产生了27 058个重叠群,其中包括21 972 个单基因。通过功能注释的方法,发现了一个组装的重叠群(长度为9 176 nt),通过Blast 分析,发现其与蟋蟀麻痹病毒(Cricket paralysis virus,CrPV)分离物CrPV-3(GenBank:KP974707.1)全基因组的核苷酸序列相似性达89.4%,将该重叠群命名为AcV-contig1。
2.2 AcV-1 基因组序列分析
成功扩增了AcV-1 基因组的3′端和5′端(图1a、图1b),拼接后得到的AcV-1 基因组序列长度为9 192 nt[不包含Poly(A)],碱基组成分别为33.3% A、27.6% T、18.2% C、20.9% G(图1c)。该序列已上传至GenBank(登录号为MW846634)。拼接的AcV-1 病毒基因组序列与RNA-seq 获得的序列相比无碱基变异,但在5′端多出25 个碱基,另外,可能由于RNA-seq 测序拼接的问题,3′端存在2 个碱基的缺失。基因组序列与CrPV(GenBank:KP974707.1)的结构和长度相似,其中核苷酸相似性最高达89.40%,表明本研究中获得了含有完整读码框的AcV-1 基因组序列。该病毒基因组包含2 个非重叠的ORFs,ORF1 含有5 316 个核苷酸,该ORF 起始于717 nt,终止于6 032 nt,分子质量为203.68 kDa,pI 为6.67,编码一个长度为1 771 个氨基酸的非结构蛋白,包含3 个保守结构域,分别是依赖RNA 的RNA 聚合酶(RNA-dependent RNA polymerase,RdRp)、蛋白酶(Protease,P)、RNA 解旋酶(RNA helicase,HEL)。对ORF1 推导出氨基酸序列进行BLASTp 分析,结果表明其与双顺反子病毒(Dicistroviruses)和微小核糖核酸病毒(Picorna-like viruses)的非结构蛋白关系较近,其中与CrPV 的非结构蛋白(UniProtKB/Swiss-Prot:AKA63263.1,相似性97.74%,覆盖率100%)的相似性最高。ORF2含有2 529个核苷酸,该ORF起始于6 384 nt,终止于8 912 nt,分子质量为94.3 kDa,pI 为7.2,编码一个包含842 个氨基酸的结构蛋白,包括蟋蟀麻痹病毒样衣壳蛋白、蟋蟀麻痹病毒VP4 衣壳蛋白以及两个小核糖核酸病毒样衣壳蛋白。2 个ORFs 中间由一个长度为351 nt 的基因间隔区(Intergenic region,IGR)隔开,其两端为非翻译区(Untranslated regions,UTRs),5′和3′非翻译区分别含有716个和280个核苷酸,且3′端具有Poly(A)尾。BLASTp 分析表明,ORF2 同样也是与双顺反子病毒和微小核糖核酸病毒关系较近,其中与CrPV 的结构蛋白(UniProtKB/Swiss-Prot:AKA63264.1,相似性93.70%,覆盖率99%)的相似性最高。
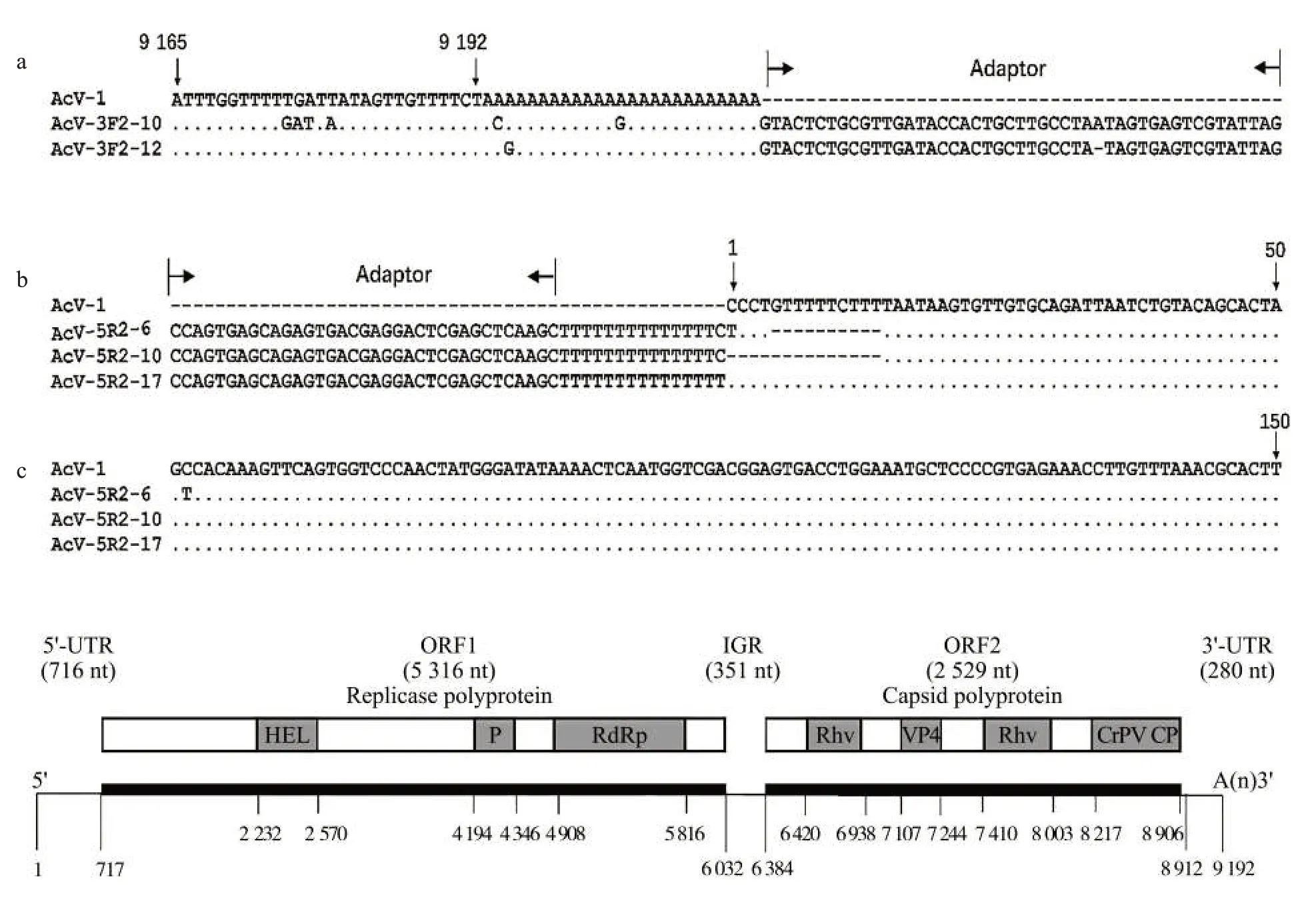
图1 AcV-1 基因组3′端/5′端扩增及基因组结构分析Fig.1 Amplification of the 3′/5′ends and structural analysis of AcV-1 genome
2.3 AcV-1 系统发育分析
通过Blastp 对推导的ORF1 和ORF2 氨基酸序列进行同源性分析,结果显示其与双顺反子病毒科中的CrPV 具有高度相似性。采用系统发育分析方法对推导的ORF1、ORF2 以及RdRp 的氨基酸序列进行了系统发育分析,进一步确定AcV-1 和双顺反子病毒科之间的关系。
采用最大似然法构建保守结构域RdRp 的系统发育树时,应首先对模型进行选择,经过筛选,此次分析选择贝叶斯信息标准得分最低的LG+伽马分布(Gamma distributed,G)模型。基于RdRp的ML 树表明,AcV-1 与褐飞虱C 病毒(Nilaparvata lugens C virus,NLCV)聚集在一起,但自举值(54,图2)较低,而基于ORF1 和ORF2 的氨基酸序列的NJ 树表明,AcV-1 与CrPV 聚集在一起且具有较高自举值(分别为100 和81,图3a、图3b)。

图2 基于RdRp 的ML 树Fig.2 Maximum-likelihood(ML)tree based on RdRp
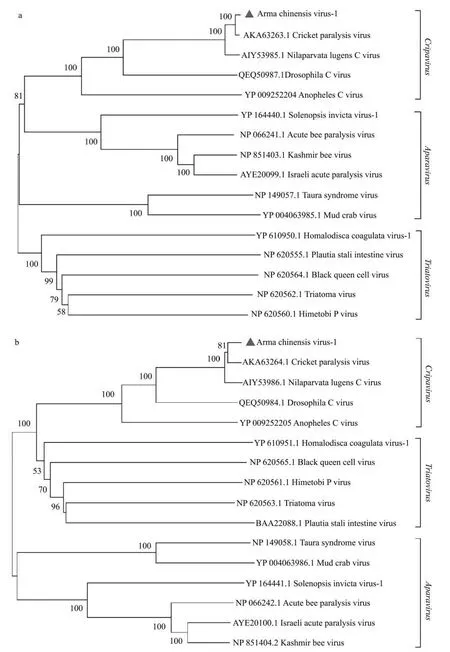
图3 基于ORF1/ORF2 的NJ 树Fig.3 Neighbor-joining(NJ)tree based on ORF1/ORF2
2.4 不同来源蠋蝽感染AcV-1 情况检测
利用特异性引物AcV-1-F/AcV-1-R(AcV-1-F:CACAGGGGATTTTACTGAAGG,AcV-1-k:CGTC GGGTGTACCTGTAGAAA;扩增片段长度为725 bp)通过RT-PCR 方法对供试蠋蝽样品中AcV-1 侵染情况进行检测。结果表明,146 份样品中,55 份样品呈AcV-1 阳性,即感染率为37.67%(表2)。
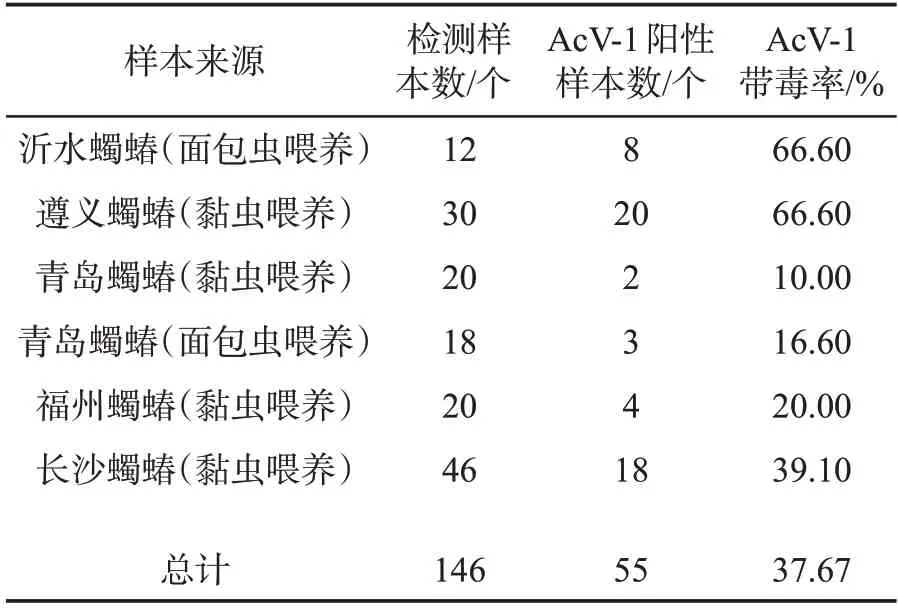
表2 不同来源蠋蝽感染AcV-1 情况检测Tab.2 Infection rates of AcV-1 in Arma chinensis from different sources
3 讨论
本研究中利用RNA-seq 测序技术在蠋蝽体内发现的AcV-1 是一种新双顺反子病毒。双顺反子病毒是一类小型无包膜RNA 病毒,此类病毒含有一个长度约8~10 kb 的正义单链RNA 基因组[15]。双顺反子病毒科分为3 个属:蜜蜂急性麻痹病毒属(Aparavirus),蟋蟀麻痹病毒属(Cripavirus)和吸血猎蝽病毒属(Triatovirus),该分类基于IGR-IRES表现出的系统发育差异和独特特征[16-17],通过病毒蛋白衣壳和RdRp 的系统发育分析也支持了这种分类[18]。蠋蝽病毒AcV-1 基于ORF1 和ORF2 氨基酸序列的NJ 树表明,该病毒与CrPV 聚在一起,而基于RdRp 氨基酸序列的ML 树表明,其与NLCV 聚在一起。上述聚类分析结果表明AcV-1与CrPV、NLCV 具有很高的同源性,但又不尽相同,推测其为蟋蟀麻痹病毒属的一个新成员。
利用检测引物AcV-1-F/AcV-1-R 检测146 份蠋蝽样本,其中有55 份样本呈阳性,即感染率为37.67%。昆虫与病毒之间存在多种互作关系,可以将这些互作关系分为3 大类:致病、共生和潜伏侵染[19-21],科学利用寄主与病毒之间的关系,有益于农作物病虫害绿色防控技术的发展。目前AcV-1 的功能尚不清楚,通过带毒蠋蝽成活率及系统发育分析结果,推测该病毒可能无致死功能,但其对蠋蝽生长发育和生殖是否有显著影响及其与蠋蝽的互作机制尚待进一步研究。若为有害病毒,可根据其传播途径等构建防控技术体系;若为有益病毒,可进一步加以利用,为蠋蝽商业化应用奠定基础。
4 结论
本研究中在蠋蝽体内发现了一种新的双顺反子病毒,并将其命名为Arma chinensis virus-1(AcV-1)。该病毒含有完整读码框的基因组序列,长度为9 192 nt(不包含Poly A),包含2 个ORFs。ORF1 编码非结构蛋白,包含3 个保守结构域,分别是RdRp、蛋白酶和RNA 解旋酶;ORF2 主要编码衣壳蛋白。

