自由基级联反应调控策略在重大疾病防治中的应用
毕郑妍, 刘艳岚,2
(1.湖南大学 化学化工学院, 长沙 410082; 2.湖南大学 分子科学与生物医学实验室化学/生物传感与化学计量学国家重点实验室 湖南省适配体工程中心, 长沙410082)
0 引 言
1956年,Harman提出衰老的自由基学说,认为衰老过程中的退行性变化是由细胞正常代谢过程中产生的有害自由基导致的。自由基主要是机体内氧化还原反应过程的中间产物,也可由外界紫外线照射和电离辐射等因素诱发产生。其反应活性高,可使细胞中的多种物质发生氧化,损害生物膜,还能够使蛋白质和核酸等大分子交联或变性,甚至引起DNA损伤导致突变,从而诱发癌症的发生和发展。
在正常生理情况下,体内自由基不断产生,同时也受人体内抗氧化防御系统(如氧化物歧化酶和维生素等)的严格调控,从而维持自由基代谢平衡,保持人体各种机能的正常运行。然而,内防御机制失衡或者外界的一些有害刺激常引起自由基平衡失调,导致自由基的过度积累,对各种生物分子(如DNA、脂质和蛋白质)造成损害,以及招募许多炎症介质,进而引发衰老、自身免疫性疾病、心血管和神经退行性疾病等许多氧化应激相关疾病。此外,自由基的过度增加与癌症的发生和恶化也密切相关。因此,从自由基稳态调节方向入手治疗相关疾病是一种行之有效的策略。
本文首先概述了自由基在体内的产生和代谢,随后对自由基的两种调控机理及本课题组在相关疾病治疗方面的工作进行介绍,最后展望了该领域发展的方向和可能面临的挑战。
1 自由基简介
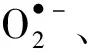
1.1 自由基的产生和代谢
1.1.1 反应活性氧(Reactive oxygen species, ROS)
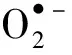
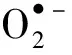
1.1.2 反应活性氮(Reactive nitrogen species, RNS)
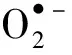
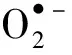
1.2 自由基级联信号调控与疾病治疗
自由基是把双刃剑,体内自由基稳态失调会导致细胞损伤和机体病变,因此,利用抗氧化剂清除自由基维持氧化还原稳态至关重要;此外,有效利用自由基也可以杀害癌细胞进行癌症治疗。尽管癌细胞微环境自由基水平较高,独特的自防御机制也导致其具有较高的耐受能力,但当产生的自由基水平超过细胞承受能力时,仍然可以有效杀死癌细胞,基于此原理的化学动力疗法在癌症治疗领域备受瞩目。
1.2.1 自由基与氧化应激
ROS和RNS都是体内重要的自由基,在生物体内作为代谢产物和信号分子,在正常的细胞代谢和受到环境刺激时产生[13-14]。这些物质通常含有孤对电子,容易与其他分子发生氧化还原反应[15],参与调节人体内各种生理过程[16-17],也有助于对抗病原体及其诱导的感染[18]。通常,由于过量ROS/RNS具有显著的细胞毒性,这种氧化过程受到细胞抗氧化防御机制的严格控制。当ROS、RNS和抗氧化防御之间的平衡被破坏时,就会产生氧化应激,导致氧化还原稳态失调,可通过急性ROS/RNS生产过剩或慢性ROS/RNS积累表现出来。由于ROS和RNS受到不同信号的调控,其过量产生将导致细胞内信号的级联改变,引起多种细胞功能障碍,如能量代谢功能失调、细胞信号和细胞周期控制的改变、细胞运输机制受损、免疫激活或抑制以及炎症[19],甚至诱发细胞死亡等对机体造成损害的连锁反应,因此,与许多疾病的发生和发展密切相关[10]。
目前,氧化应激相关疾病治疗和自由基调控主要分为两个方面:一方面,过量的自由基引起氧化损伤,导致神经退行性疾病和多种代谢性疾病等,因而利用抗氧化剂增加自由基清除能力,可以消除自由基信号异常并抑制疾病发展,这被称为抗氧化治疗;另一方面,自由基的产生与癌症的发生和发展密切相关,癌细胞微环境相比正常细胞通常具有更高的自由基水平,这种不同的氧化还原调节机制引导了一个新的治疗方向,即产生更多的自由基使其超过癌细胞耐受水平而杀死癌细胞,称为促氧化治疗。
1.2.2 抗氧化治疗
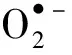
近年来,抗氧化纳米材料由于具有诸多优势引起了广泛关注[2],包括:(1)可以显著提高天然抗氧化剂的抗氧化稳定性及其药物动力学,保护这些试剂免受环境氧化/还原和酸的侵蚀;(2)许多纳米材料本身具有酶活性,相比于天然酶和小分子来说具有更高的催化效率和更强的环境耐受性;(3)对多种自由基,特别是次级ROS/RNS,具有强大的清除能力,可提供更广泛有效的抗氧化防御;(4)可以通过功能集成,合成多功能、诊疗一体化抗氧化纳米药物,有望实现个性化治疗。大量研究证明,纳米材料在体内和体外都具有强大的抗氧化和抗炎活性,但抗氧化纳米材料的临床开发仍处于早期阶段。在未来的临床应用研究中,仍需从给药途径、体内生物相容性、药代动力学、生物分布与代谢以及最终病理后遗症的表达等方面深入评估现有和新兴的大量抗氧化纳米材料。
1.2.3 促氧化治疗
癌症的一大重要特征是,癌细胞含有更多的ROS和RNS等自由基,并且对自由基水平升高更为敏感,这引起了人们的广泛关注[21]。传统化疗药物如阿霉素(DOX)和As2O3,其促氧化治疗机制是在癌细胞中特异地产生ROS杀死癌细胞。然而,目前大多数化疗药物和放疗都具有不可避免的副作用。精确和特异性调节癌细胞中ROS及其他自由基水平顺理成章地成为提高治疗效果同时减少副作用的关键。因此,肿瘤微环境(Tumor microenvironment, TME)这一与靶向策略密切相关的重要因素得到了深入研究。TME的主要特征是弱酸性、缺氧、血管异常、过氧化氢和谷胱甘肽生产过剩、消耗大量营养物质等[22-23]。基于此,复旦大学步文博课题组提出了一种将TME和Fenton反应相结合的新的治疗方法——化学动力治疗(Chemodynamic therapy, CDT)[24],通过Fenton反应可以生成•OH特异性靶向癌细胞,反应机理如式(1)和式(2)所示。实现高效的Fenton反应需要两个关键条件,即大量的H2O2和最适的pH(2~4)。
Fe2++ H2O2→Fe3++•OH + OH-
(1)
Fe3++ H2O2→Fe2++ HO2+ H+
(2)
与其他癌症治疗策略如化疗、放疗、光热治疗(PTT)、光动力疗法(PDT)和声动力疗法(SDT)相比,CDT的优势包括:特异性更高、不受外场穿透深度的限制、对正常组织副作用较低、生成更高水平的ROS以及无设备限制、非多药耐药,在临床上显示出良好的发展前景[25]。然而,TME的pH(6.5~6.8)和H2O2浓度等难以满足Fenton反应的需要。为了克服这一障碍,目前的研究主要集中在设计不同的纳米材料[26-28]、原位降低反应的pH[29-30]、原位生成H2O2[31]或消耗GSH[32],以及引入物理场和化学场等方面,以期显著提高Fenon反应效率,进而增强CDT疗法的功效。
针对抗氧化和促氧化方法调控自由基级联信号的机理和现状,本课题组研究开发了新的材料和方法以促进相关疾病治疗的发展,包括将抗氧化黑色素纳米材料用于缺血性脑损伤和人工DNA编码器用于特定治疗肥胖疾病;以及利用非晶态氧化铁RNA干扰纳米平台和适体-前药偶联物解决了化学动力疗法面临的部分问题并成功应用于促氧化癌症治疗。
2 自由基清除与抗氧化治疗
2.1 抗氧化黑色素纳米颗粒的抗氧化机制及其在缺血性脑中风方面的防御研究
缺血性脑损伤的机制众说纷纭,近年来广受关注的自由基学说认为自由基通过攻击细胞膜上的多聚不饱和脂肪酸(PUFA)引发一系列反应,造成细胞损害和死亡。在正常生理状态下,人体内存在自由基代谢酶等内源性抗氧化剂,使自由基处于稳态,不易引起损伤。但是脑部缺血后增多的自由基会大量消耗抗氧化剂,导致抗氧化防御系统不能及时清除自由基,引起氧化应激损伤。因此,清除脑部由于栓塞过程导致的过量自由基被认为是保护脑损伤的一个重要手段。
人体内的天然抗氧化剂具有一定的局限性,如无法及时响应突然升高的自由基水平、不存在特定靶向次级ROS/RNS的内源性酶等,一系列抗氧化纳米材料由于其抗氧化稳定性以及对次级ROS/RNS(如•OH和ONOO-)强大的清除能力等诸多优势引起了研究人员广泛的兴趣,但其对人体健康具有潜在的不良影响,如对免疫细胞的激活和存在基因毒性;大多数抗氧化纳米材料具有较差的生物相容性,这对其应用于治疗脑部损伤造成了阻碍,目前并没有抗氧化剂通过临床验证能够安全有效地保护缺血脑免受氧化损伤。
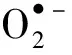

图1 (a)PEG-MeNPs的TEM图像;(b) 有/无PEG-MeNPs时100 μmol·L-1 KO2溶液中O2生成量,插图是加入KO2 前后的PEG-MeNPs溶液;(c) RONS代谢示意图及PEG-MeNPs清除•OH, •NO, ONOO-的作用;(d)不同组 (Saline:生理盐水组,NP-treated:PEG-MeNPs处理组,Sham:假手术组)对应2,3,5-氯化三苯基四氮唑(TTC)染 色脑切片的代表图;(e、f)三组相应的梗死面积和脑组织中水平(与生理盐水对照组相比,*p < 0.05, **p < 0.01)。引自参考文献[35]Fig.1 (a) TEM image of PEG-MeNPs; (b) O2 production from the KO2 solution (100 μmol·L-1) with vs. without PEG-MeNPs, the inset is the digital picture of the PEG-MeNPs solution before vs. after addition of KO2; (c) Schematic illustration of RONS metabolism and •OH, •NO, ONOO- scavenging effect of PEG-MeNPs; (d) Representative images of TTC-stained brain slices from different groups. The corresponding (e) infarct areas and (f) levels in brain tissues of the three groups (*p < 0.05 and **p < 0.01 vs. saline control). Reprinted with permission from reference [35]
2.2 人工DNA编码器的构建用于调控自由基级联反应和肥胖治疗
肥胖是一种多因素的慢性代谢性疾病,可增加糖尿病、高血压、非酒精性脂肪肝、癌症以及心血管和神经系统疾病等多种疾病的患病风险,被认为是世界范围内最严重的公共健康问题之一。肥胖病理学的最新进展表明,由代谢组织中各种活性氧和活性氮(RONS)的产生和积累引起的氧化应激是肥胖发病和进展的共同特征和核心机制之一。这种不平衡的氧化还原稳态协调级联适应性免疫反应,包括活化常驻白细胞和招募炎症细胞,释放炎性因子和更多的自由基,从而导致氧化损伤和炎性反应加剧的恶性循环,进一步促进脂肪形成并诱发许多并发症[36]。显而易见,选择性调节氧化应激有望成为治疗肥胖相关疾病的一个通用方法。


在正常生理状态下,人体内存在的抗氧化网络能够严格控制自由基级联反应(FRC),通过复制-转录-翻译(对应信息的发射、传播和接收)等分子通讯过程表达抗氧化剂,维持细胞氧化还原平衡,保护细胞免受氧化损伤[37-38]。然而,这种由基因组介导的分子通讯受到耗时、信息传递不充分、无法解码一些高活性自由基(•OH)等限制,不能有效和及时地解码肥胖疾病发生时复杂的FRC,因此,开发新的实时自由基解码器至关重要。然而到目前为止,临床上还没有抗氧化剂被用于治疗与肥胖相关的疾病。
针对基因组介导的分子通讯过程面临的问题,本课题组提出了一种基于DNA框架结构的人工DNA编码器,用于调控脂肪化过程中自由基级联反应,如图2(a)所示。考虑到对肥胖疾病特定和靶向治疗的有效性和必要性,选择一个能特异性识别脂肪细胞的适配体序列作为接收器,单宁酸(TA)作为效应器。TA是一种天然的小分子,具有广泛的生物学功能,包括抗氧化和抗炎症。利用滚动循环复制(RCR)和密集包装驱动的DNA组装方法,合成了能够解码多种复杂自由基级联信号的人工DNA编码器TADN[39]。在RCR过程中,通过适配体介导的分子识别,收发器模块使编码器能够主动感知环境压力下FRC失调的目标细胞。一旦被识别,内部即时可用的效应器直接作用于失调的FRC以清除过量的自由基,而不需要耗时的复制-转录-翻译过程来产生抗氧化酶。另外,相比基因组DNA编码产生的酶,该人工DNA编码器对各种自由基具有更广泛的清除活性如图2(b)所示,而且基于DNA框架的通道可以有效防止恶劣环境对效应器活性的负面影响,从而保障通信的稳定。此外,验证了人工DNA编码器在体内的主动传感和驱动作用。结果表明,该编码器可以通过重组由脂肪生成驱动的失调FRC和代谢,同时阻碍自由基与炎症网络之间的有害通讯,协同抗肥胖治疗,如图2(c)~图2(e)所示。

图2 (a) 基于DNA框架的人工DNA编码器的结构示意图、基于自然基因组DNA系统和人工DNA编码器介导自由 基级联(FRC)的潜在分子通讯机制;(b)TADN对H2O2、1O2和ONOO-清除作用的荧光分析;(c) 静脉注射 TADN或非靶向NTADN人工DNA编码器后,正常饮食(ND)或HFD(高脂饮食)小鼠的时间依赖性全身荧光 成像和(d)不同器官的荧光成像;(e)静脉注射PBS、TADN、非靶向NTADN或游离TA的典型ND/HFD小鼠的 图片。引自参考文献[39]Fig.2 (a) Schematic illustration of the structure of the DNA framework-based artificial DNA encoder and the underlying molecular communication mechanisms mediated by natural genome DNA-based system and the artificial DNA encoder towards the free radical cascade (FRC); (b) Fluorescence analysis of the scavenging efficacy of TADN towards H2O2, 1O2, and ONOO-; (c) Time-dependent whole-body fluorescence imaging of normal diet (ND) or HFD-fed mice after intravenous injection of TADN or NTADN artificial DNA encoder; (d) Fluorescence imaging of different organs harvested from these three groups in panel (b); (e) Digital picture of representative ND/HFD-fed mice that received iv injection of PBS, TADN, NTADN, or free TA. Reprinted with permission from reference [39]
3 放大自由基级联信号用于癌症治疗
与上述自由基调控机理相反,基于Fenton反应机理的化学动力疗法,通过产生高毒性自由基来杀死恶性细胞,这种促氧化疗法在癌症治疗上也备受关注。越来越多的证据表明,与正常细胞相比,许多类型的癌细胞都表现出ROS水平的升高[21]。由于细胞内自由基的产生增加或对自由基的清除能力下降,会导致氧化还原稳态被破坏,这种内在的氧化应激常常被视为恶性事件,癌细胞的异常生长也与活性氧及其他自由基的增加有关。然而,由于过度水平的自由基应激对细胞有毒,外源性药物诱导产生自由基时,氧化应激增加的癌细胞可能更容易受到伤害。因此,通过氧化还原调节自由基水平可能是一种选择性杀死癌细胞而不会对正常细胞造成显著毒性的方法。
3.1 RNA干扰策略用于放大自由基反应及癌症靶向治疗
在特异性调节癌细胞自由基稳态上,CDT展现了良好的前景。目前,CDT方法主要依赖于内源性过氧化氢(H2O2)通过经典的Fenton或Haber-Weiss化学转化为高毒性羟基自由基[7]。然而,由于有效的化学反应需要强酸性,以及肿瘤H2O2不足和上调抗氧化防御以对抗自由基引起的氧化损伤,CDT的抗癌效果受到极大的限制。因此,研究人员开发了很多策略,对pH和H2O2等肿瘤微环境进行调节以满足CDT反应的需要。
肿瘤微环境的重要特征之一是缺氧,在缺氧状态下,癌细胞的代谢途径可能会重塑,通过平衡生物合成过程和快速生产大量的ATP以支持细胞增殖,因而在原发性和转移性肿瘤中会观察到有氧糖酵解或“瓦伯格效应”[40]。糖酵解的高速率引起乳酸的过量生成,这导致单羧酸转运体(MCTs)的上调[41],与该过程相关的主要是MCT4,其控制乳酸/H+的流出,维持稳定的细胞内pH并诱导细胞外环境的微酸化(pH 6.5~6.8)。MCT4表达升高与许多癌症的转移、血管生成、预后不良和复发有关[42]。因此,假设沉默MCT4基因可以阻止癌细胞内乳酸的外排,使细胞内pH降低,从而增强Fenton反应效率。
结合RNAi策略,开发了一个非晶态氧化铁纳米颗粒(AIO NPs)平台(图3(a)和图3(b))有效递送靶向MCT4的小干扰RNA(siRNA),用于沉默MCT4的表达[29]。AIO NPs对siRNA的有效封装避免其与酶接触而被降解,同时利用AIO NPs酸性响应特点释放铁离子,与癌细胞内的H2O2通过类Fenton反应产生高反应性和毒性的•OH,促进内涵体逃逸并显著加剧肿瘤细胞的氧化应激,进而导致细胞凋亡。更重要的是,MCT4基因沉默后可以诱导癌细胞内的H2O2含量上升,结合细胞内由于MCT4沉默导致的乳酸积累,Fenton反应的效率大幅度提高,从而高效地杀伤癌细胞。
在荷瘤小鼠模型中,通过将NPs静脉注射到PC3荷瘤小鼠中,检测了AIO RNAi NPs的体内基因沉默效果。图3(c)~图3(e)表明,与NP(siControl)处理组相比,NP(siMCT4)处理小鼠的MCT4表达得到显著抑制。此外,类Fenton反应引起氧化损伤对肿瘤抑制起到了协同作用,从而显著抑制了肿瘤的生长。同时,氧化铁NPs还具有MRI造影的功能,从而实现了对AIO RNAi NPs肿瘤积聚的无创可视化如图3(f)所示。总体来说,该AIO RNAi NPs具有体积小、基因沉默高效、肿瘤积累高、肿瘤组织穿透深、生物相容性好以及MRI介导的肿瘤积累跟踪等特点,有望为各种恶性肿瘤的治疗提供有价值的工具。

图3 (a)AIO RNAi NPs的形成和(b)多重功能的示意图;(c) Western blot分析NP(siControl)与NP(siMCT4)对PC3荷瘤小鼠MCT4表达的影响;(d) PBS、NP(siControl)或NP(siMCT4)治疗后PC3异种移植小鼠肿瘤生长(*p<0.05和**p<0.01 vs. PBS对照);(e) 三组荷瘤小鼠和肿瘤组织的代表性图片;(f) 静脉注射AIO RNAi NPs后PC3荷瘤小鼠全身T1、T2加权MRI图像。引自参考文献[29]
3.2 生物正交适体-前药结合胶束用于非H2O2和pH依赖性癌症化学动力治疗
如上所述,传统的Fenton反应由于受到反应速率的限制,通常需要大量的H2O2和较低的pH (2~4)[44],而肿瘤内环境自身达不到如此高的要求。除了在上述工作中通过增加H2O2含量及降低细胞内pH来提高Fenton反应效率外,设计一个H2O2和pH非依赖的化学动力学疗法也是提高其抗肿瘤效果的另一个重要途径。因此,本课题小组设计了一种自由基前药和核酸适体偶联物(ApPdC),首次将生物正交反应引入化学动力疗法,实现了Fe2+可激活的有毒碳自由基的原位释放和放大,靶向杀死肿瘤细胞且不依赖肿瘤的酸性或H2O2[32]。
如图4(a)所示,在ApPdC中利用适配体AS1411特异性识别癌症中过表达的核仁素,并引入正交化学和前药设计,首先合成人工前药碱基——金刚烷稳定的四氧六烷单体(“T”)作为疏水尾部,适配体作为亲水端,通过自组装作用成功制备了一个刚性的、多组分的ApPdC纳米胶束。所得到的ApPdC纳米胶束在生理条件下是不活跃的,然而它们在癌细胞受体介导的摄取后,引起级联的生物正交反应。本设计引入与人工前药碱基选择性共给药的血红素hemin,从而实现Fe2+的自供应并能有效地激活前药。在癌细胞中,hemin中的配位Fe3+可以被细胞内还原剂(如GSH)还原为Fe2+-配位血红素,而后前药碱基T被亚铁血红素(Fe2+)/游离Fe2+激活,通过单电子转移释放毒性自由基。在活化过程中,过氧化物被裂解后通过生物正交化学触发氧自由基的产生,不稳定的氧自由基通过C—C β断裂重排成C中心自由基,诱导癌细胞发生凋亡。图4(b)证实了ApPdC胶束的活化及C中心自由基的形成。
实验表明,ApPdC胶束具有良好的特异性识别和位点选择性激活机制,如图4(c)所示。此外,由于血红素的减少导致细胞内谷胱甘肽的消耗,可显著降低肿瘤细胞的抗氧化能力,从而进一步促进毒性C中心自由基的抗癌作用,如图4(d)所示。也验证了ApPdC胶束协同治疗癌症的潜力,显然,Ap-6G-H-“T”比不含血红素的Ap-6G-“T”更能有效抑制细胞增殖和生长,而且与单T胶束相比,Ap-6G-2“T”也展现了高效选择性治疗肿瘤的潜力。

图4 (a) ApPdC胶束的合成及在癌细胞中自循环和原位扩增产生有毒自由基的示意图;(b) 以DEPMPO为自旋俘获剂,测定“T”在二亚硫酸钠诱导血红素还原产生Fe2+(上图)或血红素(Fe2+)(下图)活化下自由基的生成;(c) 不同处理下HepG2肝癌细胞中自由基水平的流式细胞术分析(上图)和共聚焦荧光成像(下图);(d) Ap-6G-“T”、Ap-6G-H-“T”、Ap-6G-2“T”、Ap-6G-H-2“T”及相应的非靶向样品处理HepG2细胞的细胞活性。引自参考文献[32]
设计的ApPdC胶束能够实现TME双靶向和自我循环,在癌细胞中原位扩增产生有毒自由基,显示了很好的治疗效果,但仍需要进一步的研究,如体内药代动力学和ApPdC胶束的抗癌效果,以更好地说明它们在癌症治疗中的潜力。此外,尽管ApPdC胶束旨在靶向独特的癌细胞代谢以最小化副作用,但未来还需要更多的研究来评估其对正常细胞或组织的长期安全性。另外,由于铁代谢失调和易受氧化应激影响是癌症的共同特征,本研究可以为开发新型有效的专门治疗多种晚期癌症的ApPdC奠定基础。
4 总结与展望
自由基在生物体中担任重要功能,其过量产生会导致脂质、蛋白质和DNA等生物分子发生变形和失活。自由基的增加也与癌细胞的异常生长有关,可能在癌症的开始和发展中扮演重要角色。此外,过量自由基导致的氧化应激可能诱发很多其他疾病,如脑中风和神经退行性疾病,因此,维持自由基稳态对保障细胞正常功能至关重要。当氧化应激发生时,由于人体内抗氧化机制无法平衡自由基的产生与消除,往往需要利用一些外源的抗氧化剂进行抗氧化治疗。然而,由于过高水平的自由基应激也可能杀害细胞,癌细胞氧化应激增加时可能更容易受到外源性药物诱导产生的自由基的损伤。因此,促氧化疗法也是一种调节自由基水平特异性杀死癌细胞的有利选择。
在抗氧化纳米材料的合理设计上,需要继续探索和优化合成途径,使材料具有更强、更稳定的体内抗氧化活性,并且高效、高选择性地调节氧化还原微环境靶位点,使全身副作用最小化;为达到显著的临床效益,还需深入了解不同疾病的氧化还原病理和抗氧化纳米材料的详细抗氧化机制,以及进行广泛的临床前研究,为开发设计抗氧化纳米材料提供关键信息。迫切需要明确自由基在调节特定生物事件的分子机制,以及氧化应激相关疾病的动力学进展。开发新的和更具有临床相关性的体外或体内动物模型也是自由基研究领域的一大热点,可对不断涌现的抗氧化纳米技术进行强有力的评价。
对于促氧化疗法的发展,一方面,针对自由基的产生,亟待开发新的材料来调节肿瘤微环境以满足需要,或者利用现有的环境开辟新的自由基产生机制;另一方面,由于涉及氧化还原调控和应激反应的因素很多,癌细胞的氧化还原变化非常复杂,单纯使用自由基生成剂并不一定产生足够的肿瘤杀伤性能。在持续的内源性氧化应激下,许多癌细胞能够很好地适应这种应激并导致内源性抗氧化剂性能增强。为了有效杀死癌细胞并克服与氧化还原适应相关的耐药性,了解癌细胞中复杂的氧化还原变化及其潜在机制是很重要的。同时,将促氧化试剂与传统的化疗或放疗等治疗方式相结合,有望显著增强癌症治疗效果。
综上所述,自由基调控是一种新型的、具有广阔发展前景的疾病防治策略。期待着上述挑战在可预见的未来得到解决,早日实现抗氧化和促氧化技术在预防和治疗人类重大疾病方面的临床应用。

