适用于光催化耦合工艺的耐紫外优势菌筛选及鉴定
张彦龙, 侯 悦, 荣 欣, 张多英, 井立强
(1.黑龙江大学 农业微生物技术教育部工程研究中心, 哈尔滨 150500;2.黑龙江大学 生命科学学院 黑龙江省普通高校微生物重点实验室, 哈尔滨 150080;3.黑龙江大学 建筑工程学院, 哈尔滨 150080; 4.黑龙江大学 化学化工与材料学院功能无机材料化学教育部重点实验室 国家级催化技术国际联合研究中心, 哈尔滨 150080)
0 引 言
光催化氧化法是基于半导体光催化原理,以光为能量,将有机物降解为二氧化碳和水的方法[1]。TiO2是最常用的一种半导体催化剂,近年来,还发展出了基于二氧化钛的可见光光催化剂,如SiO2-TiO2、Ag-TiO2、N-TiO2和Er3+∶YAlO3/TiO2等[2-5];以及铋(Bi)系化合物、混合价态锰氧化物/磷酸银光催化剂,如Bi12O17Cl2、Mn3O4/MnO2-Ag3PO4等[6-7]。已有报道发现,光催化技术虽然可以高效转化污染物,但很难达到完全矿化,加之投入成本较高,在实际应用中还是受到一定的限制[8]。此外,光催化氧化法的光照催化氧化周期较长,处理效果也难以满足实际处理的要求[9]。
光催化生物耦合(Intimated coupling of photocatalysis and iodegradation, ICPB)技术借助于多孔载体,将难降解污染物的光催化产物由载体表面传质至内部,并被生物进一步降解矿化[10]。ICPB同步解决了单一光催化技术对有机物矿化不完全,以及单一生物降解技术无法对难降解有机物起作用的问题[11]。徐政雪研究发现,ICPB体现了单独紫外光光催化(UPC)与单独生物降解(B)协同作用的特点,解除了苯酚对微生物的抑制,16 h在紫外光激发下的直接耦合体系(UPCB)中苯酚的去除率为67.7%[8]。Zhou等以海绵为载体,在光催化剂TiO2中同时掺杂Er3+和YAlO3,研究了UPCB对苯酚降解的影响。该工艺对苯酚的去除率为67.2%,进一步显示了光催化和生物降解的协同作用[4]。尽管ICPB技术存在许多优点,但经紫外光照射后,附着于载体外部的生物膜容易受到损伤,并且紫外光可能对载体内部的生物膜也产生不利影响,例如导致生物膜脱落、损伤微生物细胞、产生可溶性微生物产物等[12]。紫外辐射(Ultraviolet, UV)是指波长介于100~400 nm的光辐射,254 nm波长的紫外光会使DNA链上相邻的嘧啶碱基发生共价交联,造成嘧啶二聚体损伤,激发碱基发生各种化学反应,导致碱基修改、丢失或改变遗传信息[13],破坏细菌、病毒等微生物的细胞结构,造成细菌死亡[14]。因此,UV254是灭菌、消毒最常用的波长。有研究表明,在波长为254 nm紫外光照射下,纳米光催化剂TiO2对大肠杆菌及金黄色葡萄球菌的杀菌效果较好,作用30 min后去除率可以分别达到97.8%和99.4%[15]。而一般TiO2光催化反应在300~388 nm波长条件下受到激发[16],使H2O、O2发生氧化还原反应生成·OH及超氧离子O2-[17]。TiO2受激发的最佳波长为365 nm。有研究发现选用波长为365 nm的紫外灯作为激发光源催化纳米TiO2丝网时,空气消毒器开机作用30 min对空气中自然菌的平均消亡率为81.64 %;选用波长为254 nm的紫外灯作为激发光源催化纳米TiO2丝网时,该空气消毒器开机作用30 min对空气中自然菌的平均消亡率为93.96 %[18]。由此可见,UV254及UV254+TiO2是微生物生长最不利的条件。
为提高ICPB生物降解性能和微生物的紫外光耐受能力,本文在UV254及UV254+TiO2的条件下,经分离、筛选获得耐紫外光的优势菌,对菌株进行16S rRNA初步鉴定,确定其最佳生长温度、最适pH及渗透压,分析紫外光对优势菌生长的影响,并在UV365+TiO2的条件下构建ICPB工艺,验证优势菌对难降解有机物的去除效果。本结果旨在为ICPB技术提供菌种资源,对提高光催化生物降解直接耦合技术处理难降解有机物效率及应用具有一定意义。
1 材料与方法
1.1 试验材料
1.1.1 菌种来源
本试验菌株筛选自哈尔滨市农科院试验田表层土壤。
1.1.2 培养基
(1) 富集分离培养基:0.3 g·L-1土壤浸出液,10%TiO2,无机盐溶液。
(2) 无机盐溶液:MgSO47H2O 0.01 gL-1, K2HPO40.05 gL-1, NaCl 0.01 gL-1,MnSO44H2O 0.01 g·L-1,FeSO40.01 gL-1。
以上所有培养基在配制过程中需调节pH为6.9~7.0。如需配制固体培养基,只需向以上培养基中加入18 gL-1的琼脂,在101 ℃的高压灭菌锅内灭菌30 min即可。
1.2 试验方法
1.2.1 菌株筛选
从哈尔滨农科院试验田取300 mg表层土壤,土壤有机质含量、速效磷、速效钾含量状况优良,碱解氮含量较高,呈弱酸性。将300 mg土壤置于烧杯中,加入蒸馏水至1 L,搅拌均匀后静置,静置后的上清液即为土壤浸出液。向土壤浸出液中加入10%TiO2制备富集分离培养基(MgSO47H2O 0.01 gL-1, K2HPO40.05 gL-1NaCl 0.01 gL-1,MnSO4·4H2O 0.01 gL-1,FeSO40.01 gL-1),pH调节至6.9~7.0,在35 ℃、UV254紫外灯照射及磁力搅拌下富集3 d。培养后进行梯度稀释,涂布于富集固体培养基中,在35 ℃、UV254紫外灯照射条件下恒温培养。待长出单菌落后,选取单一菌落进行划线分离。选取长势良好的菌株用于腐殖酸降解试验。
1.2.2 腐殖酸降解试验
腐殖酸是经微生物转化、合成后积累形成的一类有机物质,属于难降解有机物[19]。腐殖酸广泛存在于地表水、地下水、黑臭水体和垃圾渗滤液等,在饮用水中是天然有机污染物,在污水中是难降解有机物。选择腐殖酸用于本文试验材料,主要考虑以下几个方面:(1)腐殖酸的污染物特性;(2)对微生物无毒害作用;(3)分解后可为微生物生长提供碳源和氮源。因此,本文选取腐殖酸作为难生物降解大分子有机物的代表物,来测定菌株对难降解有机物的去除效果。将分离的1 mL菌剂接种于含有0.5 gL-1腐殖酸的无机盐溶液中,在UV254紫外条件下处理24 h,将相同浓度的腐殖酸溶液放置暗处理作为对照,测定降解前后的和
1.2.3 菌株的形态特征研究
将分离、纯化后的典型单一菌落接种到LB固体培养基,在UV254紫外灯照射条件下,于35 ℃恒温培养箱中培养24 h,观察菌落的形态、大小、颜色、表面状况、是否有光泽等。通过革兰氏染色方法观察菌株的革兰氏染色特征[20],通过扫描电镜(SEM)观察菌体的形态特征和尺寸大小[21]。
1.2.4 菌株的16S rRNA基因鉴定
将菌株接种至LB固体培养基,在最适温度下培养16~24 h,将菌落收集后,应用细菌基因组回收试剂盒,根据操作指南提取细菌基因组DNA。通过生工生物公司对菌株T4的16S rRNA进行测序,获得菌株的基因序列号。采用BLAST在线工具(https://blast.ncbi.nlm.nih.gov/),将获得的16S rRNA序列结果与NCBI GenBank数据库中的已知模式菌株进行同源性对比,将同源性对比结果相似度最高的菌株16S rRNA序列下载,并利用MEGA 7.0软件[22],采用Neighbour-Joining法构建系统发育树[23],系统发育树中其他物种的16S rRNA基因序列由NCBI的GenBank获得。
1.2.5 碳源利用特性试验
将菌体置于基础培养基中,在最适温度下培养24~48 h,用无菌棉签收集菌体于灭菌的生理盐水中,调节菌液浓度至OD550为0.5,混合均匀使之形成均一的菌悬液。在GN Ⅲ板的各个孔中加入200 μL菌悬液,置于菌株的最适温度下培养2 d,记录试验结果,分析菌株对碳源的利用情况。若孔中的菌液由无色变为紫红色则为阳性,无变化则为阴性[24]。
1.2.6 优势菌的最佳生长条件
1.2.6.1 菌株最适生长温度
配制pH为7的LB固体培养基,于101 ℃的高压灭菌锅中灭菌30 min后,将处于对数生长期的菌株接种于上述培养基中。初步在较大的温度范围(4 ~45 ℃)内设置8个温度梯度,分别为4、10、15、20、25、30、35和45 ℃,在UV254紫外条件下培养24 h后,观察菌株形态,通过观察菌株四区生长状态判断菌株T4的最佳生长温度。
1.2.6.2 菌株最适pH
配制LB液体培养基,调节培养基pH分别为4、5、6、7、8、9、10,将菌株接种至上述培养基中,在30 ℃、160 rmin-1、UV254紫外条件下培养24 h,测定菌液在600 nm波长下的吸光度(OD600)值,确定菌株的最佳pH。
1.2.6.3 菌株最适渗透压
配制pH为7的LB液体培养基,调节培养基中NaCl的含量分别为0%、0.5%、1%、2%、3%、4%、5%、7%、8%和10%,将菌株接种至上述培养基中,在30 ℃、160 rmin-1、UV254紫外条件下培养24~48 h。培养24 h后,如菌液出现浑浊,则利用紫外分光光度计测定菌液OD600值;如菌液未出现浑浊,则继续培养至48 h,再测定菌液的OD600值,确定菌株的最适渗透压以及可适应的渗透压范围。
1.2.7 紫外光对菌株生长的影响
将配制好的LB液体培养基灭菌后,取7 mL置于10 mL的离心管中,取单菌落接种于上述离心管中混匀。分别取1 mL混匀后的菌液于锥形瓶中,在30 ℃、160 rmin-1、暗条件和30 ℃、160 rmin-1、UV254紫外条件下培养至对数生长期,于0、0.5、2、4、8、11、24和29 h取样,测定菌液的OD600值。以时间为横坐标、吸光度值为纵坐标绘制生长曲线。
1.2.8 优势菌强化的ICPB工艺的处理效果
按照1%的接种量,将菌株T4接种于含有聚氨酯海绵(填充量为30%)的LB液体培养基中,过夜培养。反复培养3次,使聚氨酯海绵被菌液充满,在UV365+TiO2条件下构建ICPB工艺,加入0.1 gL-1腐殖酸250 mL,在好氧条件下处理24 h后,测定处理效果。
1.2.9 分析方法
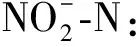
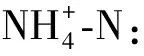
(3) TOC:利用日本岛津公司TOC-VCPN型TOC检测仪测定总有机碳,具体操作按照湿法氧化法[28]进行,分别测定总碳(TC)含量和总无机碳(TIC)含量,两者差值即为TOC 。
(4) OD:利用紫外分光光度计测定菌液的OD600值。
(5) COD:采用《水和废水监测分析方法》中的快速密闭催化消解法(含光度法)[26]进行COD测定。
2 结果与讨论
2.1 耐紫外光优势菌的筛选
通过富集、分离、纯化的方法,以腐殖酸为碳源,在35 ℃、紫外TiO2条件下筛选出三种菌,编号分别为T1、T2和T4。向含有腐殖酸的水溶液中分别添加T1、T2、T4三种菌,取上清液并测其亚硝酸盐、氨氮,TOC的变化情况,结果如图1所示。腐殖酸中含量最多的是碳元素(50%~60%),其次为氧(30%~35%),再其次为氢(4%~6%)和氮(2%~4%)[29]。对T1、T2、T4进行TOC测定,降解24 h后,三株菌对腐殖酸均有去除作用。其中T4和T1去除效果较好,T1的去除率达到60%左右,其次为T4,去除率达到50.4%,二者均高于对照组(9.16%)。经生物降解之后,体系中氨氮浓度有所升高,主要原因是腐殖酸中含有2%~4%的氮元素,腐殖酸经过降解、矿化,微生物的脱氨基作用使腐殖酸中的氮以氨氮的形式释放。对三株菌的亚硝酸盐进行测定,经T1和T2降解后,亚硝酸盐浓度升高,超过了1.3 mg·L-1,而经T4降解后,亚硝酸盐浓度最低。亚硝酸盐含量过高会引发生物急性中毒和高铁血红蛋白症等,亚硝酸盐的代谢产物N-亚硝基化合物也具有强烈的致癌性[30]。因此,鉴于T4降解腐殖酸后亚硝酸盐生成量最低,最终将T4作为降解腐殖酸的优势菌株。

图1 耐紫外光的优势菌对腐殖酸的降解效果:(a)硝酸盐、氨氮浓度变化;(b)TOC浓度变化Fig.1 Degradation effect of dominant bacteria resistant to ultraviolet light on humic acid: (a) changes of nitrate and ammonia nitrogen concentrations; (b) changes of TOC concentrations
2.2 优势菌的初步鉴定
2.2.1 形态特征
通过四区平板划线法将纯化后的单菌落接种于LB固体培养基中,待长出单菌落后,通过肉眼观察的方式记录菌落形态特征,结果如图2(a)所示。培养12 h后的菌落呈圆形,不光滑,中间凸起,边缘有菌环且颜色较浅,有芽孢。新形成的菌落呈乳白色,老龄菌落颜色较深,呈淡黄色。菌株革兰氏染色结果如图2(b)所示,T4为革兰氏阳性细菌。通过扫描电镜观察菌株T4的细胞并测量菌体大小,结果如图2(c)所示,菌株T4的大小为(2.58~7.60) μm×(1.06~1.37) μm。
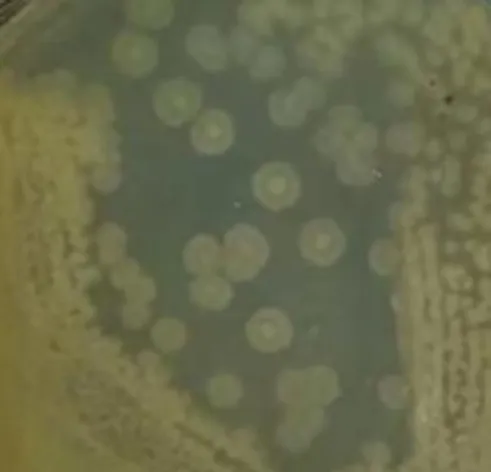
(a)
2.2.2 菌株的16S rRNA鉴定
对菌株T4进行16S rRNA基因测序,将获得的T4菌株16S rRNA基因序列提交至NCBI的Genbank中获得序列号为MN587976。将序列结果与NCBI中BLAST进行比对,发现与模式菌株BacillusaryabhattaiB8W22(EF114313)相似度为98.65%,与芽孢杆菌属的其他相关菌株具有93.54%(B.paramycoidesMCCC 1A04098)~98.45%(B.megateriumATCC 14581)的相似度。将菌株T4与芽孢杆菌属其他菌种构建系统发育树,结果如图3所示。T4与其他菌种均未显示较高的同源性,相似度不到99%,由此推测菌株T4可能为芽孢杆菌属的新菌种。

图3 基于16S rRNA基因序列构建的菌株T4系统发育树Fig.3 Phylogenetic tree of strain T4 based on 16S rRNA gene sequences
2.3 优势菌的碳源利用特征
通过BIOLOG细菌自动鉴定系统,对菌株T4的碳源利用情况进行研究,并与其亲缘关系较近的阿氏芽孢杆菌BacillusaryabhattaiB8W22T和巨大芽孢杆菌BacillusmegateriumMTCC428T[31-32]进行对比分析,结果如表1所示。

表1 菌株T4与阿氏芽孢杆菌Bacillus aryabhattai B8W22T和巨大芽孢杆菌 Bacillus megaterium MTCC428T [31-32]碳源利用对比分析Table 1 Comparative analysis of carbon utilizing characteristics among strain T4, Bacillus aryabhattai B8W22T and Bacillus megaterium MTCC428T [31-32]
碳源利用试验阳性结果指的是,菌株T4可以利用该碳源进行生长;而阴性结果则说明菌株不能利用该碳源进行生长。根据BIOLOG试验结果得知,菌株T4可利用的碳源有D-葡萄糖、麦芽糖、海藻糖、龙胆二糖、蔗糖、D-松二糖、水苏糖、棉籽糖、β-甲基-D-葡萄糖苷、N-乙酰氨基葡萄糖、D-果糖、水苏糖、丙氨酸、L-谷氨酸、L-乳酸、果胶、丙酸,不能利用D-山梨糖醇,对半乳糖、蜜二糖、D-甘露醇、D-甘露糖、丙酸盐、纤维二糖和葡萄糖酸钠微弱利用。从表中数据可知,菌株T4可以利用葡萄糖、蔗糖、果糖、麦芽糖和海藻糖,说明T4对大分子有机物降解能力较强,这也是T4对腐殖酸降解能力较强的原因之一。菌株T4与BacillusaryabhattaiB8W22T和BacillusmegateriumMTCC428T[31-32]相比存在差异,说明菌株T4与对比菌株亲缘关系较远。
2.4 优势菌的最适生长条件
2.4.1 最佳温度
通过固体培养基培养的方式,确定菌株T4的最佳生长温度,并与BacillusaryabhattaiB8W22T、BacillusmegateriumMTCC428T[31-32]进行对比分析。通过四区平板划线的方式,将菌株接种于不同培养温度下的LB培养基中,24 h后观察菌株的生长状态,结果如表2所示。由表可知,菌株T4可以在10~45 ℃条件下生长,最佳生长温度为35 ℃。BacillusaryabhattaiB8W22T生长在10~37 ℃;BacillusmegateriumMTCC428T可以在20~37 ℃条件下生长,最佳生长温度为37 ℃;BacillusthuringiensisATCC 10792可以在10~45 ℃条件下生长,最佳生长温度为30 ℃[31-32]。由此可见,菌株T4与其他菌种相比,具有一定的耐热性,可以适应相对较高的温度。

表2 菌株T4、阿氏芽孢杆菌Bacillus aryabhattai B8W22T、巨大芽孢杆菌Bacillus megaterium MTCC428T 和Bacillus thuringiensis ATCC 10792的生长温度范围[31-32]Table 2 Growth temperatures of strain T4, Bacillus aryabhattai B8W22T, Bacillus megaterium MTCC428T and Bacillus thuringiensis ATCC 10792 [31-32]
2.4.2 最佳生长pH
将菌株T4分别接种至不同pH的LB培养基中,于30 ℃、UV254紫外光照射条件下培养24 h。利用紫外分光光度计测得菌株T4的OD600值,结果如图4(a)所示。发现菌株可以在pH为5~9范围内生长,当pH为5时,OD值为1.39,当pH为7时,达到最大OD值1.72,因此,菌株的最佳生长pH为7。随着pH的继续升高,吸光度值呈现下降的趋势,说明碱性环境不利于菌株T4的生长。而菌株BacillusaryabhattaiB8W22T和BacillusmegateriumMTCC428T可以在pH为6~10范围内生长[31],以上结果说明与其他菌株相比,菌株T4更耐酸性环境。
2.4.3 最佳生长渗透压
将菌株T4分别接种于不同含量NaCl的LB液体培养基,培养24 h后测定菌液的OD600值,结果如图4(b)所示。当培养基中不添加NaCl时,OD值为1.39,当NaCl含量为0.5%时,OD值达到最大值1.71。当NaCl超过4%后,菌株T4在24 h内未见明显生长,因此继续培养48 h,测定OD600值。结果表明,菌株T4的生长范围为0%~10% NaCl,当 NaCl浓度超过4%,生长趋缓,说明高浓度NaCl抑制菌株T4的活性,最高渗透压为10%时,仍可生长,说明菌株T4具有一定的耐盐性。


图4 pH (a)和渗透压(b)对菌株T4生长的影响
2.5 紫外光对菌株T4生长的影响
生长曲线反映了细菌在不同培养条件下所表现出的生长规律和繁殖特点[33]。紫外光对菌株T4生长变化的影响如图5所示。由图可知,菌株T4在30 ℃、160 rmin-1培养条件下经历迟缓期、对数期、稳定期和衰亡期4个时期,符合细菌的生长规律。由图中菌株生长曲线可知,受紫外光照射,0~4 h为细菌T4的迟缓期,4~24 h为对数生长期,24~29 h为平稳期,29 h后进入衰亡期。在非紫外光照射条件下,0~11 h为菌株T4的迟缓期,11~24 h进入对数生长期,24~29 h为平稳期,29 h后进入衰亡期。由此可见,紫外光照射缩短了菌株T4的迟缓期,快速进入对数生长期。紫外光照射会破坏微生物细胞膜和DNA结构,对细胞生物膜造成损伤[34]。然而在本文中,T4没有产生损伤,尤其在24 h前生长速度尤为明显,可能是经紫外光照射后,LB培养基中大分子的多糖、肽链等被打开,使培养基中可利用的碳源增多,促进了菌体生长[35]。而在29 h后吸光度值的降低说明溶液中营养物质不为菌株的生长提供持续的碳源,最终进入衰亡期。此外,T4是芽孢杆菌,芽孢是其抵抗不良环境而产生的休眠体,细胞壁结构相对比较致密,这也可能是其对紫外线具有极强抵抗能力的原因之一[36]。

图5 紫外光对菌株T4生长的影响Fig.5 Effect of ultraviolet light on the growth of strain T4
2.6 优势菌强化的ICPB工艺验证
载体是ICPB工艺的重要组成部分之一,常见的载体有纤维素载体、陶瓷载体、聚氨酯海绵和聚氨酯泡沫[10,37]。本试验以聚氨酯海绵为载体,将菌株T4接种于含有聚氨酯海绵的LB液体培养基中,过夜培养(聚氨酯海绵填充量为30%),反复培养3次,使聚氨酯海绵被菌液充满,在UV365+TiO2条件下构建ICPB工艺,进行光催化耦合降解验证试验,结果如表3所示。经优势菌强化的ICPB工艺在处理24 h后氨氮值有所升高,这与之前菌株筛选结果一致(图1),证实存在微生物的脱氨基作用。经优势菌强化的ICPB对COD去除率为30.23%,低于UV254+TiO2的腐殖酸去除效果,原因可能是UV365+TiO2的光氧化作用相较于UV254的光解作用弱,无法更有效地将腐殖酸的环状结构分解,限制了微生物的降解作用。

表3 优势菌ICPB工艺的生物降解验证试验结果Table 3 Verifying experiment results of biodegrading efficiency by bio-enhanced ICPB with predominant bacteria
3 结 论
从农田表层土壤中分离出耐紫外光、可降解腐殖酸的优势菌株T4,对获得的优势菌进行16S rRNA基因鉴定和生理生化特征分析,并确定了紫外光对优势菌生长的影响。将优势菌用于ICPB工艺,验证了其在光催化体系下对难降解有机物的处理效果,具体结论如下:
(1) 菌株T4可以与紫外光(UV254)以及光催化(UV365+TiO2)耦合,分解难生物降解有机物。
(2) 优势菌T4为杆菌,大小为(2.58~7.60) μm×(1.06~1.37) μm,革兰氏阳性,无鞭毛,16S rRNA基因与芽孢杆菌属的菌种相似度最高,为98.65%,且与其他菌种的进化亲缘关系较远,推测优势菌T4为芽孢杆菌属的新菌种。
(3) 菌株T4的生长范围为10~45 ℃,最适温度为35 ℃;pH范围为5~9,最适pH为7;渗透压范围为0%~10%,最适渗透压是0.5%;菌株T4具有耐高温、耐酸性环境和高渗透压的特点。
(4) 菌株T4可以利用的碳源有D-葡萄糖、麦芽糖、海藻糖、龙胆二糖、蔗糖、D-松二糖、水苏糖、棉籽糖、β-甲基-D-葡萄糖苷、N-乙酰氨基葡萄糖、D-果糖、水苏糖、丙氨酸、L-谷氨酸、L-乳酸、果胶和丙酸。对二糖和多糖的利用能力较强,说明优势菌T4可以分泌降解多糖的胞外酶,有利于处理难降解有机物。
(5) 紫外光促进了优势菌在LB培养基中的生长,缩短了适应期的时间,主要原因可能是紫外光分解培养基中的有机物,使其更易被菌株T4利用,且菌株T4具有芽孢,耐受性更强。

