保乳手术治疗早期乳腺癌疗效分析
储昭新,严建明,陈洁,钱永祥
苏州大学附属太仓医院普外科,苏州太仓 215400
乳腺癌是女性发病率最高的恶性肿瘤之一[1-2]。乳腺癌的发生不但对女性生命健康带来致命的威胁,而且可能对患者女性形象,心理状态和工作生活均带来严重的影响。当前乳腺癌的治疗方式多样,可采取手术,放疗、内分泌治疗、靶向治疗、免疫治疗和中药治疗等的综合治疗。现阶段,手术仍是早期乳腺癌基本的治疗方式。保乳手术方式的提出,一方面体现出乳腺外科治疗的最小伤害原则,另一方面,可以规避乳房完全切除,为女性患者保留较完整的乳房形态,减少患者术后可能出现的焦虑状态,使患者更好回归社会。前哨淋巴结活检手术可减少对腋窝的操作干扰,大大减少患者术后上肢水肿的发生率,增强患者术后劳动能力,对患者生活质量具有明显改善作用。该研究中,通过回顾性分析该院2015年1月—2021年1月收治的早期乳腺癌患者29例行保乳手术患者,探讨保乳+前哨淋巴结活检手术的临床效果,现报道如下。
1 资料与方法
1.1 一般资料
方便选取该院收治的早期乳腺癌患者29例行保乳手术患者,选取同期50例行乳房全切术的早期乳腺癌患者为对照。两组患者均为女性。保乳组年龄34~71岁,平均(50.07±10.05)岁;临床分期:TNMⅠ期21例,TNMⅡ期8例。乳房全切组年龄35~69岁,平均(49.36±8.12)岁;临床分期:TNMⅠ期30例,TNMⅡ期20例。两组患者病例经过伦理委员会批准,患者或家属知情同意。两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。见表1。排除标准:接受新辅助化疗者;保乳术后拒绝放疗者。纳入标准:诊断为佩吉特氏病的患者。

表1 两组乳腺癌患者一般资料比较
1.2 方法
1.2.1 前哨淋巴结活检术 在乳晕或者肿块周围注射美兰少许,于腋窝胸大肌外侧缘附近作3~4 cm切口行前哨淋巴结活检,分离解剖3~5枚蓝染的淋巴结送至病理科进行冰冻病理检查。如术中病理显示的结果为阴性,则无需开展腋窝清扫。术中病理前哨淋巴结提示转移的保乳手术延长切口行腋窝清扫,全切手术则在乳房切除切口下完成腋窝淋巴结的清扫。
1.2.2 保乳手术 保乳切口根据癌肿病变部位确定切口方向,乳房上象限以及下象限分别作弧形切口及放射状切口。术中依据手指触感,将肿瘤附近1 cm的乳腺未病变组织进行切除,并结合肿瘤所处位置以及腺体厚度等决定部分皮肤以及肿瘤深部的胸大肌筋膜是否进行切除[3-4]。切取肿瘤肿块后,在内、外、上、下和基底切缘分别用不同根数丝线做标记,并将肿块送快速病理检查。为了便于手术之后开展放疗,对术后放疗进行定位,在腔缘位置放置钛夹标记即可。选用3-0的可吸收线分层缝合乳房腺体及皮瓣,选用4-0的可吸收线缝合皮肤。将负压引流放置于术区,常规记录引流量。
1.2.3 全乳房切除术 全乳房切除术是切除乳房全部实质,并将乳头乳晕复合体及胸壁多余皮肤进行切除,保留能缝合切口的皮肤即可。术毕,将负压引流管放置在胸骨旁以及腋下。
1.2.4 辅助治疗 参考NCCN乳腺癌指南、中国抗癌协会乳腺癌指南及CSCO乳腺癌指南及患者意愿,制订规范的综合治疗策略,包括化疗、放疗、内分泌治疗及靶向治疗等[5]。
1.3 观察指标
1.3.1 围术期指标 比较两组患者手术时间,术中的出血量及切口长度,并且对两组患者在术后两周内的总引流量进行累积比较。
1.3.2 两组并发症及及预后比较 观察两组术后并发症发生率。术后随访2个月~5年,比较两组局部复发率,远处转移率,生存率差异。
1.4 统计方法
采用SPSS 23.0统计学软件进行数据分析,计量资料以(±s)表示,采用t检验;计数资料以[n(%)]表示,采用χ2检验及Fisher精确检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者围术期指标对比
保乳组手术时间、切除长度、术中出血量及术后12 d内引流总量均明显小于对照组,差异有统计学意义(P<0.05)。见表2。
表2 两组围术期指标对比(±s)

表2 两组围术期指标对比(±s)
?
2.2 两组患者并发症及预后对比
保乳组术后并发症发生率为10.34%、低于乳房全切组的32.00%,差异有统计学意义(P<0.05)。术后随访2个月~5年,两组患者局部复发率,远处转移率,生存率差比较,异无统计学意义(P>0.05)。见表3。
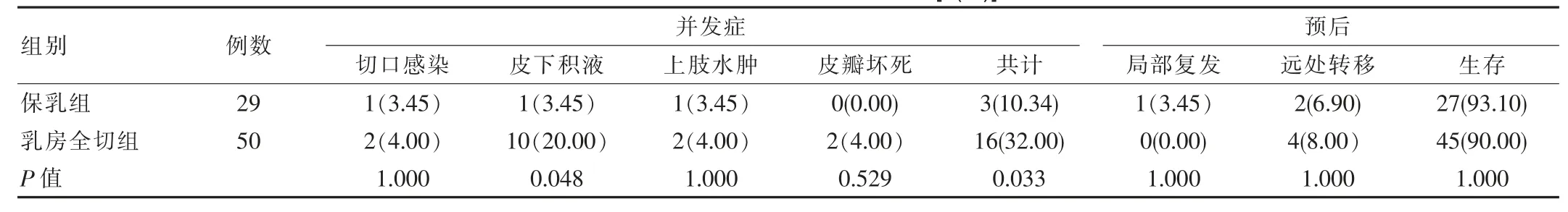
表3 两组患者并发症及预后对比[n(%)]
3 讨论
自从1894年Halsted命名乳腺癌根治术以来,采取外科治疗的方式治疗乳腺癌拥有近百年发展历程。改良根治术是乳腺癌具有代表性手术方式,其通过切除乳房全切和邻近腋窝淋巴结清扫来实现彻底消除乳腺癌的目的。大型随机对照试验(randomized controlled trial,RCT)表明,早期乳腺癌的保乳治疗[保乳手术加放疗,breast-conserving surgery with radiation therapy(BCT)]和乳房切除术的存活率相同[6-8]。目前手术治疗的策略已从“可耐受的最大治疗”转变为“有效的最小治疗”[9]。早期乳腺癌推荐采用保乳手术或乳房全切术[10]。然而近年来,有观察研究挑战了这个等效性,显示与乳房全切术相比,BCT治疗患者可能生存率更高[11]。
乳腺癌手术后最常见的“并发症”是血清肿,可能会延迟患者进一步治疗和/或损害患者的生活质量。一段时间以来,人们已经知道手术的程度会影响血清肿的产生。该研究证实,保乳组手术时间(101.20±32.18)min、术中出血量(22.59±16.72)mL、切口长度(11.69±4.18)cm和术后总引流量(143.30±63.67)mL均显著低于乳腺全切术组(118.60±21.22)min、(37.79±10.37)mL、(20.36±2.26)cm、(468.00±107.20)mL(P<0.05),并且保乳组术后并发症的发生率低于乳腺全切术组(10.34%vs 32.00%)(P<0.05)。这表明保乳手术降低了手术耗费的时间,减少患者在手术过程中的出血量,降低术后整体的引流量,提升术后的恢复能力,减低术后出现并发症的风险。可能由于术中操作手法、出血计量方法的不同,郭强[12]报道保乳组及全切组术中出血量较该研究的多,但其报道的保乳组相对全切组患者术中的出血量少[(63.43±10.32)mL vs(128.28±14.38)mL](P<0.05),手术时 间 短 [(62.83±5.22)min vs(103.53±4.98)min](P<0.05)。Ebner F等[13]证实,保乳手术后血清引流量相对乳房全切除术后少,推测其可能与手术方式,淋巴结清除数量和手术时间相关。
经过2个月~5年的随访,两组患者局部复发率、远处转移率和生存率比较差异无统计学意义。这表明这两种的手术疗效相似,两者均可降低局部复发率及预防远处转移。经期有研究证实了保乳手术在三阴性乳腺癌及有BRCA1/2基因突变乳腺癌中的安全性[14-15]。此外,保乳手术不仅可以有效地去除乳腺癌的病变,也保证了乳腺癌患者乳房的完整性,满足患者保持美丽的外表要求。因此可以有效改善患者术后心理状态[16]。
现阶段比较典型的乳腺癌保乳根治手术的具体技术有两种,一种为欧洲技术,另一种为美国技术。欧洲技术主要采取的手术方式为象限切除法,以腺体重建或者是乳头乳晕重建等技术来对乳腺癌患者术后的乳房进行美容修复。欧洲技术乳房切除范围较大,一般无需行切缘的术中冰冻活检。为了让患者在手术后的美容效果得到提升,美国技术在进行乳腺癌手术时,主要将切口置于肿瘤所处的乳房部位的正上方。并建议选取弧形方式的切口,除肿瘤所在的位置较浅,不常规推荐放射状切口。切除组织的范围在于两点,一是完整癌肿病灶;二是癌肿附近足够正常的乳腺组织。如若癌灶并未累及皮肤,则不需要对皮肤进行切除。美国技术在术中必须采取快速病理活检,通过病理验证切缘阴性情况方可进入下一步手术步骤。借助欧洲技术进行治疗,虽然可以大幅度减少复发率的出现,但是两种技术展现的总生存率相似。相对比欧美女性的乳房,我国女性乳房普遍比较小,为此针对我国患有的乳腺癌女性选取手术方案时,美国技术可能更为适合[17]。笔者所在单位在明确肿块所属位置后,上象限及下象限分别采取弧形切口以及放射状切口,一般分别选取保乳手术和腋窝淋巴结活检或清扫手术切口,以减少术后放疗引起的乳头向同侧腋窝牵拉风险。切除范围主要在于两点,一是完整癌肿病灶;二是癌肿附近1 cm正常乳腺组织。乳房较小或癌灶较深后切缘可达胸大肌筋膜。在确保病灶实现完整切除的基础上,尽可能预留较厚皮瓣,以规避患者手术后皮肤可能出现凹陷情况,以维持乳房的外形,获得较好美容效果。
乳腺癌保乳想要获得成功秘诀在于确保切缘阴性。依照以往研究可知,保乳手术如若切缘为阳性,则术后出现的局部复发率将会大大提升,同时不能被术后放疗抵消。然而,在切缘阴性情况下,采用更大的切缘范围,不会进一步降低局部复发率。该研究采用切除癌肿周围1 cm正常乳腺组织送检,以期获得切缘阴性。现阶段针对边缘评估普遍采取的方式有两种类型,一种为肿瘤边缘评估法;另一种为腔周边缘评估法[17]。我国保乳手术实际操作中多进行术中冰冻病理判断切缘。笔者医院采取选择性取材,用不同数量丝线标记保乳标本内侧、外侧,上侧。对保乳标本的内、外侧、上侧及下侧、表面基底切缘部分取材,优点是取材少、时间短,一定程度上反映保乳手术切缘情况,缺点是不能全面反映整个周切缘情况,存在假阴性、补充二次手术可能[18-19]。
综上所述,保乳手术及在乳房全切术均可适用于早期乳腺癌的手术治疗。然而,保乳手术在缩短手术时间、降低出血量、减少血清引流量和减少术后并发症发生率方面更有利,值得推广。

