尼妥珠单抗联合同步放化疗治疗中晚期食管鳞癌的近期疗效及价值研究
蒋健,朱惠平
苏州大学附属张家港医院肿瘤科,江苏张家港 215600
食管癌是临床常见的恶性肿瘤,全球肿瘤性疾病发病率居第6位[1]。食管癌发病初期往往无明显临床表现,多数患者就诊时已达疾病中晚期,往往错过最佳手术时机。临床上多采用同步放化疗治疗食管癌,不仅能够改善患者生活质量,还能提高生存率和疾病缓解率,但疗效维持时间相对较短,5年生存率约为6.4%。因食管癌患者机体耐受性相对较差,因此提高患者疗效的关键在于积极寻找低毒高效的治疗措施。伴随分子靶向治疗的迅猛发展,国内外研究已报道尼妥珠单抗联合放化疗能够治疗无法进行手术的食管癌患者,并且取得较好的治疗效果[2-4]。基于此,该研究随机选取2015年10月—2020年6月该院收治的50例中晚期食管鳞癌患者进行分析,旨在探究尼妥珠单抗联合同步放化疗治疗中晚期食管癌患者的近期疗效及价值,现报道如下。
1 资料与方法
1.1 一般资料
随机选取该院收治的50例中晚期食管鳞癌患者进行分析。纳入标准:均接受内镜病理活检、上消化道造影、CT等检查确诊,均符合食管癌相关诊断标准[5];TNM肿瘤分期[6]为Ⅲ~Ⅳ期,均为中晚期食管癌患者;ECOG评分[7]在2分及以下;患者或家属了解该研究全过程并签订知情同意书;该研究经伦理委员会批准实施。排除标准:无法耐受放化疗治疗患者;食管穿孔前征象患者;有手术指征患者;重要器官功能障碍患者;心肺功能、肝肾功能异常患者;一般资料不全患者;中途退出研究患者。
该研究通过治疗方式的不同将选取的病例平均分为两组,其中研究组和对照组各25例。所有患者的临床活检病理均为鳞癌。对照组女7例,男18例;年龄51~79岁,平均(68.34±2.33)岁;肿瘤部位:4例颈段,21例胸段。研究组女5例,男20例;年龄52~78岁,平均(68.45±2.43)岁;肿瘤部位:3例颈段,22例胸段。两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 方法
对照组接受同步放化疗治疗:(1)调强放疗。放射治疗前为患者实施CT定位扫描,放疗医生进行靶区勾画GTV/CTV,GTV为食管原发病灶或复发转移的淋巴结短径>1 cm,CTV为相应的淋巴引流区,上下外放遵循“上三下四”原则。总剂量50~64 Gy,危及器官均规定在受限范围内:脊髓1%<45 Gy,心脏V30<46%,肺V5<60%,V10<50%,V20<25%。靶区确定后,物理师进行放疗计划的制定,与医师确认无误后在直线加速器(美国Varian 23-EX)下进行放射治疗。安排患者每周接受5 d放疗。(2)化疗。选用顺铂或含铂类的同步化疗方案:①单药顺铂;②雷替曲塞+铂类;③紫杉醇+铂类,1周/次,同时予以升白、护胃、止呕等对症支持治疗。
研究组在对照组基础上给予尼妥珠单抗靶向治疗:放疗前4 d为患者静脉滴注200 mg尼妥珠单抗(国药准字S20080001),1次/周,根据患者实际情况连续治疗6~7次,期间密切观察有无不良反应等情况并积极予以对症处理。两组患者均治疗3个月后进行疗效评价。
1.3 观察指标
对比观察两组患者临床疗效、肿瘤指标变化、不良反应发生率。①临床疗效根据实体瘤RECIST评定标准[8]:完全缓解(CR):所有靶病灶消失,无新病灶出现,且肿瘤标志物正常,至少维持4周;部分缓解(PR):靶病灶最大径之和减少≥30%,至少维持4周;疾病进展(PD):靶病灶最大径之和至少增加≥20%,或出现新病灶;疾病稳定(SD):靶病灶最大径之和缩小未达PR,或增大未达PD。总有效率通过完全缓解(CR)和部分缓解(PR)进行综合计算。②记录两组患者肿瘤指标物水平的变化。③依据美国肿瘤放射治疗协作组(radiation therapy oncology group,RTOC)放射损伤分级标准及血液学毒性评价标准,评估两组患者的不良反应。
1.4 统计方法
采用SPSS 23.0统计学软件进行数据分析,计量资料采用(±s)表示,进行t检验;计数资料采用[n(%)]表示,进行χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者临床疗效比较
研究组的总有效率明显高于对照组,差异有统计学意义。见表1。

表1 两组患者临床疗效比较[n(%)]
2.2 两组患者肿瘤标记物水平
治疗前,两组患者肿瘤标记物水平差异无统计学意义(P>0.05);治疗后,研究组肿瘤标记物CEA(2.01±0.75)ng/mL、CA125 (33.43±1.28)U/mL、SCC (1.02±0.12)ng/L水 平 均 低 于 对 照 组 的 (4.26±1.11)ng/mL、(38.13±2.45)U/mL、(1.55±0.27)ng/L,差异有统计学意义(P<0.05)。见表2。
表2 两组患者肿瘤标记物水平比较(±s)

表2 两组患者肿瘤标记物水平比较(±s)
?
2.3 两组患者不良反应发生情况对比
研究组和对照组患者的不良反应发生率差异无统计学意义(P>0.05)。见表3。
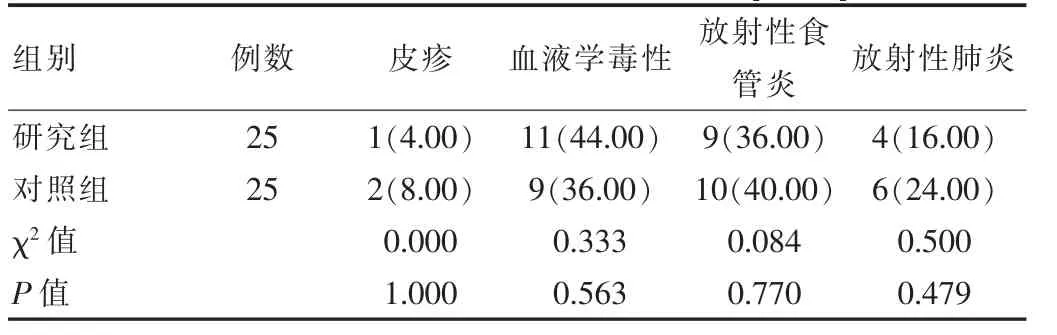
表3 两组患者不良反应发生情况对比[n(%)]
3 讨论
食管癌早期无明显症状表现,临床易忽视,大多患者发现时已达疾病中晚期,存在机体微小病灶转移情况,有研究证实对于无法接受手术治疗的食管癌患者实施放化疗治疗能够取得理想的治疗效果,食管癌对于放射线更加敏感,治疗效果确切。美国国家综合癌症(NCCN)指南[9]推荐中晚期食管癌非手术治疗患者的标准治疗方案为同步放化疗,不仅能够有效治疗食管癌原发肿瘤病灶,还能够治疗机体微小转移病灶和全身隐匿性肿瘤病灶,最大程度降低食管癌转移和细胞复发,提高综合疗效。放疗治疗对于非手术治疗的食管癌患者控制肿瘤生长和缓解症状已经得到较为肯定的疗效,同期化疗治疗能够有效治疗转移病灶和原发性病灶,且对于放疗治疗具有一定增强敏感性的作用效果。但临床上不良反应相对较大,患者耐受性不佳,极易导致治疗中断情况发生,导致患者治疗效果不甚理想。放化疗治疗不良反应大,获益小。
近年来,分子靶向治疗为食管癌的治疗提供了新途径,作为食管癌治疗的第4种形式,且因其低毒高效的特点而备受关注。表皮生长因子受体(EGFR)是跨膜糖蛋白的一种,能够调节有丝分裂,在恶性肿瘤中易出现过度表达情况,在食管癌中,EGFR过度表达可达70%,会使肿瘤对放化疗治疗产生一定抵抗作用[10]。尼妥珠单抗是以EGFR为靶点的单克隆抗体,通过竞争性结合EGFR,能够使受体失去活性,减少EGFR的表达,有效增强放化疗治疗的敏感性。具有半衰期长、高选择性、高度人源化等特点。临床大量研究证实,尼妥珠单抗治疗对于多种实体肿瘤具有较为显著的治疗效果,疾病控制率相对较高,能够取得较好的生存获益效果,且用药治疗不良反应轻微,临床应用前景和应用价值较为显著。
该研究结果表明,对照组临床治疗总有效率(56.00%)相较于研究组(88.00%)明显更低(P<0.05),而两组患者毒副反应发生率差异无统计学意义(P>0.05)。这与吴小源等[11]研究结论相似:开展尼妥珠单抗联合放化疗治疗的食管癌患者临床治疗总有效率为96%,大多发生1~2级不良反应,主要包括胃肠道反应、黏膜炎以及骨髓抑制等,不良反应耐受。陶兴[12]研究显示尼妥珠单抗联合放疗能够有效阻断由EGFR与其介导的下游信号转导通路,从而抑制肿瘤细胞增殖,增强晚期肿瘤患者的疗效。提示中晚期食管癌患者实施尼妥珠单抗联合同步放化疗能够有效控制患者病情进展,并且不良反应可控。分析原因可知,同步放化疗是非手术晚期食管癌的标准治疗方案,虽能够在一定程度上控制肿瘤细胞生长,杀灭肿瘤细胞,但同样会对患者机体正常生理功能造成不利影响,综合治疗效果不甚理想。EGFR在食管癌病灶中大多呈现过度表达的情况,与患者预后情况和肿瘤的恶性程度具有显著相关性。尼妥珠单抗治疗能够有效结合EGFR细胞外区域的3A表位受体,对于EGFR和配体的结合发挥竞争性抑制作用,进而使配体失活。尼妥珠单抗具有半衰期长特点,且有高度选择性,能够有效降低肿瘤组织血液供应情况,抑制恶性肿瘤新生血管的形成,进而对于促进肿瘤的缩小和消失具有积极作用,能够有效提高综合疗效。
肿瘤标志物是由恶性肿瘤细胞异常产生的物质,可反应肿瘤的发生、发展,对肿瘤标记物水平变化情况进行监测,利于掌握患者的临床疗效。CEA、CA125、CA199为胃肠道肿瘤常检测的肿瘤指标,SCC常为鳞癌的首选肿瘤指标[13-15]。该研究结果显示,当治疗有效时患者某些肿瘤标志物水平会有所降低。治疗前,两组患者肿瘤标记物数据相近(P>0.05);治疗后,研究组肿瘤标记物CEA(2.01±0.75)ng/mL、CA125(33.43±1.28)U/mL、SCC(1.02±0.12)ng/L水平均低于对照组的 (4.26±1.11)ng/mL、(38.13±2.45)U/mL、(1.55±0.27)ng/L(P<0.05),因CA199可能多为胃肠道腺癌的监测指标,故治疗前后对比差异无统计学意义(P>0.05)。提示在相同条件下,尼妥珠单抗联合放化疗能够抑制肿瘤细胞的增殖和分化,进而有效杀伤肿瘤细胞,减少某些肿瘤标记物的释放,间接反映肿瘤治疗有效[16-18]。
综上所述,中晚期食管癌实施尼妥珠单抗联合同步放化疗近期疗效显著,可有效降低CEA、CA125、SCC等肿瘤标志物的水平,毒副反应可控,具有重要的临床指导意义。

