妊娠期高血压对早产新生儿血细胞计数及早发型败血症诊断的影响
张红飞,张玲萍,毛郑霞,余 欢,董文斌,雷小平
西南医科大学附属医院 儿科(新生儿),四川泸州 646000
妊娠期高血压(pregnancy induced hypertension,PIH)是一组妊娠20周后发生的高血压疾病,在全世界孕妇中的发生率为5% ~10%,包括妊娠期高血压、子痫前期、子痫等,可对母婴健康造成严重不良影响[1-3]。PIH孕妇分娩的新生儿败血症发生率较正常产妇新生儿高[4]。PIH的发生与母体循环中白细胞活化、炎症反应增强和氧化应激等因素相关[5]。有研究发现,子痫前期孕妇存在的非感染性炎症反应及白细胞活化等因素可影响胎儿造血功能,其分娩的新生儿白细胞及中性粒细胞均较正常新生儿低[5],胎儿胸腺调节性T细胞生成减少[6]。根据中国2019版“新生儿败血症诊断及治疗专家共识”,在有临床表现的基础上,同时出现2项及以上非特异性炎症指标异常即可临床诊断败血症[7],而白细胞数异常及血小板减少均是临床诊断败血症的非特异性炎症指标。由此我们可以推测,PIH孕妇分娩的早产新生儿,出生后即使不存在感染性因素,也可能在其他因素导致的非特异性临床症状的基础上,因PIH导致的血细胞计数降低被纳入疑似早发型败血症(early onset sepsis,EOS)并早期应用抗生素[8];部分甚至达到EOS的临床诊断标准,导致更长时间的非必要的抗生素使用。抗生素的过度使用会增加后期肠道菌群失调、二重感染、晚发性败血症、坏死性小肠结肠炎等的发病风险[9]。本研究旨在通过比较PIH产妇与非PIH产妇所分娩早产新生儿出生后第1周的血细胞计数,并进一步对比两组患儿EOS的诊断、非特异性炎症蛋白改变及血细胞计数降低对临床诊断EOS的贡献率等,探讨PIH对早产新生儿EOS诊断的影响。
资料与方法
1 资料来源 观察组(PIH 组)来源于2016年10月1日- 2020年11月30日于我院新生儿科住院的、我院产科收治的PIH孕妇所分娩的早产新生儿。孕妇PIH诊断参照中国“妊娠期高血压疾病血压管理专家共识(2019版)”标准,包括孕20周后初次诊断的妊娠期高血压、子痫前期、子痫。在纳入研究期间,我院产科PIH孕妇所分娩的新生儿大多为早产儿,出生后均入住新生儿科;同期PIH分娩的足月新生儿仅有部分入住新生儿科而缺乏相关实验数据,为避免未住院足月儿导致的选择偏倚,本研究的观察对象仅纳入早产儿,且均在出生后24 h内入院并存活7 d以上。对照组(非PIH组)按照1∶1匹配纳入与PIH组患儿出生时间差距不超过1个月且胎龄差距不超过1周的非PIH孕妇所分娩早产儿。排除标准:1)任何严重结构畸形(如先天性心脏病、中枢神经系统畸形、消化道畸形等)及染色体疾病、遗传代谢病,辅助生殖、双胎及多胎;2)孕妇妊娠合并慢性高血压、慢性高血压并发子痫前期、妊娠糖尿病等疾病;3)新生儿出生后超过24 h入住新生儿科以及经细菌培养证实的新生儿败血症。本研究方案均经本院伦理委员会批准(审批号:KY2021030)。
2 研究方法 根据我院新生儿科临床诊治常规,早产儿入院后均常规于入院时、出生后48 h及出生后7 d行血常规+C反应蛋白(C reactive protein,CRP)检查;对疑似败血症患儿同时检测降钙素原(procalcitonin,PCT),并在入院使用抗生素前行血培养。血细胞分析相关参数分析采用BC6000 Plus仪器进行,PCT检测采用诺尔曼化学发光分析仪。早产儿血细胞计数、人口学基本资料、住院期间相关诊断信息均通过查阅患儿住院病历资料获得,采用Epidata双人独立录入,数据不一致由 第三人评估。
3 分析指标 1)孕妇合并症及并发症:妊娠期高血压、胎膜早破、妊娠期糖尿病、产前皮质激素使用、分娩前发热、分娩前48 h全身抗生素使用。2)新生儿相关信息:胎龄、性别、出生体质量、出生后1 min和5 min的Apgar评分、分娩方式;临床诊断。3)新生儿血细胞相关参数:入院时、出生后48 ~72 h(2 ~3 d)、入院后144 ~168 h(6 ~7 d)静脉血细胞计数。4)发生率比较:比较两组早产新生儿达到现行疑似或临床诊断EOS标准的比例,并比较两组患儿中因白细胞和血小板同时 降低而达到临床诊断EOS的比例。
4 新生儿EOS诊断标准 EOS的诊断依据中国2019版新生儿败血症诊断及治疗专家共识[10]:1)疑似诊断:3 d龄内有下列任何一项,①不能用其他原发疾病解释的异常临床表现,②母亲有绒毛膜羊膜炎,③胎膜早破(premature rupture of membranes,PROM)≥18 h。如无异常临床表现,血培养阴性,间隔24 h的连续2次血非特异性检查<2项阳性,则可排除败血症。2)临床诊断:有临床异常表现,同时满足下列条件中任何一项,①血液非特异性检查≥2项阳性,②脑脊液检查为化脓性脑膜炎改变,③血中检出致病菌DNA。3)确定诊断:有临床表现,血培养或脑脊液(或其他 无菌腔液)培养阳性。
5 血液非特异性指标解释 血液非特异性指标异常包括:1)白细胞计数在6 h龄~3 d龄≥30×109/L;大于3 d龄时≥20×109/L;任何日龄<5×109/L。2)不成熟中性粒细胞/总中性粒细胞异常(immature/total neutrophil,I/T):出生~3 d龄I/T≥0.16为异常,大于3 d龄时≥0.12为异常。3)血小板降低<100×109/L。4) CRP异常:6 h龄内CRP≥3 mg/L;6 ~24 h龄内≥5 mg/L;大于24 h龄时≥10 mg/L。5) PCT异常:3 d龄内PCT有生理 性升高,PCT异常依据表1所示[11]。

表1 新生儿血清降钙素原浓度的截断值(µg/L)Tab. 1 Cut-off value of serum procalcitonin concentration in neonates (µg/L)
6 统计学分析 采用SAS9.4软件进行统计分析,P<0.05为差异有统计学意义。计数资料采用频数及百分比表示;计量资料以± s(符合正态分布时)或Md(IQR)(不符合正态分布时)表示;计数资料的组间比较采用χ2检验,计量资料的组间比较采用独立样本t检验或秩和检验。两组患儿血细胞计数为重复测量数据,考虑时间相关因素,采用广义线性模型比较两组间的血细胞计数,并调整胎膜早破、产前激素使用、分娩前48 h抗生素使用等混杂因素对血细胞相关参数的影响。为验证血细胞计数对PIH暴露人群早产新生儿败血症诊断及抗生素应用的可能影响,参照CRP和PCT相关诊断界值,以出生后7 d内CRP和PCT同时高于诊断界值1次或两者分别高于诊断界值2次作为非特异性炎症指标异常的标准。
结 果
1 两组一般资料比较 PIH组早产儿胎盘异常率、胎膜早破率、分娩前抗生素使用率较非PIH早产儿组低(P均<0.05);但产前激素使用率、剖宫产率、小于胎龄儿发生率高于非PIH早产儿组(P均<0.05)。见表2。

表2 妊娠高血压组新生儿与非妊娠高血压组早产儿围生期情况比较Tab. 2 Comparison of perinatal conditions in the premature infants delivered by the pregnancy induced hypertension versus the non-pregnancy induced hypertension mothers
2 两组早产儿血细胞参数及降钙素原比较 PIH组各时点白细胞计数、中性粒细胞数、血小板计数均显著低于非PIH组(P均<0.05),两组间白细胞计数差异不受出生后日龄的影响(P>0.05),中性粒细胞计数(P<0.05)、血小板计数(P<0.05)差异因日龄而不同;PIH组仅在出生后48 h降钙素原较非PIH组低(P<0.05),入院时及出生后7 d降 钙素原无统计学差异。见表3。
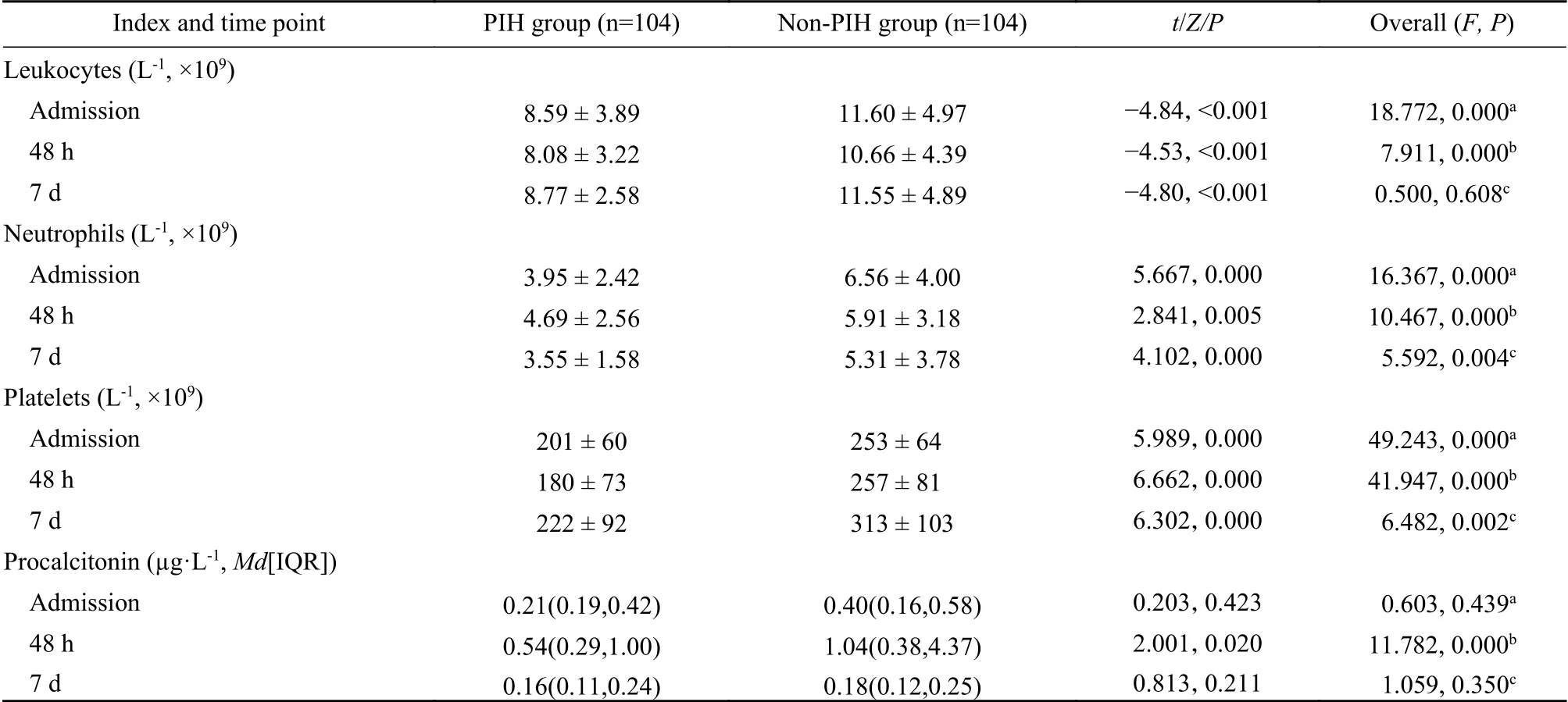
表3 妊娠高血压组与非妊娠高血压组早产儿血细胞参数及降钙素原比较Tab. 3 Comparison of hemocyte parameters and procalcitonin between premature infants of pregnancy induced hypertension and non-pregnancy hypertension mothers
3 两组早产儿EOS诊断及入院7 d内非特异性炎症蛋白升高发生率比较 两组早产儿EOS临床诊断率及非特异性炎症蛋白升高发生率无统计学差异,但PIH组因白细胞和血小板同时降低而达到临床诊断EOS标准的比例显著高于非PIH组(P<0.05)。见表4。

表4 两组早产儿早发型败血症诊断及7 d内非特异性炎症蛋白升高发生率的比较Tab. 4 Diagnosis of EOS and rates of elevated non-specific inflammatory protein within 7 days between the two groups
讨 论
PIH可导致胎盘早剥、胎儿发育迟缓、早产、血糖紊乱、神经系统不良预后及胎儿死亡等不良妊娠结局[12-13],较少有研究关注PIH对新生儿血细胞生成的影响。PIH的发生涉及机体的炎症反应机制,而白细胞及血小板生成受全身炎症反应状态的调节[14]。既往研究显示,患有先兆子娴的孕妇,其中性粒细胞水平较正常妊娠孕妇显著降低,其脐血中中性粒细胞水平也显著低于正常孕妇[15];而子痫前期孕妇的IL-6、TNF-α、α1-抗胰蛋白酶、CRP等炎性因子显著高于正常孕妇,且胎儿脐带血α1-抗胰蛋白酶和CRP等炎症指标也显著升高[5]。由此可见,母亲罹患PIH,胎儿由于长期暴露于母体的全身炎症环境中,其本身的炎症反应水平也增加。
进一步研究发现,子痫前期孕妇的胎儿虽然脐带血炎症指标升高,但其胸腺直径及体积均较正常孕妇胎儿小,脐带血中调节性T细胞(Treg细胞)、白细胞及中性粒细胞计数均低于正常血压孕妇[6,16-17]。本研究结果也证实,PIH孕妇分娩的早产新生儿出生后外周血白细胞、中性粒细胞及血小板计数均较非PIH孕妇的新生儿低,与上述研究结果相互印证。据此,我们推测PIH组白细胞及血小板减少可能与母体的炎症暴露对胎儿造血系统的影响有关。PIH孕妇的胎儿暴露于母体高水平的炎症环境中,其胸腺发育受到抑制,胎儿期胸腺本身是重要的造血器官之一;其次,胸腺来源的Treg细胞有限制炎症损伤和氧化应激的作用,可对抗母亲炎症反应对胎儿的影响[16,18-19]。但Treg细胞分泌的减少导致胎儿对炎症的耐受能力降低,进一步导致骨髓抑制,白细胞及血小板生成进一步降低。此外,PIH患者的炎症反应导致血小板在血管内皮损伤部位的黏附性增加、血小板消耗增加和继发性破坏增加[20]。
新生儿败血症确诊主要依据血液及无菌体液的细菌培养,然而细菌培养阳性率低,故新生儿败血症多为临床诊断。依据中国2019版“新生儿败血症诊断及治疗专家共识”,新生儿败血症临床诊断依据中的非特异性指标包含白细胞和血小板计数异常[7]。在早产新生儿这一特殊群体,感染导致的血常规指标改变不同于成人、儿童、甚至足月儿,更可能表现为白细胞甚至血小板计数的减少。早产儿因自身生长发育欠佳,在早期可表现出反应差、体温波动、少吃等非特异性临床表现,因而在早产儿中,出现2项以上非特异性指标异常时易被临床诊断EOS。本研究及既往研究结果均证实,PIH孕妇新生儿白细胞、中性粒细胞及血小板计数均低于非PIH孕妇的新生儿。本研究中,两组临床诊断EOS的患儿,PIH组因白细胞和血小板同时降低而达到EOS临床诊断标准的比例高于非PIH组。而现行新生儿败血症的临床诊断标准不能兼顾该类患儿自身白细胞及血小板基数明显偏低的情况,以此标准进行EOS临床诊断时必然存在扩大化的情况,造成不必要的抗生素使用,并可能增加患儿晚发性败血症的风险。
本研究为回顾性巢式病例对照研究,可能存在选择偏倚和样本量较小等因素对研究结果的影响,但本研究提示的PIH孕妇分娩的早产儿EOS诊断扩大化在临床是可能存在的。目前对于PIH孕妇分娩的早产新生儿EOS诊断标准,可能需更多参照血细胞计数以外的其他非特异性炎性指标。

