布鲁氏杆菌性脊柱炎术后伤口不愈合的危险因素分析
魏 萌,柳洪宙,王 磊邯郸市中心医院 骨科三病区,河北邯郸 05600;解放军总医院第一医学中心 内分泌科,北京 0085;解放军总医院第四医学中心 骨科医学部,北京 00048
布鲁氏杆菌是一种革兰阴性细菌,共有6个种,其中羊氏布鲁氏杆菌的危害性最强[1]。布鲁氏杆菌感染人体所造成的人畜共患病称为布鲁氏杆菌病,简称“布病”。目前布鲁氏杆菌病在我国乃至一些发达国家中呈现高发态势,且发病率在各个年龄段人群中均有增高的趋势,成为威胁人民健康的重要疾病[2-7]。而布鲁氏杆菌性脊柱炎是由于布鲁氏杆菌侵袭脊柱所导致的一种传染性变态反应性疾病。布鲁氏杆菌性脊柱炎的概念于1932年由Kulowski和Vinke[8]首次提出。常见的布鲁氏杆菌性脊柱炎可以侵袭脊柱的各节段,腰椎是布鲁氏杆菌性脊柱炎发病率最高的部位[8]。其主要临床症状表现为发热、多汗、乏力、腰痛,严重时会出现双下肢神经症状。布鲁氏杆菌性脊柱炎的治疗方法主要包括药物治疗及手术治疗。当患者腰痛症状经保守治疗未见缓解甚至加重,脊髓神经受压,脊柱结构不稳定时常需要行手术治疗。布鲁氏杆菌性脊柱炎的手术治疗难度大,并发症多,复发率高,由于患者的手术切口并非清洁切口,有些伤口长期不愈合形成窦道,需要翻修清创,因此伤口感染发生率较其他脊柱手术发生率高[8]。本研究分析布鲁氏杆菌性脊柱炎患者术后伤口不愈合的危险因素,为降低术后伤口不愈合概率提供参考。
资料与方法
1 资料来源 纳入2013年1月- 2018年1月于邯郸市中心医院骨科行手术治疗的资料完整的布鲁氏杆菌性脊柱炎患者94例。纳入标准:符合布鲁氏杆菌性脊柱炎的诊断标准[9],于术前行化验检查、X线、CT、MRI检查且术中取病理确诊为布鲁氏杆菌性脊柱炎;排除标准:合并脊柱畸形、既 往脊柱手术、外伤史、其他细菌感染。
2 手术方法 94例患者均行病灶清除椎间植骨融合内固定术,术前至少规范足量应用二联抗布氏杆菌药物(利福平、多西环素)治疗3周,定期复查血沉,待血沉呈下降趋势时行手术清除病灶。所有手术均由同一组手术医师完成。根据布鲁氏杆菌性脊柱炎部位、是否有脓液、脓液的位置和量,分别行单纯前路病灶清除植骨融合/单纯后路病灶清除植骨融合内固定术,或前后路联合病灶清除植骨融合内固定术。具体要点:1)对于行前路病灶清除的患者,取仰卧位,常规皮肤消毒铺单,切开病变椎体对应皮肤,充分暴露至病变椎体,彻底清除病变的椎间盘及骨组织,刮匙刮除肉芽组织及脓肿。清除病灶后行植骨融合。用过氧化氢溶液、稀碘伏和0.9%氯化钠注射液反复冲洗后放置引流管并逐层缝合。2)行后路病灶清除植骨融合内固定的患者取俯卧位,确定患者手术节段后常规消毒铺单,取后路正中切开皮肤,充分暴露至病变椎体,置入椎弓根螺钉系统,彻底清楚病灶后,置入椎间融合器,伤口冲洗放置引流管并逐层缝合。3)行前后路联合病灶清除植骨融合内固定术的患者,在全身麻醉后,取仰卧位,切开病变椎体对应皮肤,剥离肌肉、显露病灶。钝性分离肌肉,彻底清理脓肿,暴露病变椎体及椎间隙,彻底清除病灶至正常骨质。伤口彻底止血后,用过氧化氢溶液、稀碘伏和0.9%氯化钠注射液反复冲洗后逐层关闭切口。将患者更换至俯卧位,取病变节段后正中切口,C形臂X线机透视定位病变椎体。根据病情置入椎弓根钉,于病椎间隙置入置有自体髂骨的椎间融合器。X线透视下确定置钉及融合器的位置情况后 ,清洗伤口后逐层缝合。
3 术后处理 术后给予脊柱外科一级护理,术后第1天预防性应用抗生素头孢唑林1 g、1次/6 h,术后24 h改为头孢唑林1 g、1次/d,应用3 d。术后3 ~4 d拔除引流管。卧床休息两周。在支具保护下下地活动,支具佩戴至术后3个月。术后同时行抗布氏杆菌药物治疗,持续时间3个月,口服多西环素0.1 g、2次/d,利福平0.6 g、1次/d。定期复查血常规、CRP、血沉等炎性指标和肝肾功能。术后12 d伤口仍未愈合者视为伤口不愈合。出现伤口不愈合后视情况予以伤口换药或清创手术 治疗,直至伤口愈合。
4 观察指标 1)患者手术时的年龄、性别、术前症状持续时间、术前抗布氏杆菌治疗时间及术前血液指标[包括白细胞(white blood cell,WBC)、血沉(erythrocyte sedimentation rate,ESR)、降钙素原(procalcitonin,PCT)、血白蛋白]。术前症状持续时间指症状刚出现到手术当天的时间。2)术前是否存在贫血及营养不良,是否合并脊柱外布鲁氏杆菌病,是否合并基础病(包括糖尿病、心脏病和高血压)。3)手术部位(颈椎/胸椎/腰椎)、手术方式 及手术病灶清除程度。
5 统计学方法 采用SPSS 22.0 (IBM,Armonk,NY,USA)统计软件进行分析。两组间计量资料对比根据是否符合正态分布和方差齐性分别应用独立样本t检验或非参数检验分析。计数资料应用χ2检验分析或精确概率检验。单因素logistic回归分析中P<0.05的因素纳入多因素logistic回归模型。应用多因素logistic回归分析影响术后伤口愈合的危险因素并计算相对危险度和95% CI,检验水准为双侧α=0.05。
结 果
1 患者一般资料及术后伤口愈合情况 94例患者中男54例,女40例,平均年龄(47.36 ± 7.32)岁,1 3例(13.83%)出现伤口不愈合。
2 患者术后伤口愈合组与不愈合组临床资料比较 愈合组年龄显著小于不愈合组(P=0.001)。两组在性别、症状持续时间、术前抗布氏杆菌治疗时间及是否存在贫血与营养不良方面无统计学差异。愈合组糖尿病患病率低于不愈合组(P=0.021),两组心脏病及高血压病患病率无统计学差异(P=0.636、P=0.977)。手术方式上两组无统计学差异(P=0.203)。在手术病灶清除程度上,不愈合组不能彻底行病灶清除患者占46.15%(6例),显著高于愈合组的9.88%(8例)(P=0.001)。两组WBC、血沉及PCT无统计学差异,但不愈合组的血白蛋白水平(31 g/L)显著低于愈合组(42 g/L)(P<0.001)。见 表1。
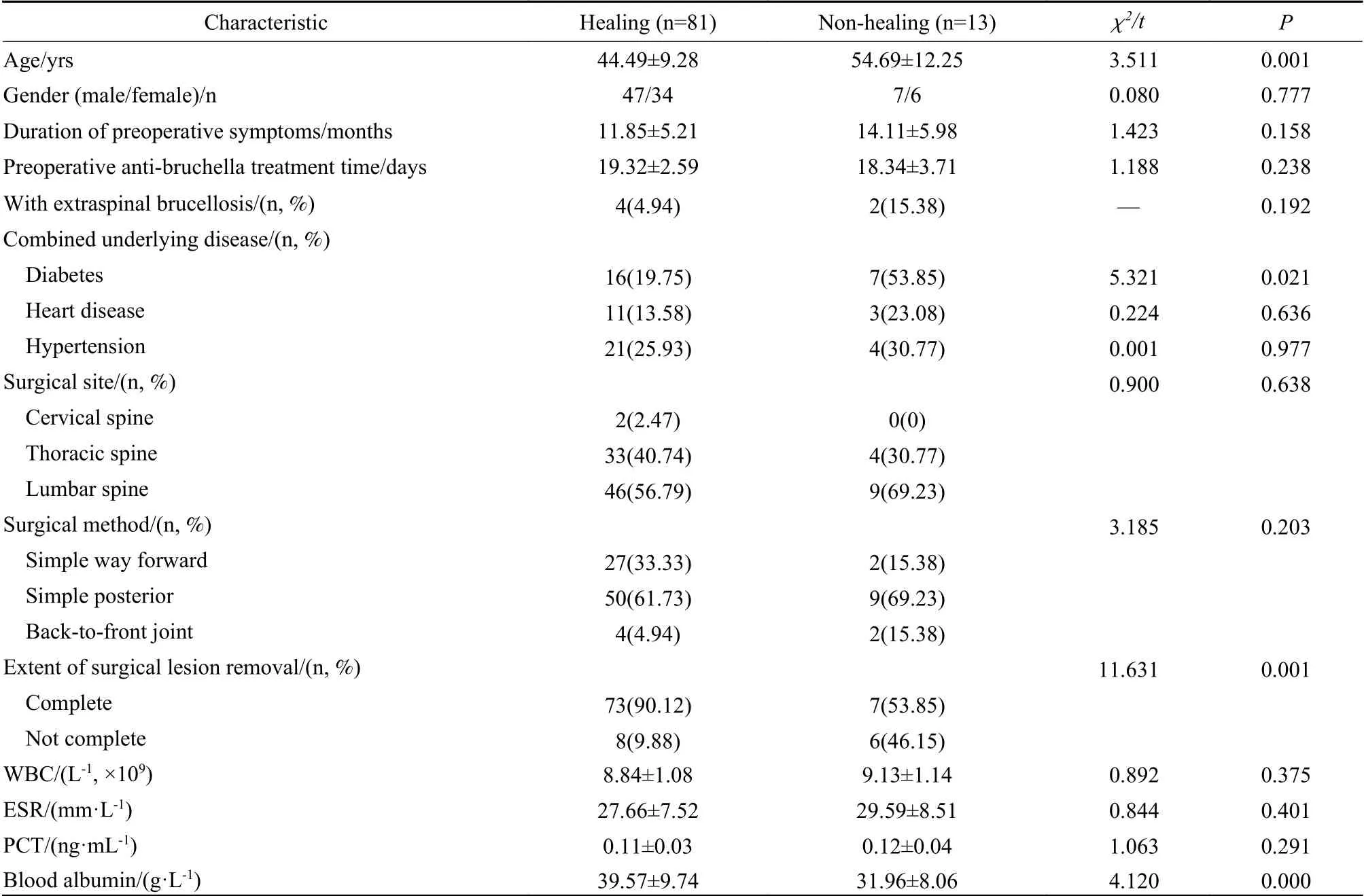
表1 布氏杆菌性脊柱炎患者手术愈合组与不愈合组临床数据比较Tab. 1 Comparison of clinical data about patients with Brucella spondylitis between the two groups
3 患者术后伤口不愈合的危险因素分析 建立logistic回归模型,应变量为患者术后伤口愈合情况,赋值1=不愈合,0=愈合。分别进行单因素和多因素分析。1)单因素分析:将患者的年龄、性别、术前症状持续时间、术前抗布氏杆菌治疗时间、贫血或营养不良、是否合并脊柱外布鲁氏杆菌病、是否合并糖尿病、心脏病、高血压、手术部位、手术方法、病灶清除程度、WBC、ESR及PCT作为布鲁氏杆菌性脊柱炎患者术后伤口不愈合的潜在危险因素纳入logistic分析,相关赋值见表2。单因素分析结果:年龄(P=0.002)、合并糖尿病(P=0.012)、手术病灶清除程度(P=0.002)及血白蛋白(P<0.001)有统计学意义(不再列表赘述)。2)多因素logistic回归:将单因素logistic中年龄、合并糖尿病、手术病灶清除程度及血白蛋白等4指标,作为自变量纳入多因素logistic回归分析模型中,赋值见表2,并采用全模回归方式。回归结果:年龄(OR=1.135,95% CI=1.032 ~1.248,P=0.009)、合并糖尿病(OR=9.020,95% CI=1.294 ~62.885,P=0.026)、手术病灶清除程度(OR=20.911,95% CI=1.908 ~229.141,P=0.013)及血白蛋白水平(OR=0.776,95% CI=0.664 ~0.907,P=0.001)是布鲁氏杆菌脊柱炎患者术后伤口不愈合的显著影响因素,见表3。

表2 布氏杆菌性脊柱炎患者手术伤口不愈合危险因素量化赋值Tab. 2 Assignment of factors associated with Brucella spondylitis for postoperative non-healing wound of spinal tuberculosis
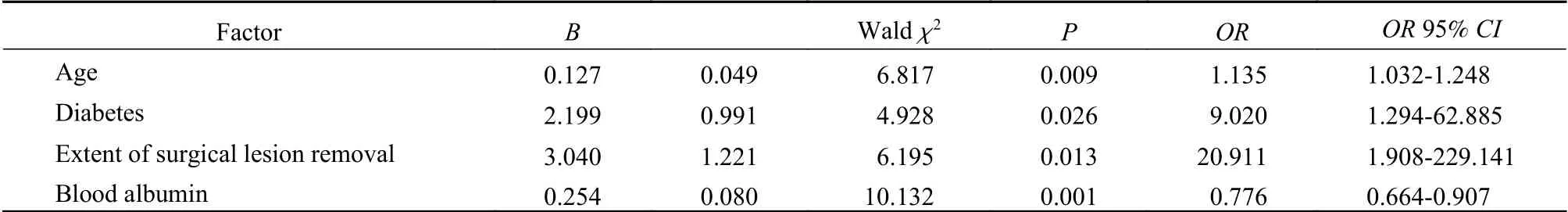
表3 布氏杆菌性脊柱炎患者术后不愈合多因素logistic回归分析Tab. 3 Multivariate logistic regression analysis in associated factors of of non-healing wound of patients with brucella spondylitis
讨 论
布鲁氏杆菌性脊柱炎是由布鲁氏杆菌侵袭脊柱所造成的一种变态反应性疾病。常见的布鲁氏杆菌脊柱炎治疗方法主要有药物治疗和手术治疗。药物治疗主要应用利福平与多西环素[10]。而当患者经过系统性的药物治疗后腰背部疼痛未见明显缓解、出现神经损害症状、出现较大的椎旁脓肿时以及病菌侵蚀椎体造成脊柱不稳定时常需进行手术治疗[11]。但布鲁氏杆菌性脊柱炎的患者手术切口属于污染切口,患者自身抵抗力低下,且容易合并其他细菌感染,因此容易造成伤口不愈合,需行二次甚至多次伤口清创术,对患者的身体以及心理造成一定的影响。本研究发现高龄、合并糖尿病、手术病灶清除不彻底以及术前血白蛋白浓度低为布鲁氏杆菌性脊柱炎患者术后伤口不愈合的危险因素。正规的化疗与术后并发症降低关系密切[12-13]。而在本研究中术前抗布氏杆菌药物治疗的时间并不是伤口不愈合的危险因素,这可能是由于两组患者均在抗布氏杆菌治疗3周左右行手术治疗,两组术前布氏杆菌治疗时间无统计学差异。
布鲁氏杆菌性脊柱炎40岁以上男性中多发[14-15]。随着年龄的增加,人体体质下降,尤其是对于布鲁氏杆菌性脊柱炎这类感染性疾病的患者,由于自身消耗,对手术耐受能力也较差,抵抗力及免疫力相对较低,这就导致患者术后并发症发生率较高。我们的研究发现,年龄增大是布鲁氏杆菌性脊柱炎换患者术后伤口不愈合的重要危险因素之一。随着畜牧业的快速发展,近年来布鲁氏菌病已逐渐在全国范围内流行[16]。高龄布鲁氏杆菌性脊柱炎患者数量和比例都在逐渐增加,高龄患者因感染原因更易出现贫血[17]。>50岁患者恢复能力弱且术后更容易出现贫血、低蛋白血症及其他并发症,导致患者出现伤口不愈合的风险更高,致病情更加复杂多变,常需要清创治疗,甚至需要多次行伤口清创治疗才能促进伤口愈合。所以年龄偏大的患者行手术时,应尽量彻底清除病灶,术后及时复查血常规等生化指标,如出现贫血等症状,必要时可多次、少量输注血液制品,增加患者血红蛋白及血红蛋白等的水平,提高患者抵抗力,减少术后伤口不愈合的概率。
糖尿病是全球最常见的内分泌疾病,而在全球范围内我国是糖尿病患者人数最多的国家[18]。合并糖尿病是脊柱手术后发生伤口感染最重要的独立危险因素之一[19-21]。本研究中,不愈合组中糖尿病患者占53.85%(7/13)。布鲁氏杆菌性脊柱炎合并糖尿病患者因口服降糖药导致体质量增加、皮下脂肪增多,在手术过程中由于术中电凝止血和显露手术视野过程中拉钩的牵拉作用,皮下脂肪破坏,导致患者术后脂肪液化,伤口不愈合。同时糖尿病患者的微血管病变也会引起组织缺血,且糖尿病患者体内的高血糖状态也会导致促进伤口愈合的胶原纤维等物质合成减少,使得患者术后伤口愈合减慢甚至不愈合。因此对于合并布鲁氏杆菌性脊柱炎的糖尿病患者,术前应积极控制血糖,对于血糖控制不佳的患者,应积极联系相关科室调整用药,术后及时监测血糖变化情况。
彻底清理病灶是手术治疗布鲁氏杆菌性脊柱炎成功的关键[22]。布鲁氏杆菌性脊柱炎患者手术切口范围有限,病灶有时难以彻底清除,即使可见的病灶被清除,布鲁氏杆菌也有可能存于体内导致无法完全清除。本研究中的病灶彻底清除或不彻底清除,指在肉眼可见范围内病灶是否被清除干净。病灶清除不彻底导致布鲁氏杆菌残留,成为布鲁氏杆菌脊柱炎患者术后各种并发症乃至复发的基础。相关研究证实,病灶清除不彻底与布鲁氏杆菌性脊柱炎复发密切相关[23]。本研究证实病灶清除不彻底导致术后伤口不愈合发生率增加。在术中应尽量彻底清除病灶,对不能完全清除的病灶,术后应及早应用抗布鲁氏杆菌药物治疗,布鲁氏杆菌的术后药物治疗应遵循“长期、足量、联合、多途径给药”的原则。积极控制布鲁氏杆菌减少各种术后并发症发生[22,24]。
布鲁氏杆菌性脊柱炎患者由于体内布鲁氏杆菌的消耗,导致血清白蛋白水平不同程度降低。而患者术中失血进一步降低血清白蛋白水平。布鲁氏杆菌性脊柱炎合并低白蛋白血症患者术后出现伤口不愈合可能有以下几个原因:1)患者体内白蛋白降低,导致伤口愈合所需的胶原蛋白等物质减少;2)血清白蛋白水平降低,患者体内渗透压降低,伤口渗出增加,导致伤口愈合减慢;3)患者术后分解代谢增强,加重低蛋白血症程度,导致术后伤口不愈合。外科手术后输注白蛋白,能够改善患者临床症状,促进康复[25-26]。所以当布鲁氏杆菌性脊柱炎患者术前生化检查提示血清白蛋白水平较低时,应及时补充营养,提高体内白蛋白水平,降低术后低蛋白血症发生概率。
本研究存在一些不足之处,如样本量较少、随访时间较短、缺少多中心研究。
综上所述,年龄大、合并糖尿病、手术病灶清除不彻底及白蛋白水平低是布鲁氏杆菌性脊柱炎患者术后伤口不愈合的危险因素,合理选择手术适应证、糖尿病患者血糖水平、术后营养支持是降低术后伤口不愈合的关键。

