磁共振动态对比增强扫描定量参数与原发性肝癌患者病理特征及缺氧诱导因子
--1α水平的关系
何承峻,杨小丁,陈海洋
四川大学华西医院资阳医院//资阳市第一人民医院普外科,四川 资阳641300
原发性肝癌包括肝细胞癌和肝内胆管癌,近年来发病率不断增加,是全球癌症相关死亡率的重要病因[1]。原发性肝癌是高发病率高死亡率的恶性肿瘤,手术切除是其最主要的根治性治疗,但术后5 年生存率仅约50%,5年复发率达60%~70%[2]。对未出现肝功能受损的患者,由于主诉模糊和无特异性症状,原发性肝癌早期诊断通常较为困难。影像学检查和实验室检查是原发性肝癌诊断的主要方法,用于原发性肝癌诊断、制定治疗计划、管理和随访的影像学研究包括超声检查、CT和MRI[3]。有研究显示,与CT相比,MRI在原发性肝癌诊断中与病理检查一致性更好[4]。了解肝癌患者临床病理特征是评估患者状况,制定治疗计划和预测患者预后的重要步骤。动态对比增强磁共振成像(DCE-MRI)已在临床广泛应用,其基于三维体积薄层扫描梯度回波T1WI序列,在静脉注射造影剂后快速多相重复扫描获得内脏器官的血流灌注信息,然后通过后处理软件进行分析得到不同的灌注参数[5]。有研究显示,原发性肝癌患者经DCE-MRI技术检测后,多种灌注参数与病灶微血管密度(MVD)、病理分级明显相关[6]。但该研究仅对DCE-MRI定量参数与肝癌病理分析的关系进行分析,未关注患者其他临床病理特征和实验室指标与DCEMRI定量参数的关系,仍需进一步研究。本研究选取94例原发性肝癌患者作为研究对象,以探讨DCE-MRI定量参数与原发性肝癌患者病理特征及缺氧诱导因子-1α(HIF-1α)水平的关系,现报道如下。
1 资料与方法
1.1 一般资料
选取2019年1月~2020年12月收治的94例原发性肝癌患者作为研究对象。纳入标准:符合原发性肝癌诊断标准[7]者;年龄>18岁者;初诊;入组前未接受其他任何抗癌治疗;均接受DCE-MRI检查。排除标准:合并其他恶性肿瘤;有任何DCE-MRI禁忌证;合并其他原发性肝脏疾病;妊娠期妇女。40例肝脏良性结节患者中男性28例,女性12例,年龄26~71(49.09±11.01)岁;血管瘤32例,肝硬化不典型增生6例,肝吸虫2例。94例肝癌患者中,男性71例、女性23例,年龄32~77(49.78±11.16)岁。两组一般资料比较,差异无统计学意义(P>0.05)。本研究已通过医院伦理委员会审核。
1.2 检查方法
所有患者均使用Discovery MR750型MRI扫描仪(GE)进行检查,所有患者均于受检前1 d禁食禁水4 h以上。患者取仰卧位,头先进,体部线圈置于受检者剑突,确保肝脏位于磁体中心;先行平面扫描,T1WI序列:TR 4000 ms、TE 47.5 ms、FOV 42×42,矩阵384×256、层厚6.0 mm、层间距1.8 mm;T2WI序列:TR 4000 ms、TE 47.5 ms、FOV 36×36,矩阵384×256、层厚6.0 mm、层间距1.0 mm。DCE-MRI检查:使用钆喷酸葡胺作为对比剂,经肘正中静脉注入0.2 mmol/kg钆喷酸葡胺,速率2 mL/s,注射完成后静脉注射20 mL生理盐水冲管;行横断面或矢状面DCE-MRI检查,肝脏加速容积采集LAVA-XV序列,参数:TR 5.1 ms、TE 1.7 ms、FOV 380×380、层厚3 mm,连续扫描35个相位,成像时间325 s。图像处理:将扫描图像传输至扫描仪自带工作站,手动勾画病灶感兴趣区,测定血管内至血管外细胞间隙的转运系数(Ktrans)、血管外细胞外间隙转运至血管内的速率常数(Kep)、血管外细胞外间隙体积百分比(Ve)。由2名影像学医师在低倍镜下选定MVD最高处,调至高倍镜下双盲计数并计算平均值作为MVD计数。
1.3 实验室检查
所有受试者均采集清晨空腹外周静脉血,3500 r/min离心5 min后收集上清液,-80 ℃保存待测。采用酶联免疫法测定患者HIF-1α水平,试剂盒购自上海西唐生物科技有限公司,检测步骤严格遵照试剂盒说明书。
1.4 观察指标
评估两组MVD、Ktrans、Kep、Ve及HIF-1α。分析肝癌患者中不同肿瘤分期、不同分化程度、是否有转移、不同HIF-1α水平者DCE-MRI定量参数的差异。
1.5 统计学分析
采用SPSS19.0软件对数据进行统计分析。计量资料以均数±标准差表示,两组间比较采用t检验;性别等计数资料以n(%)表示,组间比较行χ2检验,两变量相关关系分析采用Spearman和Pearson相关分析法。以P<0.05为差异有统计学意义。
2 结果
2.1 两组MVD、Ktrans、Kep、Ve及HIF-1α水平
肝癌患者MVD、Ktrans、Kep、Ve及HIF-1α水平均高于对照组(P<0.05,表1)。典型病例(图1)。

图1 肝癌患者,男性,58岁,Ⅲ期,低分化Fig. 1 A58-year-old male patient with liver cancer,stage III,poorly differentiated.
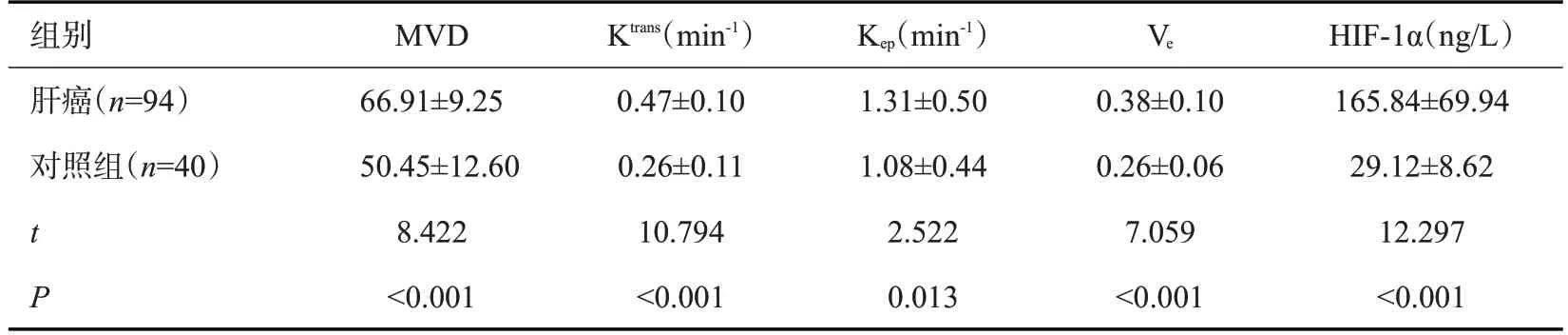
表1 两组MVD、Ktrans、Kep、Ve及HIF-1α水平Tab.1 Levels of MVD,Ktrans,Kep,Ve and HIF-1α in the two groups(Mean±SD)
2.2 不同肿瘤分期肝癌患者DCE-MRI定量参数比较
肝癌患者Ⅲ/Ⅳ期者MVD、Ktrans、Kep、Ve水平均高于Ⅰ/Ⅱ期者(P<0.001,表2)。

表2 不同肿瘤分期肝癌患者DCE-MRI定量参数比较Tab.2 Comparison of DCE-MRI quantitative parameters of liver cancer patients with different tumor stages(Mean±SD)
2.3 不同分化程度肝癌患者DCE-MRI定量参数比较
肝癌低分化患者MVD、Ktrans、Kep、Ve水平均高于中高分化者(P<0.001,表3)。
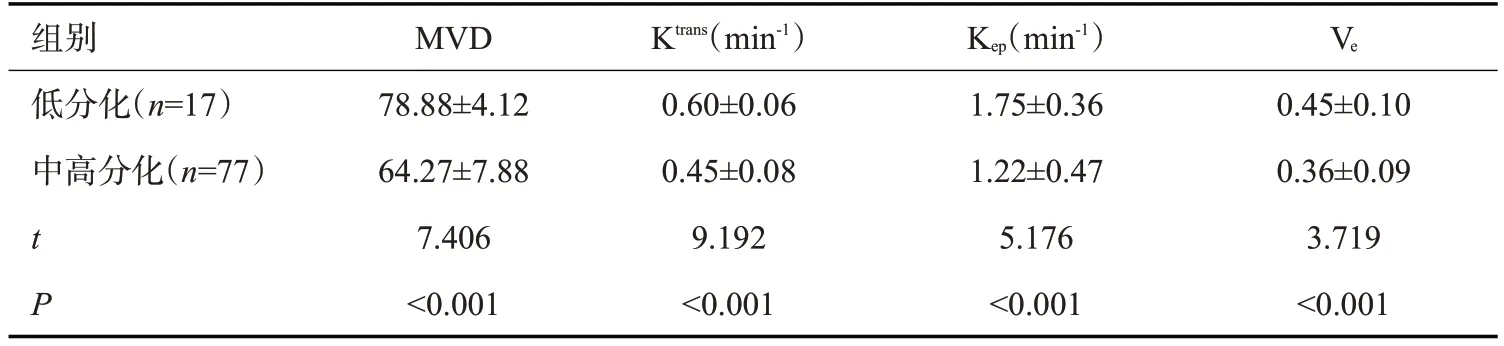
表3 不同分化程度肝癌患者DCE-MRI定量参数比较Tab.3 Comparison of DCE-MRI quantitative parameters of liver cancer patients with different degrees of differentiation(Mean±SD)
2.4 有无淋巴结转移肝癌患者DCE-MRI定量参数比较
有淋巴结转移的肝癌患者MVD、Ktrans、Kep、Ve水平均高于无淋巴结转移者(P<0.05,表4)。

表4 有无淋巴结转移肝癌患者DCE-MRI定量参数比较Tab.4 Comparison of DCE-MRI quantitative parameters of liver cancer patients with and without lymph node metastasis(Mean±SD)
2.5 不同HIF-1α水平肝癌患者DCE-MRI定量参数比较
以肝癌患者HIF-1α中位数(162.96 ng/L)作为界限对其进行分组。HIF-1α≥162.96 ng/L的肝癌患者MVD、Ktrans、Kep、Ve水平均高于HIF-1α<162.96 ng/L 者(P<0.05,表5)。

表5 不同HIF-1α水平肝癌患者DCE-MRI定量参数比较Tab.5 Comparison of DCE-MRI quantitative parameters of liver cancer patients with different HIF-1α levels(n=47,Mean±SD)
2.6 肝癌患者DCE-MRI定量参数与临床病理特征及HIF-1α的关系
Spearman 相关分析法显示:肝癌临床分期与MVD、Ve呈正相关关系(P<0.05),肝癌淋巴结转移与Ktrans、Ve呈正相关关系(P<0.05)。Pearson相关分析法显示:HIF-1α与MVD、Ktrans、Kep、Ve呈正相关关系(P<0.05,表6)。
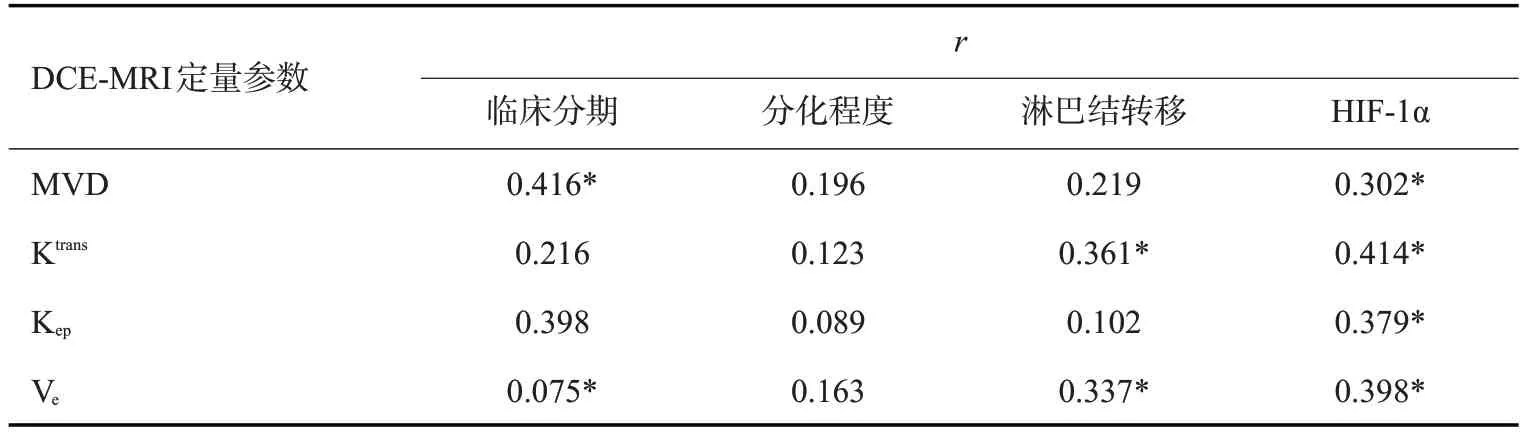
表6 肝癌患者DCE-MRI定量参数与临床病理特征及HIF-1α的关系Tab.6 The relationship between DCE-MRI quantitative parameters and clinicopathological features and HIF-1α in HCC patients
3 讨论
DCE-MRI定量参数分析可以反映组织的血流灌注、微血管通透性等信息,能客观地评价病变内部的病理生理特征[8],在肝癌诊断、分期及预后方面有重要作用。有研究显示,DCE-MRI对宫颈癌患者的临床病理学特性具有一定的评估价值[9]。但目前国内相关研究中,DCE-MRI多应用于肝癌鉴别诊断中。动物实验显示,DCE-MRI定量参数Ktrans和MVD相关,可无创评估肝癌的肿瘤血管生成状况[10]。而相关研究显示,DCEMRI定量参数与肿瘤增殖状态、组织学分级或MVD,存在弱但显著相关性的关系,这说明DCE-MRI评估肝癌临床病理特征方面是可行的,也为肝癌鉴别诊断提供一个新的途径[11]。肝癌多为富血供肿瘤,是一种以新生血管形成和血管侵犯为特征的肿瘤,微血管形成也是肿瘤增殖、复发和转移的主要机制之一[12]。HIF-1α是具有较强的诱导血管生成能力的血管生成因子,其表达情况与肝癌肿瘤分期、包膜完整性、肿瘤转移均存在相关性,是影响患者预后的重要指标[13]。本研究分析DCE-MRI定量参数与原发性肝癌患者病理特征及HIF-1α的关系,也发现各指标存在关联。
本研究结果显示,肝癌患者各DCE-MRI定量参数及HIF-1α水平均高于对照组,与相似研究结果一致[14-15]。肝脏有血管内间隙、血管外细胞外间隙和细胞内间隙3个间隙,Ktrans是指对比剂分子从血液进入血管外细胞外间隙的速率,Kep是指对比剂分子由血管外细胞外间隙回到血管内的速率,Ve指血管外细胞外间隙内对比剂的容积分数[16]。DCE-MRI定量参数与肿瘤病灶组织内血管灌注情况、血流情况和血管通透性等均相关。肝癌作为恶性肿瘤,其血供主要是肝动脉,血供丰富,故MVD水平显著高于对照组。同时,由于肝癌组织富含新生血管,血流量和血管通透性增高,造影剂更易在血管内间隙、血管外细胞外间隙和细胞内间隙活动,故Ktrans、Kep、Ve水平更高。而正常肝组织血液主要来自门静脉,细胞结构密集,血流量或血管通透性不如肝癌[17]。
本研究结果显示,在临床病理特征方面,不同肿瘤分期、不同分化程度、有无淋巴结转移肝癌患者MVD、Ktrans、Kep、Ve水平各DCE-MRI定量参数水平差异显著,这提示应用DCE-MRI定量参数了解肝癌患者临床病理特征是可行的。实体瘤的发生、生长和转移依赖于血管生成,肿瘤血管生成不仅是血管数量的增多,血管壁结构也发生异常,内皮细胞间隙增大、基底膜增厚或变细等[18],均是肿瘤血供变化的原因。肿瘤血供变化与其发生进展相互影响,因此肿瘤病灶异常的血管结构,会导致其灌注情况、通透性变化,使肿瘤组织获得更丰富的血供,继而支持肝癌发生进展,故肿瘤分期越晚,DCE-MRI灌注参数越高。同时,低分化肝癌患者肿瘤细胞恶性程度高、侵袭性强,所需营养物质就越多。有研究显示,高分化肝癌进展为中分化,其肿瘤组织动脉供血表现出增加趋势[19]。在这种情况下,肿瘤组织发生恶性侵袭性行为,致使新生血管增加,改变组织血管结构,也会导致DCE-MRI检查时低分化肿瘤组织表现出更高的灌注参数水平。但本研究数据显示,肿瘤分化程度与DCE-MRI灌注参数线性相关关系不显著。有文献指出,肿瘤在中、高分化时,有氧代谢突出,尤其是低分化时,伴有大量无氧酵解,促使低分化时血供下降[20]。故部分低分化肝癌患者血供可能相对丰富,但不足以与灌注参数呈现线性相关关系。本研究还显示,肝癌临床分期与MVD、Ve呈正相关关系,肝癌淋巴结转移与Ktrans、Ve呈正相关关系,HIF-1α与各灌注参数均呈正相关关系。HIF-1α在肝癌组织中高表达,能通过激活血管内皮生长因子的转录,促进血管生成及肿瘤的侵袭和转移,并维持着肿瘤细胞的代谢,是肝癌发生发展过程中重要的调控蛋白之一[21]。因此,HIF-1α表达水平与肿瘤组织血管生成、血供和血流动力学密切关联。临床可综合应用HIF-1α水平与DCE-MRI灌注参数评估肝癌患者病情进展程度及预后情况。
综上所述,肝癌患者DCE-MRI灌注参数及HIF-1α水平显著升高,且各灌注参数水平与患者临床分期、有无淋巴结转移和HIF-1α水平存在关联性,DCE-MRI灌注参数具有实际应用价值。