实时三维超声心动图、二维斑点追踪技术联合血浆游离细胞DNA水平评估心肌梗死患者右房容积及心肌受损的价值
王佳玲 张 瑜 王春燕
急性下壁心肌梗死(acute inferior myocardial infarction,AIMI)可导致心肌灌注减少,继而引发心肌梗死[1]。目前对 AIMI 伴右室心肌梗死(right ventricular myocardial infarction,RVMI)患者右房改变的研究较少。右房在维持右室充盈及调节心输出量方面具有重要意义,二维超声心动图可以简单评价右房结构和功能,但其对右房功能评估的准确性较差,且观察结果易受操作者主观性的影响[2]。实时三维超声心动图(real-time three-dimensional echocardiography,RT-3DE)可以实时、动态地显示心脏三维结构和功能变化,对右房形态和功能的评价具有一定优势[3]。二维斑点追踪(two-dimensional speckle tracking imaging,2D-STI)技术可以对心肌运动进行多方向、多参数评估,且不受心肌运动方向、声束方向及心肌运动过程中邻近组织牵引的影响[4]。研究[5]表明,心肌梗死发生后,心肌细胞广泛损伤并释放大量游离DNA(cellfree DNA,cf DNA)进入血液循环中,通过检测血浆cf DNA水平可在一定程度上反映心肌细胞的损伤程度。基于此,本研究应用RT-3DE、2D-STI 联合血浆cf DNA水平评估AIMI 伴RVMI 患者右房各时相容积改变及心肌受损情况,探讨其临床应用价值。
资料与方法
一、研究对象
选取2018 年1 月至2021 年1 月我院初诊为AIMI的患者 98 例,其中男 51 例,女 47 例,年龄 43~62 岁,平均(55.78±3.21)岁。纳入标准:①年龄>18 岁;②初次诊断为AIMI;③发作时间>12 h;④于本院接受经皮冠状动脉介入术治疗。排除标准:①心肌梗死病史;②心血管疾病及相关手术史;③严重感染性疾病;④肿瘤疾病史、严重的肝肾功能障碍。AIMI 诊断标准[6-7]:①具有典型缺血性胸痛症状;②症状持续时间≥30 min;③心电图Ⅱ、Ⅲ、aVF 下壁导联中出现ST 段抬高且幅度≥0.1 mV;④心肌坏死标志物水平超过正常值2倍以上。AIMI 伴 RVMI 诊断标准[7]:①符合 AIMI 诊断标准;②发病 12 h 内心电图 V1 或 V4R 导联 ST 抬高且幅度>0.1 mV。98 例患者根据AIMI 是否伴RVMI 分为单纯 AIMI 组 50 例和 AIMI 伴 RVMI 组 48 例,另选同期年龄、性别与之匹配的38例体检健康者为对照组。本研究经我院医学伦理委员会批准,所有受检者均签署知情同意书。
二、仪器与方法
1.仪器:使用Philips EPIQ 7C 彩色多普勒超声诊断仪,S5-1探头,频率1~5 MHz。
2.二维超声心动图检查:患者取左侧卧位,于心尖四腔心切面最大程度显示右房,测量其横径(RAT)、上下径(RAL)、面积(RAA)、舒张末期面积(RVEDA)、收缩末期面积(RVESA)、面积变化分数(RVFAC),以及三尖瓣口舒张早期前向血流速度峰值(E)、三尖瓣口舒张末期前向血流速度峰值(A)、三尖瓣环收缩期运动速度峰值(S’)、三尖瓣环舒张早期运动速度峰值(e’),计算E/e’和三尖瓣环收缩期位移(TAPSE)。
3.RT-3DE 检查:启动全容积成像模式,嘱患者呼气末屏气,采集右房连续7个心动周期的全容积图像,速率(28±5)帧/s。首先在心尖四腔心切面和两腔心切面上最大程度显示右房,然后在右室舒张末期和收缩末期选取5 个采样点(分别为三尖瓣根部与右房相交的前壁侧、后壁侧、侧壁侧、间隔侧及右房顶部),通过软件自动对右房三维心内膜容积图像进行跟踪描绘,建立右房时间-容积曲线。若右房壁薄,则手动调整右房内膜轮廓尽量与实际内膜边界相符合。获得右房最大容积指数(RAVmaxI)、右房最小容积指数(RAVminI)、右房收缩前容积指数(RAVpreI)、右房总排空容积指数(TSVI)、右房被动排空容积指数(PSVI)、右房主动排空容积指数(ASVI)、右房总排空分数(TEF)、右房扩张指数(EI)、右房主动排空分数(AEF)、右房被动排空分数(PEF)。
4.2D-STI 检查:嘱患者呼气末屏气,对右房进行连续3 个心动周期的图像采集,速率≥50 帧/s。首先在心尖四腔心切面勾画右房心内膜轮廓,如与实际情况不符,则手动调整心内/外膜边缘曲线、感兴趣区宽度尽量与实际一致。自动分析右房各壁(共计6个节段)的感兴趣区,生成各节段心肌的平均应变-时间曲线,获得右房心肌应变相关指标:心肌正向应变(LSpos)、负向应变(LSneg)及二者绝对值之和(LStot),分别可以评估右房导管功能、收缩功能及储蓄功能。
上述检查均由两位经验丰富的超声医师根据美国超声心动图协会制定的超声心动图规范化操作流程[8]完成,所有数据均重复测量3次取平均值。
5.实验室血浆cf DNA检测:所有受检者入院后2 h内采集肘部外周静脉血5 ml,使用QIAamp 循环核酸试剂盒、Quanti-iT PicoGreen dsDNA 试剂盒(赛默飞世尔科技有限公司)并严格遵照说明书提取与检测血浆cf DNA。对每个样本进行复测读数,计算平均值作为最终浓度。
三、统计学处理
结 果
一、各组一般资料比较
各组间年龄、性别、体质量指数、心率、高血压病史、糖尿病史及吸烟史方面比较差异均无统计学意义。见表1。

表1 各组一般资料比较
二、各组二维超声心动图指标比较
各组二维超声心动图指标中e’、E/e’、TAPSE比较差异均有统计学意义(均P<0.05),其余指标比较差异均无统计学意义。两两比较发现,AIMI伴RVMI组E/e’较对照组和AIMI组增大,e’、TAPSE 均减小,差异均有统计学意义(均P<0.05),其余指标比较差异均无统计学意义。AIMI 组与对照组间各指标比较差异均无统计学意义。见表2。
表2 各组二维超声心动图指标比较()

表2 各组二维超声心动图指标比较()
对照组比较,aP<0.05;与AIMI 组比较,bP<0.05。RAL:右房上下径;RAT:右房横径;RAA:右房面积;RVEDA:右房舒张末期面积;RVESA:右房收缩末期面积;RVFAC:右房面积变化分数;E:三尖瓣口舒张早期前向血流速度峰值;A:三尖瓣口舒张末期前向血流速度峰值;S’:三尖瓣环收缩期运动速度峰值;e’:三尖瓣环舒张早期运动速度峰值;TAPSE:三尖瓣环收缩期位移
TAPSE(mm)19.72±2.11 18.96±2.15ab 21.03±1.98组别AIMI组AIMI伴RVMI组对照组RAL(mm)37.41±6.01 38.23±5.97 36.28±5.07 RAT(mm)31.46±5.76 32.19±6.11 30.64±3.52 RAA(cm2)14.87±3.92 15.31±4.33 14.16±3.24 RVEDA(cm2)16.31±2.12 15.58±2.21 16.59±2.57 RVESA(cm2)9.47±1.96 8.89±1.87 9.79±2.03 RVFAC(%)46.98±4.56 46.67±4.59 46.97±4.03 E(cm/s)60.11±4.28 58.74±5.63 59.18±3.26 A(cm/s)59.32±6.47 59.01±6.13 56.27±6.53 S’(cm/s)12.01±3.65 11.98±2.87 10.79±3.72 e’(cm/s)9.15±1.29 8.21±1.81ab 9.17±1.28 E/e’5.76±1.47 7.63±1.32ab 5.78±1.05 10.498 0.000 F值P值1.221 0.298 0.884 0.416 0.927 0.398 2.316 0.103 2.420 0.093 0.074 0.929 0.932 0.396 2.852 0.061 1.7005 0.186 6.278 0.002 31.310 0.000
三、各组RT-3DE指标比较
各组RT-3DE指标中RAVmaxI、RAVminI、RAVpreI、TSVI、PSVI、ASVI、PEF 比较差异均有统计学意义(均P<0.05),其余指标比较差异均无统计学意义。两两比较发现,AIMI伴RVMI组RAVmaxI、RAVminI、RAVpreI、TSVI、PSVI、ASVI 均较对照组和 AIMI 组增大,PEF 减小,差异均有统计学意义(均P<0.05),其余指标比较差异均无统计学意义。AIMI 组与对照组间各指标比较差异均无统计学意义。见表3和图1。

图1 AIMI组和AIMI伴RVMI组RT-3DE图
表3 各组RT-3DE指标比较()
与对照组比较,aP<0.05;与AIMI组比较,bP<0.05。RAVmaxI:右房最大容积指数;RAVminI:右房最小容积指数;RAVpreI:右房收缩前容积指数;TSVI:右房总排空容积指数;PSVI:右房被动排空容积指数;ASVI:右房主动排空容积指数;EI:右房扩张指数;TEF:右房总排空分数;PEF:右房被动排空分数;AEF:右房主动排空分数
AEF(%)36.12±8.76 32.55±7.13 35.97±8.34 2.913 0.058组别AIMI组AIMI伴RVMI组对照组F值P值RAVmaxI(ml/m2)24.01±4.28 32.15±5.01ab 23.49±4.06 53.921 0.000 RAVminI(ml/m2)10.49±2.17 14.02±3.21ab 9.92±1.93 35.080 0.000 RAVpreI(ml/m2)16.31±3.27 21.05±4.57ab 15.28±3.02 30.952 0.000 TSVI(ml/m2)14.32±2.56 18.21±2.01ab 13.61±2.11 54.901 0.000 PSVI(ml/m2)8.61±2.53 11.26±2.97ab 8.01±2.76 17.817 0.000 ASVI(ml/m2)5.12±2.93 8.93±2.95ab 4.65±2.28 32.855 0.000 EI(%)131.21±26.19 125.01±15.43 128.21±18.22 1.097 0.337 TEF(%)56.14±7.68 53.42±7.54 55.97±8.25 1.796 0.170 PEF(%)56.09±8.21 53.18±7.22ab 58.32±7.15 4.987 0.008
四、各组2D-STI指标比较
各组 2D-STI 指标中 LSpos、LStot 比较差异均有统计学意义(均P<0.05),LSneg 比较差异无统计学意义。两两比较发现,AIMI 伴 RVMI 组 LStot、LSpos 均较对照组和AIMI 组减低,差异均有统计学意义(均P<0.05),LSneg比较差异无统计学意义。AIMI组与对照组各指标比较差异均无统计学意义。见表4和图2。
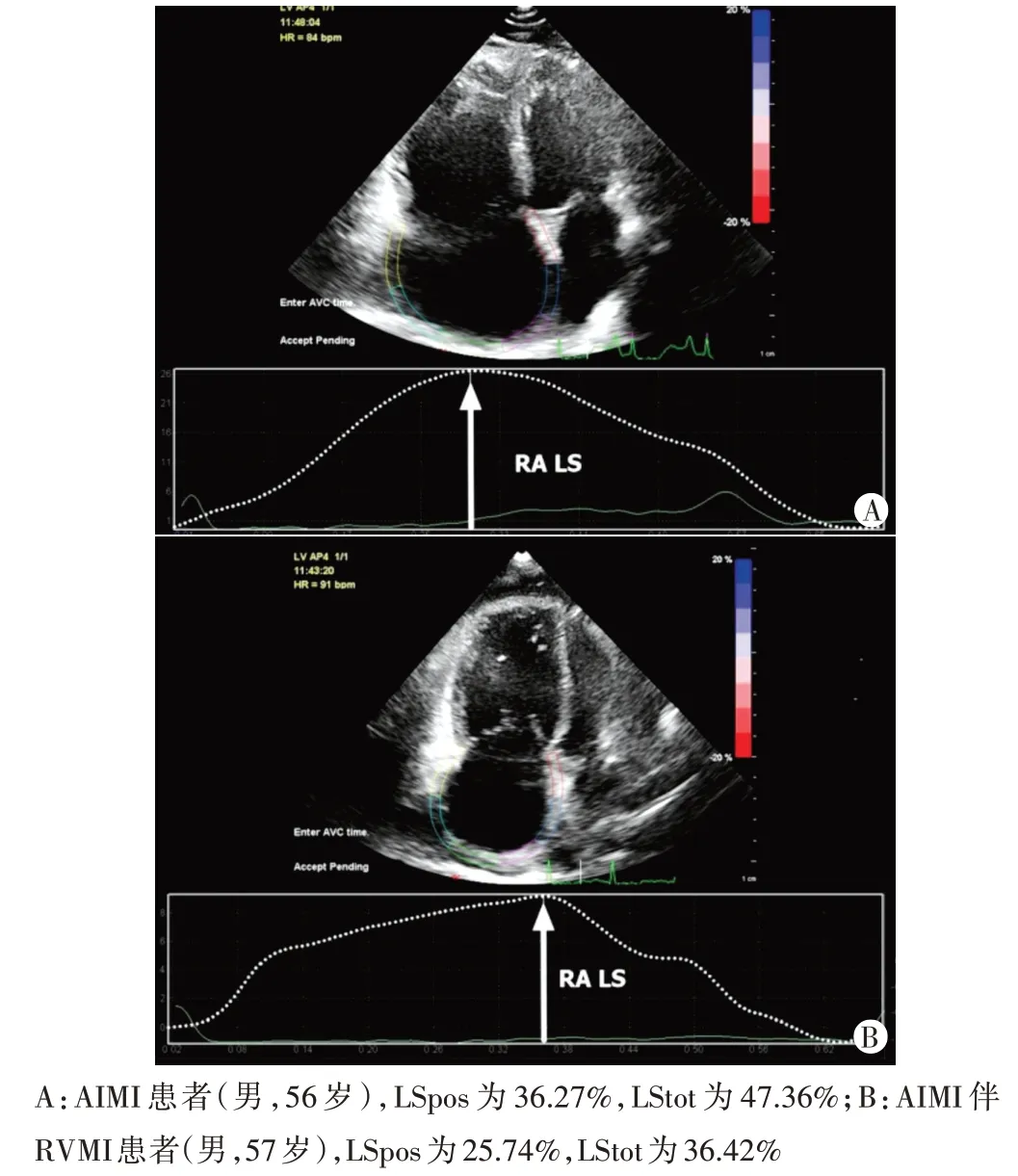
图2 AIMI组和AIMI伴RVMI组2D-STI图
表4 各组2D-STI指标比较() %

表4 各组2D-STI指标比较() %
与对照组比较,aP<0.05;与AIMI 组比较,bP<0.05。LSpos、LSneg、LStot分别为心肌正向应变、负向应变及二者绝对值之和
LStot 46.21±9.67 37.12±7.29ab 45.96±10.13 15.329 0.000组别AIMI组AIMI伴RVMI组对照组F值P值LSpos 35.64±5.17 26.38±5.12ab 36.11±5.23 52.132 0.000 LSneg 8.76±3.24 8.01±3.45 9.55±4.12 1.971 0.143
五、各组血浆cf DNA水平比较
AIMI组、AIMI伴RVMI组和对照组血浆cf DNA水平分别为(6543.28±847.25)ng/ml、(6649.52±539.12)ng/ml、(1213.46±137.14)ng/ml,差异有统计学意义(F=1065.215,P=0.000)。两两比较发现,AIMI 伴 RVMI 组血浆cf DNA 水平高于对照组和 AIMI 组(t=79.326、81.435,均P=0.000);AIMI 组血浆 cf DNA 水平高于对照组(t=80.136,P=0.000)。
六、ROC曲线分析
ROC曲线分析显示,RT-3DE、2D-STI、血浆cf DNA水平联合诊断AIMI 伴RVMI 的曲线下面积、敏感性、特异性分别为0.908、90.0%、91.7%,与各方法单独及两两联合应用比较差异均有统计学意义(均P<0.05)。见表5和图3。
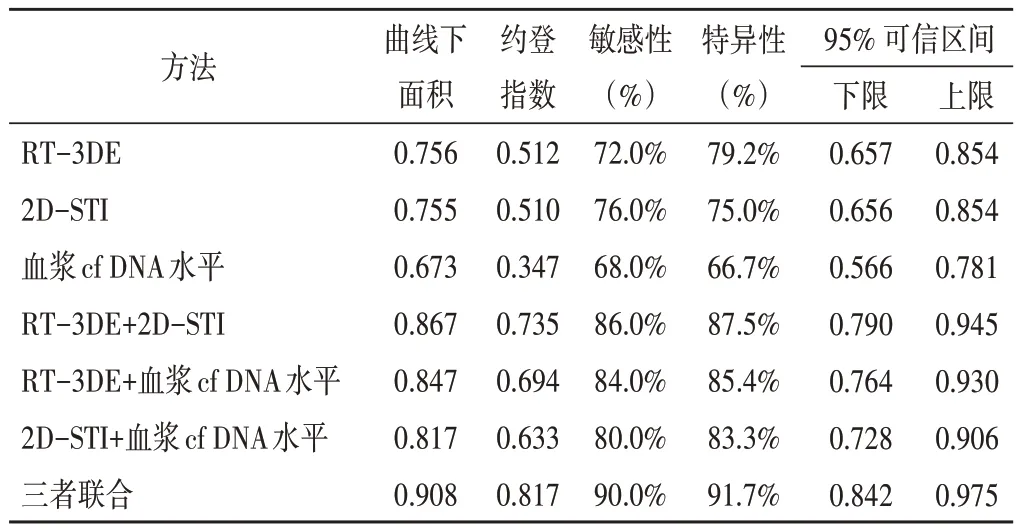
表5 RT-3DE、2D-STI、血浆cf DNA水平单独及联合诊断AIMI伴RVMI的ROC曲线分析

图3 RT-3DE、2D-STI、血浆cf DNA水平单独或联合诊断AIMI伴RVMI的ROC曲线图
讨 论
研究[9]表明,超过50%的AIMI患者常伴有RVMI,且AIMI 伴RVMI 患者的休克率及病死率均明显增高。然而以往研究大多仅关注AIMI 伴或不伴RVMI 对右室功能的影响,对右房功能影响的研究较少。右房在维持右室输出中有重要作用,与右室功能密切相关,AIMI 伴 RVMI 时可能影响右房功能[10]。因此,本研究应用 RT-3DE、2D-STI 对 AIMI 伴 RVMI 患者右房各时相容积功能进行量化分析,联合血浆cf DNA 水平评估其心肌受损情况。
右房主要在右室收缩期储蓄血液,舒张早期将血液从全身血管床流向右室,舒张末期对血液增压泵送[8]。而右房各时相容积由多种因素决定,舒张功能受损和右室顺应性降低可导致右房舒张期充盈压力增加。本研究AIMI 伴RVMI 组患者右室收缩和舒张功能均受损,充盈压力升高,超出代偿性扩张,导致RAVmaxI 增加。随着右室舒张功能进一步下降,其抽吸功能受损,导致右房内血液淤滞,引起RAVpreI 增加。本研究二维超声心动图检查结果发现,与AIMI组和对照组比较,AIMI 伴 RVMI 组 E/e’增大,e’、TAPSE均减小,差异均有统计学意义(均P<0.05),说明AIMI伴RVMI 患者右室收缩和舒张功能受损。RT-3DE 可对右房进行实时三维全容积图像采集,且测值较二维超声心动图更准确,本研究RT-3DE 检查结果显示,与AIMI 组和对照组比较,AIMI 伴RVMI 组右房各时相 容 积 指 数(RAVmaxI、RAVminI、RAVpreI、TSVI、PSVI、ASVI)均增大,PEF 减低,差异均有统计学意义(均P<0.05)。主要原因可能是AIMI 伴RVMI 时,右室顺应性减低,血液聚集在右室,心肌收缩性受损导致右房内血液淤积,可能引起中心静脉压力和右房各时相容积增加[11]。此外,右房具有心肌壁薄及变形能力强的特点,也使得右房容积变化的敏感性增高。Kanar等[12]发现,AIMI 伴 RVMI 患者右房各时相容积增加,右房导管功能受损,本研究结果与其相似。表明二维超声心动图和RT-3DE 均有助于临床诊断AIMI 伴RVMI患者。
2D-STI 能实时、有效地对心肌斑点进行跟踪,可以更准确地评价心肌局部和整体功能,还可以评价各种疾病状态下的心房功能[13]。本研究2D-STI 检查结果显示,与 AIMI 组和对照组比较,AIMI 伴 RVMI 组LStot 和 LSpos 均降低(均P<0.05),而 LSneg 比较差异均无统计学意义,分析原因可能是2D-STI识别右房心肌变形能力的敏感性高,AIMI 伴RVMI 患者右房最大容积增大,全身静脉血液回流入右房的容量增多,导致右房心肌纤维过度伸展,超过心肌自身限度,使心肌变形能力受损,故心肌整体应变减低。Nourian等[14]研究结果表明,AIMI 伴RVMI 患者的导管功能和储蓄功能均较单纯AIMI 患者降低,差异均有统计学意义(均P<0.05),而二维超声心动图测得的右房各时相容积比较差异无统计学意义;本研究结果与其相似。表明2D-STI也有助于临床诊断AIMI伴RVMI。
研究[15]表明,在大部分伴有细胞坏死和凋亡的疾病中,血浆cf DNA 水平显著升高,因此在AIMI 的发生、发展过程中cf DNA 水平也会发生变化。本研究结果显示,AIMI 伴RVMI 组患者血浆cf DNA 水平均高于对照组和AIMI 组(均P<0.05),说明血浆 cf DNA 可以补充现有心肌损伤生物标志物,作为一种实验室辅助诊断方式,有助于AIMI伴RVMI患者与单纯AIMI患者的鉴别诊断。本研究绘制ROC 曲线分析RT-3DE、2D-STI、血浆cf DNA 水平单独或联合应用诊断AIMI伴RVMI的价值,发现三者联合应用的曲线下面积、敏感性、特异性均最高,与各方法单独及两两联合应用比较差异均有统计学意义(均P<0.05),说明RT-3DE、2D-STI 联合血浆 cf DNA 水平提高了 AIMI 伴 RVMI 的诊断效能。
综上所述,RT-3DE、2D-STI 联合血浆 cf DNA 水平能准确评估AIMI 伴RVMI 患者右房各时相容积改变及心肌受损情况,为临床治疗方案的选择提供依据。

