血液中5 种蘑菇毒素的UPLC-HRMS 分析
刘文乔,施妍,向平,于峰,谢冰,董玫,哈婧,马春玲,文迪
1.河北医科大学法医学院 河北省法医学重点实验室 河北省法医分子鉴定协同创新中心 河北医科大学法医鉴定中心,河北 石家庄 050017;2.河北科技大学化学与制药工程学院,河北 石家庄 050018;3.司法鉴定科学研究院 上海市法医学重点实验室 司法部司法鉴定重点实验室 上海市司法鉴定专业技术服务平台,上海200063
毒蘑菇是指含有不同类型毒素的大型真菌[1]。全世界毒蘑菇种类约有100 余种,其中30 余种含有致死性毒素[2-3]。由于很多有毒蘑菇与食用蘑菇外观上难以区分,因而很容易混淆造成严重的食物中毒[4]。在世界范围内,每年有数百例蘑菇中毒致死案件[5-6]。根据国家突发公共卫生事件管理信息系统的数据,蘑菇中毒是我国食物中毒死亡的主要原因[7]。目前已经确定的蘑菇毒素种类主要包括环型多肽、毒蝇碱、色胺类化合物、异恶唑衍生物、鹿花菌素、鬼伞素及奥来毒素7 类[8]。由于蘑菇毒素的种类不同,而且这些毒素的化学结构也不同,因此在血液样品中建立一种快速、准确的蘑菇毒素分析方法对于蘑菇中毒事件的法医学鉴定和临床早期诊断至关重要。目前已有测定生物样本中蘑菇毒素的方法,如毛细管电泳(capillary electrophoresis,CE)[9]、气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)[10]、高效液相色谱(high performance liquid chromatography,HPLC)[11-14]、高效液相色谱-质谱联用(high performance liquid chromatography-mass spectrometry,HPLC-MS)[4,15-19]、高效液相色谱-高分辨质谱联用(high performance liquid chromatography-high resolution mass spectrometry,HPLC-HRMS)[20-22]。本 研究拟建立同时测定血液样品中α-鹅膏毒肽、羧基二羟鬼笔毒肽、蝇蕈醇、毒蝇碱和赛洛新5 种蘑菇毒素的超高压液相色谱-高分辨质谱联用(ultra-high performance liquid chromatography-high resolution mass spectrometry,UPLC-HRMS)分析方法。
1 材料与方法
1.1 主要仪器与试剂
UltiMateTM3000 高效液相色谱仪串联Q ExactiveTMFocus 质谱仪(美国Thermo Fisher Scientific 公司);ACQUITY Premier CSH C18色谱柱(100 mm×2.1 mm,1.7 μm;美国Waters 公司);Acquity Premier CSHTMC18 VanGuardTM保护柱(5 mm × 2.1 mm,1.7 μm;美国Waters 公司);MicroCL 21R 高速冷冻离心机(美国Thermo Fisher Scientific 公司);LSETM旋涡振荡器(美国CORNING 公司);KQ-500DE 型数控超声波清洗器(昆山市超声仪器有限公司);Milli-Q IQ 超纯水系统(美国Millipore 公司);Cleanert PAX(50 mg PAX)、Cleanert MAS-QuEcHERS 系列Cleanert®C18净化管[25 mg C18,25 mg 乙二胺-N-丙基硅烷(primary-secondary amine,PSA),150 mg MgSO4;天津博纳艾杰尔科技有限公司]。
α-鹅膏毒肽、羧基二羟鬼笔毒肽、蝇蕈醇、毒蝇碱和赛洛新标准品溶液(美国Sigma 公司);抗坏血酸(美国Sigma 公司);甲醇、乙腈(色谱级,美国Thermo Fisher Scientific 公司);甲酸(色谱级,北京DiKMA 公司);实验用水均由Milli-Q IQ 超纯水系统制备。
1.2 标准溶液的配制
分别将α-鹅膏毒肽、羧基二羟鬼笔毒肽和赛洛新用甲醇配制成0.1 mg/mL 的单个分析物储备溶液,蝇蕈醇和毒蝇碱用纯水配制成0.1 mg/mL 的单个分析物储备溶液。精密移取各标准品储备溶液适量,用甲醇-水溶液(V甲醇∶V水=1∶1)配制成各分析物质量浓度为10 μg/mL 的混合标准溶液。所有储备溶液和工作溶液均避光储存于-20 ℃冰箱内。
1.3 样品前处理
取血液样品200 μL,加入5 μL 0.1 mol/L 的抗坏血酸,再加入800 μL 乙腈-水溶液(V乙腈∶V水=3∶1),充分混匀并涡旋30 s,超声混匀10 min 后,在4 ℃下以离心半径8.5 cm,12 000 r/min,离心5 min,将上清液移取至Cleanert PAX 中,涡旋振荡30 s 后置于高速离心机以离心半径10 cm,12 000 r/min,再次离心5 min,取上清液用纯水稀释1 倍经0.2 μm 滤膜过滤,供UPLCHRMS 分析。
1.4 UPLC-HRMS 检测
ACQUITY Premier CSH C18色谱柱:柱温40 ℃,流速200 μL/min,进样量5 μL。流动相为0.1%甲酸水溶液(A)和甲醇(B)。梯度洗脱程序:0~3 min 2%B,3~5 min(2%~50%)B,5~10 min(50%~70%)B,10~12 min(70%~95%)B,12~12.01 min(95%~2%)B,12.01~15 min 2%B。整个分析过程中样品置于4 ℃自动进样器中。
以电喷雾离子源(electrospray ionization,ESI)在FullMS-ddMS2正离子扫描模式下扫描;一级质谱质量扫描范围为m/z100~1 000,分辨率为70 000;二级分辨率为15000;碰撞能量(collision energy,NCE)为30eV;喷雾电压3.2 kV,辅助加热器温度为300 ℃,毛细管温度为320 ℃;鞘气30 L/min,辅助气15 L/min。所有质量数的提取均基于5×10-6的质量窗口。每天使用正离子模式校准溶液对Q ExactiveTMFocus 质谱仪进行外部质量校准。数据的采集和处理使用Xcalibur 4.0软件(美国Thermo Fisher Scientific 公司)。
质谱参数结合蠕动针泵进行输注,通过全扫描和子扫描在正离子和负离子模式下对每种分析物进行优化。所有分析物均在正离子扫描模式下信号响应最强,除毒蝇碱的分子离子为[M]+,其他分析物的分子离子均为[M+H]+,同时也确定了母离子和子离子的精确质量数(表1)。

表1 5 种蘑菇毒素的UPLC-HRMS 参数Tab.1 UPLC-HRMS parameters of 5 mushroom toxins
1.5 方法学验证
检出限、定量限和线性:取空白全血添加混合标准溶液,分别配制成0.05、0.1、0.2、0.5、1、2、5、10、20、50、100、500 和1 000 ng/mL 的加标血液样品。按1.3节和1.4 节方法进行前处理和分析。根据各种分析物的保留时间和碎片离子定性,以色谱峰面积进行定量,以信噪比(signal-noise,S/N)≥3 时对应的质量浓度作为检出限,以信噪比S/N≥10 时对应的质量浓度作为定量限。以各被测物浓度为横坐标(x),以被测物峰面积为纵坐标(y),绘制线性关系曲线。
精密度和准确度:取空白血液样品,准确添加不同浓度的混合标准溶液,按各分析物的线性范围配制成低、中、高3个质量浓度水平的标准添加样品,分别为20、50、500 ng/mL(α-鹅膏毒肽、羧基二羟鬼笔毒肽),0.5、1、5 ng/mL(毒蝇碱、赛洛新),50、100、500 ng/mL(蝇蕈醇)。按1.3 节和1.4 节方法进行前处理和分析,每个质量浓度在1 d 内不同时间检测6 次,连续测定3 d,得到日内、日间精密度(以相对标准偏差表示)以及准确度。
回收率和基质效应:在空白血液样本中加入混合标准溶液,得到低、中、高3 个浓度的样品,按1.3 节和1.4 节方法进行前处理和分析得到添加血液中各分析物的峰面积为A。同时取空白血样,直接按1.3 节方法进行处理,然后向获得的提取剂中加入相应浓度的对照品,按1.4 节的方法进行分析得到各分析物的峰面积为B。提取回收率=(A/B)×100%,并计算回收率的相对标准偏差(relative standard deviation,RSD)。用流动相配制低、中、高混合标准溶液,直接按1.4 节方法进行分析得到各分析物的峰面积为C。基质效应=(B/C)×100%。
1.6 动物实验
C57BL/6N 雄性小鼠9 只,体质量(25±2)g,随机分为3 组,每组3 只。分别按照1/2 的LD50剂量灌胃给药α-鹅膏毒肽(LD50=0.6 mg/kg)[20]、毒蝇碱(本研究预实验得到LD50=10 mg/kg)和赛洛新(本研究预实验得到LD50=4 mg/kg),并于中毒后1 h 内采取血液和尿液样本,按照1.3 节方法进行样本前处理,运用所建方法进行分析。本实验严格按照河北医科大学动物伦理学委员会的相关规定执行操作。
2 结果与讨论
2.1 样本前处理方法的优化
蝇蕈醇、毒蝇碱和赛洛新是低分子极性化合物,而α-鹅膏毒肽和羧基二羟鬼笔毒肽是高分子环肽化合物,其种类和化学性质差异较大。已报道[16-17,20]的生物体液中蘑菇毒素的样本前处理方法多为固相萃取法。虽然固相萃取是一种众所周知的有效纯化复杂基质的技术,但大多数可用的固相萃取方法都需要复杂的处理条件、蒸发和富集步骤,同时该方法较难满足同时提取多种类型蘑菇毒素的需求。因此,本研究选择了溶剂提取和净化管净化基质进行样本前处理,该方法具有操作步骤简便、快速等特点。
由于赛洛新非常不稳定,在光和空气中会快速地分解[14],故本研究通过加入抗坏血酸来保证赛洛新在样本前处理过程中的稳定性[17]。然后根据5 种蘑菇毒素的物理溶解性质,对几种提取溶剂或由甲醇、乙腈和水组成的混合溶剂进行了测试。这些极性溶剂的选择考虑了分析物的极性和亲水性。选择了不同比例的水和有机溶剂的混合溶液作为提取溶剂,考察了甲醇-水溶液(V甲醇∶V水=3∶1)、甲醇-水溶液(V甲醇∶V水=2∶1)、乙腈-水溶液(V乙腈∶V水=3∶1)、乙腈-水溶液(V乙腈∶V水=2∶1)对5 种蘑菇毒素回收率的影响,结果表明,以乙腈-水溶液(V乙腈∶V水=3∶1)作为提取溶剂时回收率最高(图1),并且以此溶剂提取时蛋白沉淀效果最好。
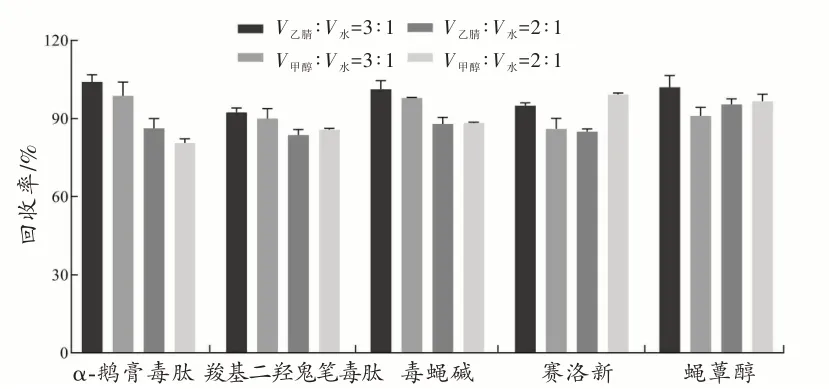
图1 不同提取溶剂对5 种蘑菇毒素回收率的影响Fig.1 Effects of different extraction solvents on the recovery of 5 mushroom toxins
溶剂提取法在充分提取各蘑菇毒素的同时,不可避免地会将内源性物质一并提取,可能产生一定的基质效应。本研究考察了Cleanert PAX 和Cleanert MAS-QuEcHERS 系列Cleanert®C18 净化 管2 种净 化管作为实验考察对象(表2),经Cleanert MAS-QuEcHERS系列Cleanert®C18 净化管和Cleanert PAX 净化管净化后的赛洛新基质效应均降低,然而这两种净化剂都无法消除内源性物质对蝇蕈醇信号的抑制作用。Cleanert PAX 对5 种目标化合物的回收率均较好,Cleanert MAS-QuEcHERS 系列Cleanert®C18 净化管降低了蝇蕈醇的回收率,可能是其在吸附基质的同时也吸附了一些目标化合物,因此对于5 种蘑菇毒素同时提取时,选用Cleanert PAX 较好。另外,直接稀释净化液进行进样,避免了溶剂蒸发再复溶的耗时步骤。
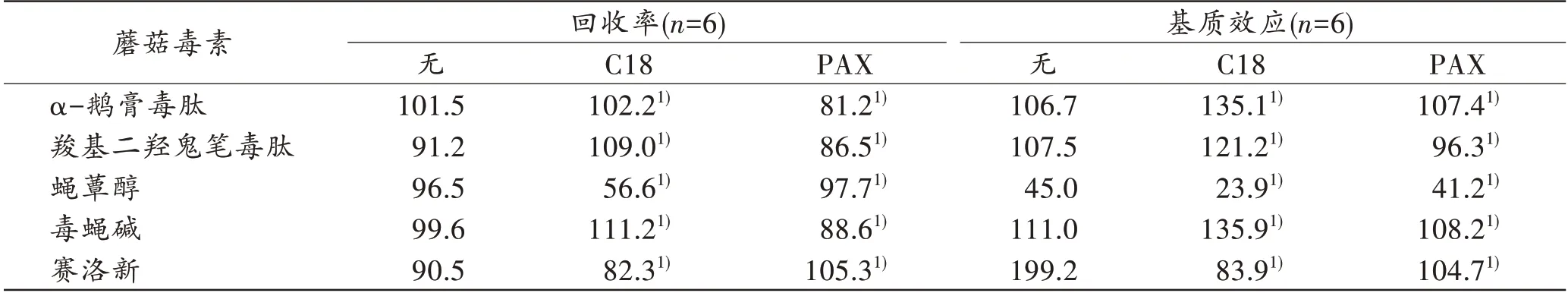
表2 不同净化剂对5 种蘑菇毒素回收率和基质效应的影响Tab.2 Effects of different purifiers on the recovery and matrix effect of 5 mushroom toxins(%)
2.2 UHPLC-HRMS 的优化
在液相色谱分离方面,对3 种色谱柱进行了考察,包括Hypersil GOLD PFP 色谱柱(100 mm×2.1 mm,1.9 mm;美国Thermo Fisher Scientific 公司)、Acquity HSS T3 色谱柱(100 mm×2.1 mm,1.8 mm;美国Waters公司)和ACQUITY Premier CSH C18色谱柱。在1.4 节的流动相梯度洗脱程序下,ACQUITY Premier CSH C18色谱柱对5 种蘑菇毒素的保留性和分离度均较高,并且流动相中无需加入离子对试剂,便可以提供尖锐的峰形和更强的MS 响应,有效地改善峰形拖尾的现象,并且提高MS 响应灵敏度。除了固定相外,流动相是色谱分析中获得良好分离效果的另一个重要参数,对分析物的电离和质谱仪的灵敏度也有影响。本研究以甲醇或乙腈为有机相,以水为极性相,对不同的流动相进行了实验研究。与乙腈和水组合相比,甲醇和水使分析物在液相色谱中分离效果更好,质谱中信号强度更高,因此选择甲醇作为有机相。甲醇与乙腈相比,还具有更低成本和更低毒性的优点。采用梯度洗脱的条件,分析时间只需15 min,可为临床诊断救治提供宝贵的时间。详见图2色谱图所示。
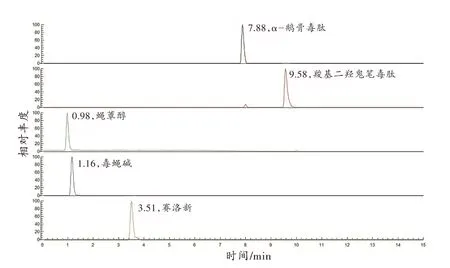
图2 5 种蘑菇毒素的一级全扫描提取离子色谱图Fig.2 Full-scan extraction ion chromatogram of 5 mushroom toxins
2.3 方法学验证
血液中α-鹅膏毒肽、羧基二羟鬼笔毒肽、蝇蕈醇、毒蝇碱和赛洛新在相应的线性范围内线性关系良好,决定系数(R2)均大于0.99,检出限为0.2~20 ng/mL,定量限为0.5~50 ng/mL(表3)。与已报道[4,15-16,19]的单一方法比较,发现本方法α-鹅膏毒肽、羧基二羟鬼笔毒肽略高,毒蝇碱和赛洛新的检出限和定量限与其他方法相当。
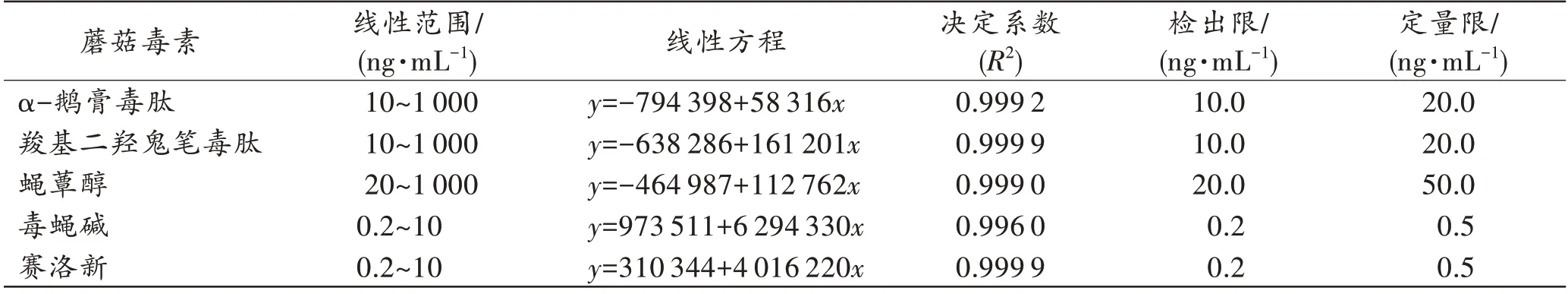
表3 5 种蘑菇毒素的线性范围、线性方程、检出限和定量限Tab.3 Linear ranges,linear equations,limits of detection and limits of quantitation of 5 mushroom toxins
本研究中各分析物的日内精密度为0.6%~9.0%,日间精密度为1.7%~6.3%,准确度为90.4%~101.3%,均满足精密度和准确度的要求。提取回收率为89.6%~101.4%,RSD 为1.1%~6.7%,表明乙腈-水溶液(V乙腈∶V水=3∶1)提取和Cleanert PAX 的前处理方法可达到较好的提取效果。α-鹅膏毒肽、羧基二羟鬼笔毒肽、毒蝇碱和赛洛新的基质效应为91.9%~129.8%,而蝇蕈醇的基质效应较强,为42.2%~47.7%,但从回收率和精密度的结果来看,蝇蕈醇虽然有一定的基质效应,但并不影响测定的准确性。详见表4。
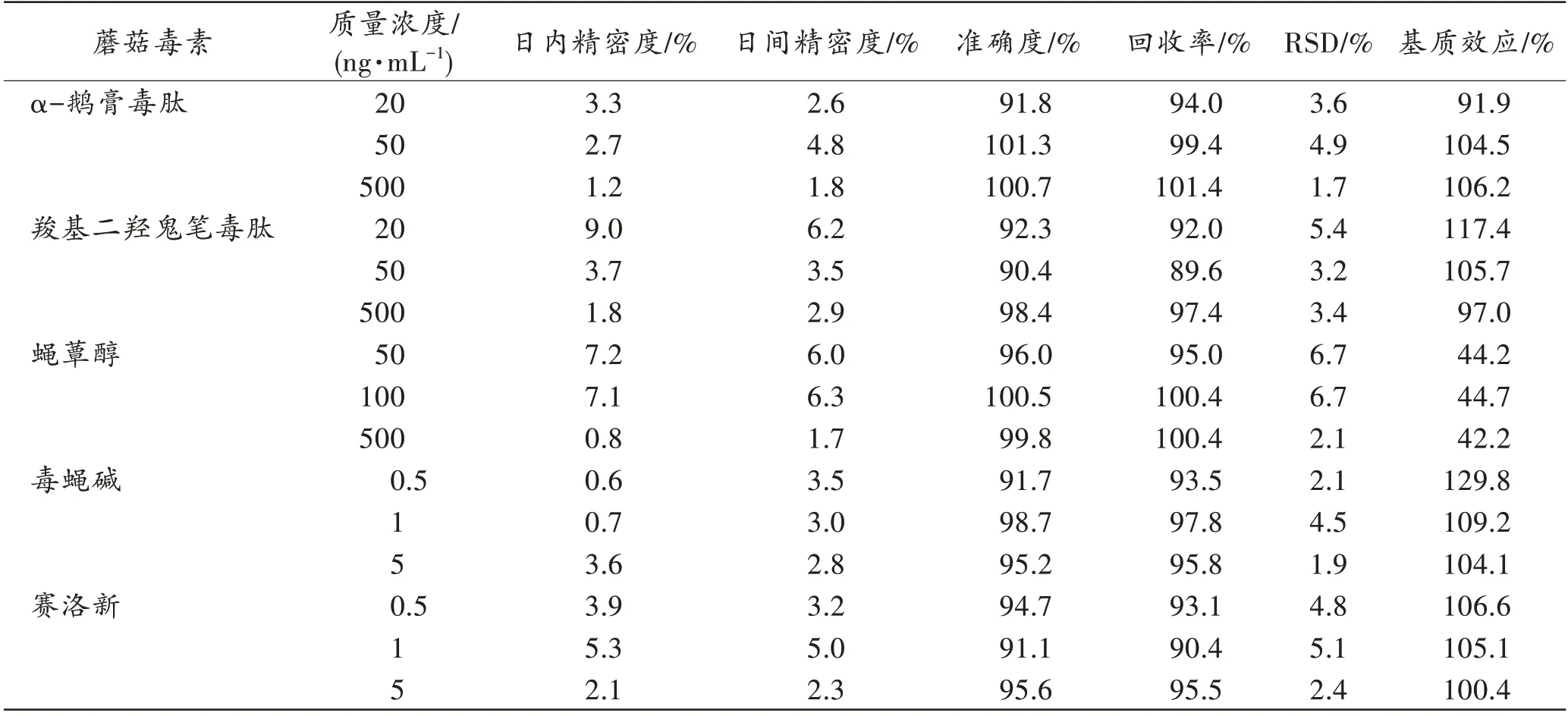
表4 5 种蘑菇毒素的精密度、准确度、回收率和基质效应Tab.4 Precision,accuracy,recovery and matrix effect of 5 mushroom toxins
2.4 动物实验
对α-鹅膏毒肽、毒蝇碱和赛洛新染毒动物的生物检材血液和尿液进行分析,定性及定量结果见表5。除α-鹅膏毒肽染毒小鼠血液中未检出α-鹅膏毒肽成分外,毒蝇碱和赛洛新染毒小鼠血液中均可检出相应成分。但是,在α-鹅膏毒肽、毒蝇碱和赛洛新染毒动物的尿液中均可检出相应的毒物成分。因此,在蘑菇毒素中毒的实际案例应用中,应注意留存尿液等生物检材。
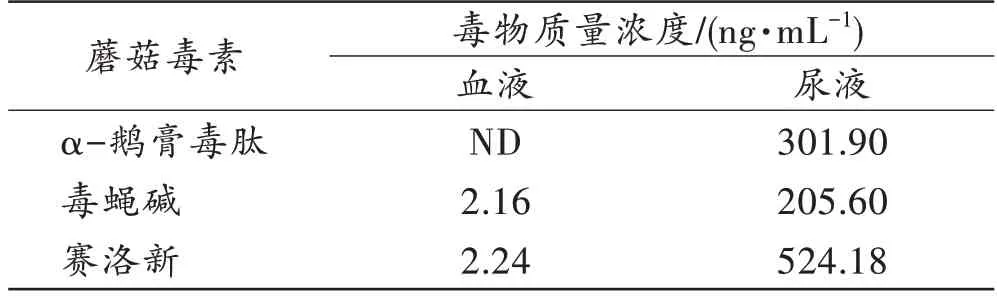
表5 α-鹅膏毒肽、毒蝇碱和赛洛新染毒小鼠生物检材中毒物的含量Tab.5 The content of α-amanitin,muscarine and psilocin in biological samples of mice
2.5 结论
本研究建立了一种简便、快速测定血液中5 种蘑菇毒素(α-鹅膏毒肽、羧基二羟鬼笔毒肽、蝇蕈醇、毒蝇碱和赛洛新)的方法。经简单的提取和纯化,采用UPLC-HRMS 联用技术进行了测定。经验证,结果可靠、重现性好、灵敏度高,可同时对血液中多种类型蘑菇毒素进行快速准确的定性筛查和定量分析,从而为蘑菇中毒事件的鉴定提供依据。

