基于NFAT信号通路的抗LAG3抗体8F-6生物活性检测
蒙柳仙 魏振华 熊雪阳 许立达 吴依昕 梁 蒙 喻长远
(北京化工大学 生命科学与技术学院,北京 100029)
引 言
传统放化疗由于在癌症治疗过程中副反应严重且效果有限,因此免疫治疗越来越受到重视,成为目前癌症治疗中最热门的领域。以抗CTLA-4和抗PD-1/PD-L1为代表的免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)因具有良好的临床效果而成为免疫治疗领域的研究热点。应用于临床时,这些单克隆抗体具有治疗窗口广、疗效显著、不良反应小等优势[1]。与此同时,以淋巴细胞活化基因3(LAG3)(又称CD223)、BTLA、TIM-3等为代表的其他免疫检查点也逐渐进入科学家的视野[2]。
作为免疫球蛋白超家族成员之一,LAG3是一种由470个氨基酸组成的跨膜蛋白,在特征上与CD4分子有一定的相似性[3]。研究发现,LAG3分子及CD4分子均可以与抗原肽-主要组织相容性复合体Ⅱ(major histocompatibility complex Ⅱ, MHC Ⅱ)分子结合,但是结合位点不同,而且MHC Ⅱ分子与LAG3分子的结合能力显著大于与CD4分子的结合能力[4]。LAG3在活化的T淋巴细胞、B淋巴细胞、DC细胞和NK细胞中分子的表达量会上调,而在未活化的免疫细胞中基本没有表达[5]。LAG3作为一种重要的免疫调节因子,是T细胞受体(T cell receptor,TCR)的共抑制受体之一。因其与MHC Ⅱ分子具有更强的亲和力,可抑制特异性T细胞增殖和细胞因子(IFN-γ、TNF-α、IL-2)分泌,使T细胞的抗肿瘤免疫应答处于沉默状态[6-7]。与 PD-1分子类似,LAG3分子在T细胞活化和增殖过程中均起负调控作用,有利于肿瘤实现免疫逃逸。通过封闭LAG3分子介导的信号通路,可以使T细胞恢复至正常状态,进而杀伤肿瘤细胞[8-9]。
目前针对LAG3分子的单克隆抗体有多达几十种,且处于不同的临床阶段[10]。生物活性测定对抗体药物的临床前研发至关重要,报告基因检测法由于具有操作简单、快捷精确、结果稳定等优点,近年来被广泛用于各种抗体药物(如PD-1/PD-L1、CLDN18.2、CTLA4和VISTA)的生物活性检测[11-12]。利用报告基因检测法测定抗LAG3抗体,使其与LAG3偶联从而阻断LAG3与MHC II的结合,以抗体剂量依赖的方式解除T细胞的抑制状态。活化T细胞核因子(NFAT)家族的第一个成员是在抗原刺激T淋巴细胞激活基因转录而导致IL-2等新的细胞因子合成时被发现的[13]。同时还发现,免疫细胞的激活可促使胞质钙离子水平的上升,从而导致体内NFAT的激活,促进随后对病原体感染的免疫反应,并且NFAT家族成员还可以调节多种癌症的发展和转移[2,14]。此外,当MHC II分子与TCR相互结合时,因为T细胞内钙水平升高,使得 NFAT去磷酸化,再转运到细胞核中,形成协同转录复合物,促使IL-2产生。
本课题组前期利用杂交瘤融合及抗体人源化改造技术,得到了一株全人源化的抗LAG3单克隆抗体8F-6;在Jurkat细胞上稳定转染NFAT控制的荧光素酶基因,得到Jurkat-NFAT-Luc2,然后分别稳定转染人LAG3和LAG3-CD3zeta,构建了Jurkat-NFAT-Luc2-LAG3和Jurkat-NFAT-Luc2-LAG3-CD3zeta细胞系。在本文中,由于Daudi细胞对Jurkat-NFAT-Luc2-LAG3-CD3zeta细胞有直接的激活作用,在二者的共混体系中加入抗体8F-6,测试了8F-6对Jurkat-NFAT-Luc2-LAG3-CD3zeta细胞激活的阻断作用;在APC细胞(Daudi、Raji细胞)和Jurkat-NFAT-Luc2-LAG3细胞的共混体系中加入人金黄色葡萄球菌肠毒素E(SEE)作为免疫刺激剂,以确保Jurkat-NFAT-Luc2-LAG3细胞的激活效果,然后加入抗体8F-6,检测了Jurkat-NFAT-Luc2-LAG3细胞激活效果的变化情况。
1 实验部分
1.1 实验材料与仪器
1.1.1实验材料
293T-LAG3、293T-cyno-LAG3、Jurkat-NFAT-Luc2、Jurkat-NFAT-Luc2-LAG3、Jurkat-NFAT-Luc2-LAG3-CD3zeta、CHO-K1-FCGR1A(CD64)、Daudi及Raji细胞,抗体8F-6、LAG3-His蛋白、LAG3-hFc蛋白、SEE及IgG1抗体,均由康源博创生物科技有限公司提供;荧光检测试剂,BPS公司;DMEM、RPMI-1640培养基,Hyclone公司;puromycin、胎牛血清(FBS),GBICO公司;PE anti-human IgG Fc抗体、抗人CD3抗体、抗人CD28抗体,BioLegend公司;hygromycin B,Invitrogen公司;酶联免疫吸附测定(ELISA)试剂盒,R&D公司;Human CD4+T cell isolation kit、96孔透明平底黑壁板、96孔化合物板、50 mL离心管、15 mL离心管、10 mL移液管,Corning公司;T75细胞培养瓶,Thermo公司。
1.1.2实验仪器
多功能酶标仪(Spectramax M3),北京富龙康泰公司;流式细胞仪(easyCyte),Guava公司;离心机(Centrifuge 5804/5804 R),Eppendorf公司;CO2培养箱(3100 Series)、生物安全柜(1300 Series A2),Thermo Scientific公司;倒置显微镜(CKX41SF),Olympus公司。
1.2 实验方法
1.2.1抗体8F-6与LAG3蛋白结合
在特定ELISA板中加入100 μL经过磷酸盐缓冲液(PBS)稀释的LAG3-His蛋白,其最终质量浓度为0.5 μg/mL,4 ℃孵育过夜。洗涤细胞板后,每孔加入300 μL封闭液,室温孵育1.5 h。再次洗涤后加入100 μL抗LAG3抗体8F-6,其起始质量浓度为20 μg/mL,以3.16倍稀释,设置10个质量浓度梯度,对照组为相同浓度的IgG1抗体,室温孵育2 h。洗涤后加入100 μL Streptavidin-HRP工作液,室温孵育20 min。再次洗涤后每孔加入100 μL Substrate Solution,室温孵育20 min,此过程避光。最后每孔加入50 μL终止液,轻敲细胞板以确保充分混匀。使用多功能酶标仪校准波长后于450 nm处测定吸光度A450。
1.2.2抗体8F-6与人活化T细胞结合
使用Human CD4+T cell isolation kit从外周血单个核细胞(PBMC)中分选出CD4+T细胞。加入10 μg/mL抗CD3抗体和1 μg/mL抗CD28抗体,在37 ℃、5% CO2条件下培养48 h后加入96孔板中(每孔5×105个细胞),加入1 μg/mL抗体8F-6,混合均匀,4 ℃孵育1 h后离心洗涤,重悬,再加入2 μL PE anti-human IgG Fc抗体混合均匀,4 ℃孵育1 h后离心洗涤,重悬,使用流式细胞仪检测荧光强度。不加抗体为空白组,PE anti-human IgG Fc抗体为对照组。
1.2.3抗体8F-6与过表达LAG3细胞株结合
为了更好地反映8F-6与细胞膜表面LAG3的结合能力,分别构建了可在293T细胞膜表面上稳定表达人的LAG3抗原以及猕猴的LAG3抗原的工程细胞株293T-LAG3及293T-cyno-LAG3,待细胞长至适宜密度时,使用DMEM+10% FBS+1 μg/mL puromycin收取细胞,通过流式细胞仪检测荧光强度。其中,所加入的抗体8F-6的起始质量浓度为20 μg/mL,以3.16倍稀释,设置10个质量浓度,对照组为相同浓度的IgG1抗体。使用GraphPad-Prism 7软件对检测结果进行曲线拟合,得到半最大效应浓度(EC50)。对于构建的LAG3分子过表达细胞株Jurkat-NFAT-Luc2-LAG3和Jurkat-NFAT-Luc2-LAG3-CD3zeta,前者在细胞膜表面过表达人的LAG3蛋白,后者在细胞膜表面过表达重组人LAG3和CD3zeta的融合蛋白,待细胞长至适宜密度时使用RPMI-1640 + 10% FBS+1 μg/mL puromycin + 300 μg/mL hygromycin B收取细胞,实验组加入1 μg/mL抗体8F-6,不加抗体为空白组,PE anti-human IgG Fc抗体为对照组,使用流式细胞仪检测荧光强度。
1.2.4报告基因细胞的激活作用
构建的Jurkat-NFAT-Luc2-LAG3和Jurkat-NFAT-Luc2-LAG3-CD3zeta细胞都是基于NFAT信号通路激活下引发荧光素酶基因表达的原理,因此不同反应体系检测的荧光值可反映Jurkat细胞的受激活程度。Daudi和Raji细胞表面表达有MHC Ⅱ分子,因此可用作激活体系中的配体细胞。计数后在96孔透明平底黑壁板中加入Jurkat-NFAT-Luc2-LAG3细胞悬液,每孔细胞数为20 000个,实验组分别加入10 μg/mL CD3抗体+1 μg/mL CD28抗体、10 μg/mL 8F-6、10 μg/mL IgG1抗体、Daudi细胞、Raji细胞,其中每孔Daudi细胞和Raji细胞的数量均为2×105个,设置复孔,同时空白孔只含有Jurkat-NFAT-Luc2-LAG3。混合均匀,孵育6 h后,加入100 μL荧光检测试剂,避光震荡后使用多功能酶标仪检测荧光值。Jurkat-NFAT-Luc2-LAG3-CD3zeta与Jurkat-NFAT-Luc2-LAG3的检测方法相同。使用GraphPad-Prism 7软件对检测结果进行分析,按照下式计算差异倍数(fold change)。
式中,Fc为差异倍数,Ie为实验孔的荧光值,Ib为空白孔的荧光值。
1.2.5抗体8F-6阻断LAG3与MHC II的结合
将0.5 μg/mL LAG3-hFc蛋白与Daudi细胞混合后,加入抗体8F-6,其起始质量浓度为20 μg/mL,以3.16倍稀释,设置10个质量浓度,混合均匀后共孵育1 h,进行流式细胞检测。对照组为相同浓度的IgG1抗体,二抗为PE anti-human IgG Fc抗体,空白组不含抗体。检测结果使用FlowJo软件处理,使用GraphPad-Prism 7软件进行曲线拟合,按照下式计算抑制率R。
将构建的Jurkat-NFAT-Luc2-LAG3-CD3zeta与Daudi细胞共混,加入96孔透明平底黑壁板中,两种细胞数量之比为1∶1,均为20 000个/孔。然后加入梯度稀释的抗体8F-6,其起始质量浓度为20 μg/mL,以3.16倍稀释,设置9个质量浓度。混合均匀后共孵育6 h,反应体系体积为200 μL,设置复孔,对照抗体为相同浓度的IgG1抗体。空白孔只含有Jurkat-NFAT-Luc2-LAG3-CD3zeta细胞,作为激活结果的参考背景值。孵育6 h后,加入100 μL荧光检测试剂,避光震荡后使用多功能酶标仪检测荧光值,使用GraphPad-Prism 7软件对检测结果进行曲线拟合。
1.2.6利用CHO-K1-FCGRIA实现抗体8F-6对Jurkat-NFAT-Luc2-LAG3-CD3zeta的激活
将CHO-K1-FCGRIA细胞悬液加入96孔透明平底黑壁板中,细胞数量为20 000个/孔,然后加入抗LAG3抗体8F-6预混30 min,抗体8F-6的起始质量浓度为3.16 μg/mL,以3.16倍稀释,设置9个质量浓度。混合均匀后共孵育6 h,反应体系体积为200 μL,设置复孔,对照抗体为相同浓度的IgG1抗体。空白孔只含有Jurkat-NFAT-Luc2-LAG3-CD3zeta和CHO-K1-FCGRIA细胞,作为激活结果的参考背景值。孵育6 h后,加入100 μL荧光检测试剂,避光震荡后使用多功能酶标仪检测荧光值。使用GraphPad-Prism 7软件对检测结果进行曲线拟合。
1.2.7SEE对Daudi和Raji细胞与报告基因细胞共混的激活
将Daudi及Raji细胞悬液分别加入96孔透明平底黑壁板中,细胞数量为10 000个/孔,然后加入梯度稀释的SEE悬液,SEE悬液的起始质量浓度为100 ng/mL,以5倍稀释,设置8个质量浓度。混合均匀后孵育过夜,反应体系体积为100 μL,设置复孔,对照组不含有Daudi及Raji细胞。第2天分别在各组中加入Jurkat-NFAT-Luc2细胞悬液,细胞数量为20 000个/孔,最终反应体系体积为200 μL,混合均匀后共孵育6 h。空白孔只含有Jurkat-NFAT-Luc2细胞和Daudi/Raji细胞,作为激活结果的参考背景值。孵育6 h后,加入100 μL荧光检测试剂,避光震荡后使用多功能酶标仪检测荧光值。Jurkat-NFAT-Luc2-LAG3的检测方法与Jurkat-NFAT-Luc2细胞相同。使用GraphPad-Prism 7软件对检测结果进行曲线拟合。
1.2.8抗体8F-6对SEE激活效果的影响
将Daudi及Raji细胞悬液分别加入96孔透明平底黑壁板中,细胞数目为10 000个/孔,然后加入梯度稀释的SEE悬液,SEE悬液的起始质量浓度为0.8 ng/mL,以5倍稀释,设置5个质量浓度,混合均匀后孵育过夜,反应体系体积为100 μL,设置复孔。第2天分别在各孔中加入Jurkat-NFAT-Luc2-LAG3细胞悬液,细胞数量为20 000个/孔,再加入10 μg/mL抗体8F-6,对照组为加入相同质量浓度的IgG1抗体。最终反应体系体积为200 μL,混合均匀后共孵育6 h。空白孔只含有Jurkat-NFAT-Luc2细胞和APC细胞,作为激活结果的参考背景值。孵育6 h后,加入100 μL荧光检测试剂,避光震荡后使用多功能酶标仪检测荧光值。使用GraphPad-Prism 7软件对检测结果进行分析。
2 结果与讨论
2.1 抗体8F-6的结合作用测试结果
图1(a)为抗体8F-6与LAG3分子的结合能力测试结果,随着抗体8F-6的质量浓度增加,A450逐渐增大,表明二者的亲和力良好,而对照组抗体IgG1与LAG3分子无结合作用。为了更好地反映抗体8F-6与人体细胞表面的LAG3分子的结合,测试了抗体8F-6与抗CD3/CD28抗体激活后的T细胞的结合作用,结果如图1(b)所示。结果显示激活后的T细胞与8F-6的结合有明显的高位峰移,表明T细胞表面的LAG3分子表达上调,并且与8F-6为阳性结合。为了在细胞水平上定量反映抗体浓度与LAG3分子亲和力的关系,分别利用构建的293T-LAG3及293T-cyno-LAG3细胞检测了它们与8F-6的结合情况,结果如图1(c)和1(d)所示。随着抗体8F-6的质量浓度增加,平均荧光强度逐渐增大,表明抗体8F-6在细胞水平上与人的LAG3分子及猕猴的LAG3分子均有结合能力,而阴性对照组抗体IgG1与它们无结合作用。
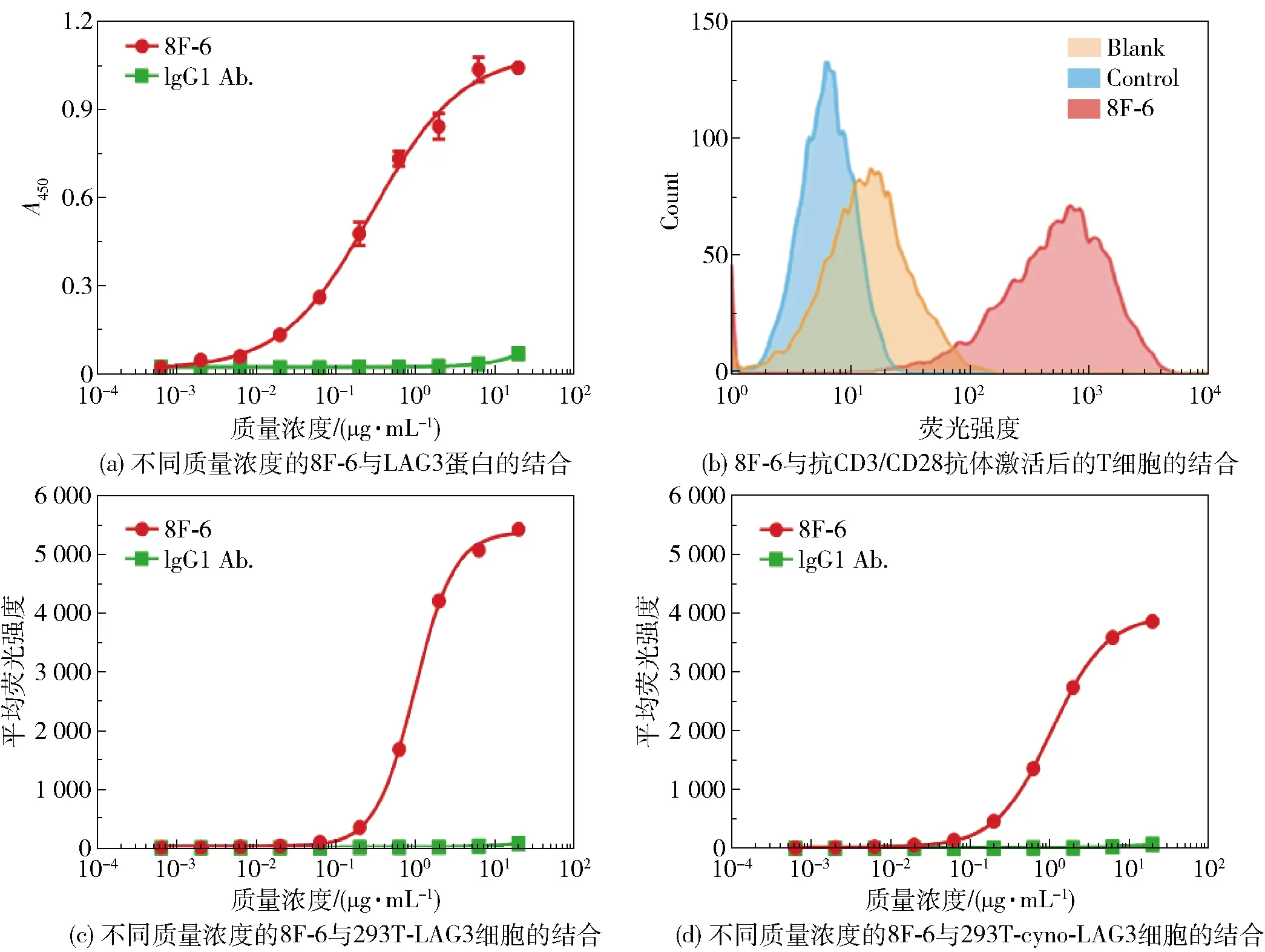
图1 抗体8F-6的结合作用
2.2 抗体8F-6的阻断作用测试结果
为了验证抗体8F-6对LAG3分子与APC细胞表面MHC II分子结合的影响,测定了不同质量浓度的抗体8F-6对Daudi细胞与LAG3蛋白结合的阻断作用,结果如图2(a)所示。随着抗体8F-6的质量浓度增加,抑制率逐渐增大,表明抗体8F-6对二者的结合有明显的阻断效果,且这种效果与抗体浓度呈正相关,而对照组抗体IgG1则不具有阻断效果。为了开发出良好的报告基因检测平台并应用于抗体检测,利用Jurkat-NFAT-Luc2-LAG3-CD3zeta细胞与抗体8F-6混合后进行流式细胞检测,结果如图2(b)所示。加入抗体8F-6的荧光检测结果出现高位峰移,表明 Jurkat-NFAT-Luc2-LAG3-CD3zeta细胞有LAG3融合蛋白表达并且与8F-6为阳性结合,CD3zeta具有转导TCR识别抗原所产生的活化信号的作用。图2(c)为不同激活体系对Jurkat-NFAT-Luc2-LAG3-CD3zeta细胞的激活作用,阳性对照使用CD3抗体和CD28抗体刺激后,其荧光值明显升高,Raji和Daudi细胞组也检测到荧光值升高,而8F-6和IgG1抗体组与空白细胞组无差异,结果表明除了CD3/CD28抗体对Jurkat-NFAT-Luc2-LAG3-CD3zeta细胞具有激活效果外,Raji和Daudi细胞通过与LAG3-CD3zeta融合蛋白的结合也具有激活Jurkat细胞的作用;而抗体8F-6虽然也可以与LAG3-CD3zeta融合蛋白结合,但不具有激活效果,表明APC细胞与Jurkat-NFAT-Luc2-LAG3-CD3zeta的结合方式和抗体8F-6有差异。鉴于Daudi细胞与Jurkat-NFAT-Luc2-LAG3-CD3zeta细胞的结合具有直接激活的效果,本文检测了抗体8F-6在此体系中的阻断作用,结果如图2(d)所示。随着8F-6的质量浓度增加,荧光值变化的差异倍数明显下降,表明8F-6可以阻断Daudi细胞对Jurkat-NFAT-Luc2-LAG3-CD3zeta细胞的激活,并且这种阻断效果有明显的浓度依赖性,而对照组抗体IgG1则不能阻断这种激活作用,这说明该体系可用于LAG3抗体的阻断检测平台。
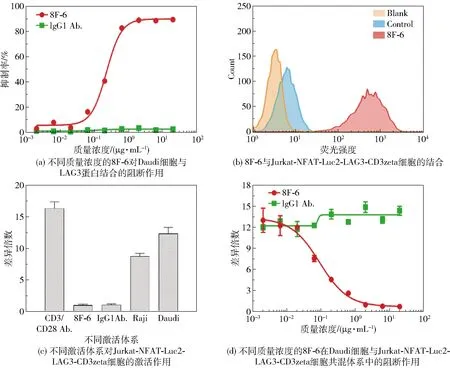
图2 抗体8F-6的阻断作用
2.3 利用报告基因细胞对抗体8F-6生物活性的测定结果
在图2(c)实验结果的基础上构建了CHO-K1-FCGRIA细胞,该细胞可特异性结合抗体8F-6的Fc段。图3(a)为不同质量浓度的抗体8F-6在CHO-K1-FCGRIA细胞与Jurkat-NFAT-Luc2-LAG3-CD3zeta细胞体系中的激活作用。当通过CHO-K1-FCGRIA细胞与抗体Fc段的结合将8F-6聚集起来后,再与Jurkat-NFAT-Luc2-LAG3-CD3zeta细胞表面的LAG3-CD3zeta融合蛋白结合,就可以使Jurkat细胞得到激活,且激活效果与抗体浓度呈正相关。为了更好地模拟体内LAG3分子的结合环境,将Jurkat-NFAT-Luc2-LAG3细胞与抗体8F-6混合后进行流式细胞检测,荧光检测结果显示高位峰移明显(图3(b)),表明Jurkat-NFAT-Luc2-LAG3表面有LAG3分子的表达并且与8F-6为阳性结合。图3(c)为不同激活体系对Jurkat-NFAT-Luc2-LAG3细胞的激活作用。由于细胞表面没有CD3zeta蛋白,所以8F-6、Raji和Daudi细胞都不具有直接激活作用。基于这种情况,利用不同质量浓度的SEE先分别与Raji和Daudi细胞共混过夜,然后再分别与Jurkat-NFAT-Luc2、Jurkat-NFAT-Luc2-LAG3共混孵育后进行检测,结果如图3(d)和3(e)所示。在SEE与Raji/Daudi细胞同时存在下,Jurkat-NFAT-Luc2、Jurkat-NFAT-Luc2-LAG3均被明显激活,并且这种激活作用具有SEE浓度依赖性;在SEE质量浓度相同的情况下,Daudi细胞和Raji细胞对Jurkat-NFAT-Luc2的激活效果大于Jurkat-NFAT-Luc2-LAG3,推测这种差异是由Jurkat-NFAT-Luc2-LAG3表面有LAG3分子存在造成的。因为存在这种激活差异并且考虑到LAG3分子的影响,在差异最大的SEE浓度区间内,将不同质量浓度的SEE分别与Daudi细胞和Raji细胞共混过夜后,再与Jurkat-NFAT-Luc2-LAG3共混并加入10 μg/mL 8F-6抗体进行检测,结果如图3(f)和3(g)所示。结果表明,在抗体8F-6的作用下,整体上Jurkat-NFAT-Luc2-LAG3被激活的效果相对于抗体IgG1有不同程度的提升,这也说明图3(d)和3(e)反映的激活差异确实是因为LAG3分子的存在造成的,而这种检测体系更好地模拟了相关作用机制,可用于LAG3抗体生物活性的体外检测。
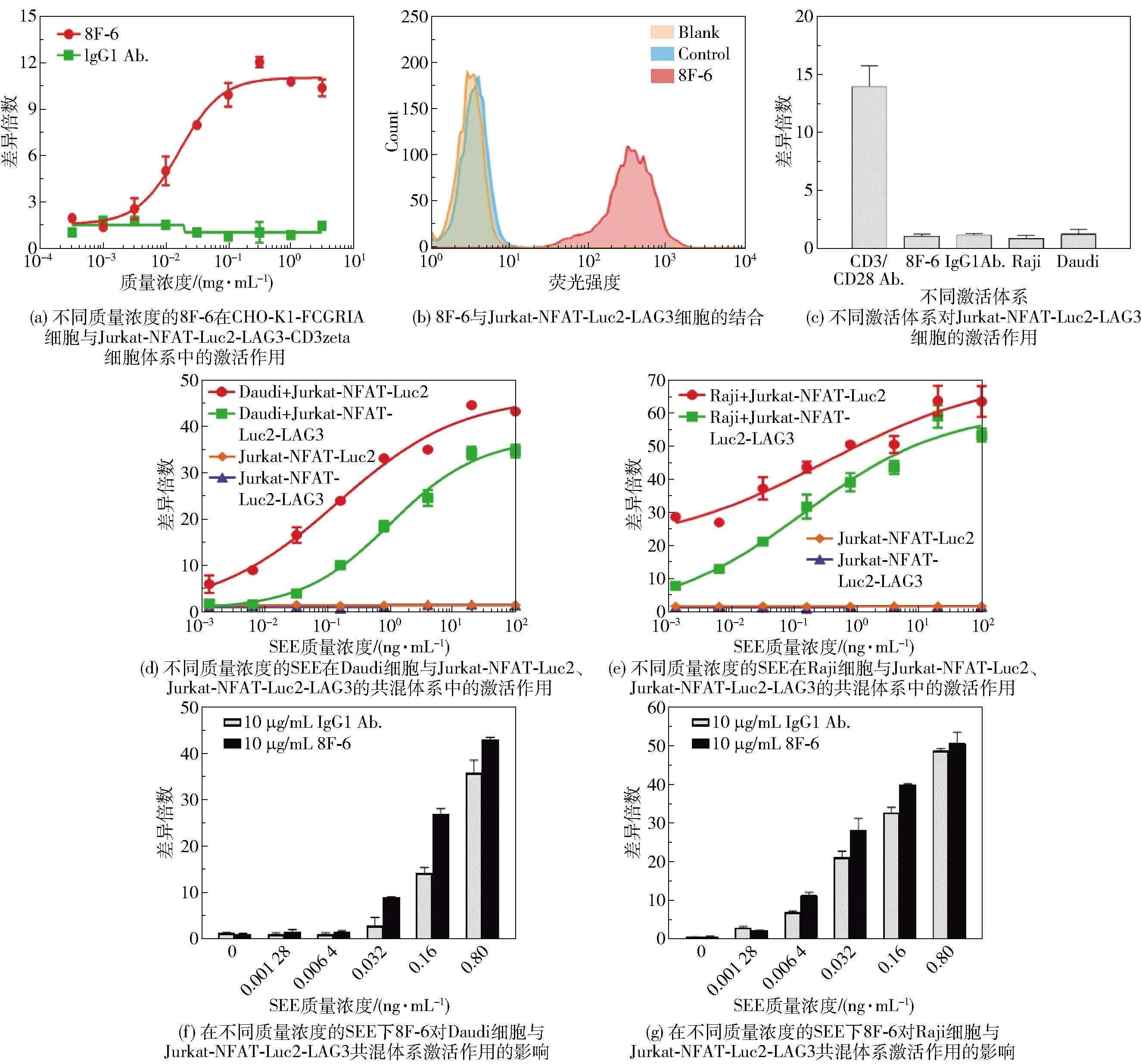
图3 报告基因细胞检测抗体8F-6活性的结果
通过经典杂交瘤技术获得的单克隆抗体在许多应用领域中都是非常有价值的工具,但其在临床中的应用因其异种来源而受到影响。而在蛋白水平及细胞水平上,人源化的抗LAG3抗体8F-6与LAG3分子均有良好的亲和力表现,同时可阻断LAG3分子与MHC II分子结合。基于抗体产生的不同免疫调节结构可能在识别治疗方面发挥重要的作用,LAG3肯定是最吸引人的新兴靶点之一[15]。
此外,SEE可同时结合MHC II分子和TCR的特定V β区域,缩短二者的空间距离,实现TCR-CD3复合体激活,诱导NFAT相关信号传导[16]。LAG3-MHC II复合物与TCR-CD3复合物结合,导致NFAT驱动的荧光素酶表达被抑制。抗LAG3抗体8F-6阻断了LAG3和MHC II分子之间的相互作用,从而使荧光素酶的表达得到释放。正是通过对荧光素酶的测定,从而体现了抗体对反应体系的影响。尽管LAG3的具体信号转导途径仍未清楚,但是在T细胞活化过程中的影响已被实验证实[17]。为了将NFAT报告细胞株应用于生物活性检测,我们在前期优化了多种试验参数,包括抗体的浓度、稀释倍差、体系内不同细胞的比例、SEE工作浓度和孵育时间等。检测结果发现在不同的体系中,检测响应度足够准确且稳定。LAG3在活化的人CD4+T和CD8+T细胞[18]、浆细胞样树突状细胞和NK细胞[7]上表达,MHC II分子、纤维蛋白原相关蛋白1(FGL1)、半乳糖凝集素-3、LSECtin和α-synuclein与LAG3分子有显著关联。目前临床实验中所有单克隆抗体的设计均基于阻断MHC II分子和LAG3之间的相互作用,这表明已建立的报告基因检测体系与当前的LAG3单抗在生物学上具有一定的相关性。
3 结论
本文通过对筛选得到的抗LAG3抗体8F-6进行亲和力及阻断效果检测,得到一株效果良好的抗LAG3抗体8F-6。利用基于NFAT信号通路构建的Jurkat-NFAT-Luc2-LAG3和Jurkat-NFAT-Luc2-LAG3-CD3zeta细胞,建立了一种抗LAG3单抗生物活性的测定方法。结果表明得到的抗体8F-6具有良好的生物活性,可充分阻断MHC II分子与LAG3分子的结合,证实利用以NFAT报告基因为基础的抗体检测平台具有较大的应用价值,可以为单克隆抗体的研究和开发提供新的思路。

