不同抗Ro52抗体亚型与SLE/SS/ IIM患者临床表现的相关性研究①
赵国旺 齐家龙 付 萍
(昆明医科大学第二附属医院风湿免疫科,昆明 650101)
抗Ro52抗体是干燥综合征(Sjögren's syndrome,SS)的特异性自身抗体,发生率约为66.7%,其与口眼干燥症及淋巴瘤呈正性相关;然而抗Ro52抗体在其他自身免疫性疾病中也常有表达,如:约有30%系统性红斑狼疮(systemic lupus erythematosus,SLE)患者表达抗Ro52抗体,这一抗体与狼疮患者的皮肤光敏密切相关[1];约有20%特发性炎症性肌病(idiopathic inflammatory myopathies,IIM)患者表达抗Ro52抗体,并且约有14%的免疫性肌炎中可以单独检测到抗Ro52抗体[2-3],抗Jo-1抗体阳性的肌炎患者中抗Ro52 抗体同时出现的概率约为70%。与单独的抗Jo-1抗体阳性的患者相比,同时表达抗Ro52抗体和抗Jo-1 抗体的患者的肌炎和关节症状更重,预后不良的肺间质纤维化和肿瘤的发生率更高[4]。而且IgM 型抗磷脂酰抗体可以降低SLE 活动度及减少器官损害,IgM 型抗ds-DNA 抗体可以降低SLE 患者肾损害的发病率,同时对狼疮鼠也具有治疗作用[5]。另外,以细胞凋亡相关抗原为靶抗原的IgM 型自身抗体对SLE 患者也具有保护作用,其与疾病的活动性、器官损害及心血管事件发生率呈负相关[6]。IgA、IgE 和大多数IgG 型自身抗体参与疾病的发病机制,其中IgA和IgE型自身抗体可能参与了狼疮性肾炎的发病及进展[7-8];研究表明母亲抗Ro52 抗体的IgG型与新生儿狼疮的房室传导阻滞密切相关[9]。所以本研究旨在研究不同抗Ro52 抗体亚型与不同临床表现之间的相关性。
1 资料与方法
1.1 资料
1.1.1 样本收集 收集2015年1月至2017年10月于昆明医科大学第二附属医院风湿免疫科明确诊断为SLE/SS/IIM 且抗Ro52 抗体阳性的住院患者1 ml血清标本和病例各50/30/30 份作为实验组;及明确诊断为SLE/IIM 且抗Ro52 抗体阴性的住院患者病例分别50/30 份,作为对照组。所有入组患者分别符合2012 年国际狼疮研究临床协作组制定的SLE 分类标准、2016 年美国风湿病学会/欧洲抗风湿病联盟制定的pSS 分类标准、2017 年欧洲抗风湿病联盟/美国风湿病学会关于成人IIM的分类标准。
1.1.2 主要材料 pThioHISA 由本实验室构建,大肠杆菌BL21、ER2566 由本实验室保存,TRIM21 基因(Cat.No:SM0331)由上海生工生物公司优化并合成。Anti-TRIM21 抗体、山羊Anti-Human IgG/A/M H&L(HRP)购自Abcam 公司,KOD DNA 聚合酶购自ToYoBo 公司;T4 DNA 连接酶、限制性内切酶为TaKaRa公司的产品,质粒小提试剂盒云南杰美科技有限公司。
1.2 方法
1.2.1 重组pThioHISA-TRIM21 质粒的构建TRIM21 全基因由生工生物工程(上海)股份有限公司优化并合成,得到含有目的基因的重组质粒pUC57-TRIM21。以质粒pUC57-TRIM21 为模板,设计分别带有限制性内切酶EcoRⅠ和SacⅠ位点的上下游引物(上游:5'-TTTAACGGCACACTTGAC-3';下游:5'-CTAGAGATGGAGAGGAGA-3')。通过分子克隆方法将目的基因插入表达载体pThioHISA 中,构建pThioHISA-TRIM21质粒。
1.2.2 重组TRIM21 的表达与纯化 取-20℃保存菌液10 μl 于5 ml LB 培养基内活化,37℃恒温振荡培养8~12 h。将活化的菌液加入无菌的LB 培养基内,并加入氨苄青霉素;将培养基置于37℃大摇床内,180 r/min 振荡培养6~8 h,去除少量菌液测定OD600在0.6 左右时,降低温度培养。摇瓶内菌液的温度降至诱导温度时,按照1∶1 000 比例加入诱导剂IPTG诱导8~10 h。回收菌体,8 000 g离心15 min,去除菌液上清。超声裂解破碎菌体重悬液,分别取适量上清与沉淀进行SDS-PAGE分析及Western blot验证。将可溶性蛋白通过不同梯度浓度尿素进行纯化和复性。
1.2.3 Western blot 验证 将重组TRIM21 抗原做样,进行SDS-PAGE 胶分析,待样品快跑出胶时将胶取出,浸泡在1×的电转液里面。打开电转仪器去离子水清洗干净,铺上一层大小与胶相当,使用电转液浸润的滤纸,在上面铺上一层硝酸纤维素膜,将胶平铺在膜上,最后盖上一层滤纸,保证每层膜之间没有气泡。连接电源,按照每块胶电流为35 mA设定参数,时间为1 h。转膜完成后,将硝酸纤维素膜取出浸泡在脱脂奶封闭液中,室温封闭2 h。封闭完成后使用TNT(即在TN 缓冲液中加入Tween-20至0.05%)清洗1 遍,按照1∶3 000 稀释中和 抗TRIM21单抗作为一抗,室温孵育45 min。一抗孵育完成后,使用TNT 清洗5 遍,每遍3 min。加入HRP标记的山羊抗小鼠抗体作为二抗(1∶5 000)室温孵育1 h。酶标二抗体孵育完成后,使用TNT清洗5遍,每遍3 min。清洗完成后进行化学发光显影。
1.2.4 ELISA 实验 采用重组TRIM21 作为抗原,使用1*CB作为包被缓冲液,包被浓度为100 ng/孔,体积为100 μl/孔,37℃培养箱包被2 h 后置于4℃冷库过夜。采用4%的明胶作为封闭液,200 μl/孔,37℃封闭2 h。使用20%NBS 为样品稀释液,稀释100 倍。将稀释好的血清100 μl/孔转移至包被有抗原的KE 板内,用封板膜封住,防止液体挥发及污染,并置于37℃恒温箱内孵育45 min。揭掉封板膜后使用PBST 清洗5 遍,甩干/拍干板内残留液体。加入100 μl/孔酶标二抗GAM-HRP(1∶5 000),盖上封板膜37℃孵育1 h。揭掉封板膜后使用PBST清洗5 遍,甩干/拍干板内残留液体。加入显色液(A∶B=1∶1)100 μl/孔,显色15 min,加入终止液50 μl/孔,反应5 min后,酶标仪于450 nm处读取各孔OD值。
1.3 统计学分析 数据采用GraphPad Prism7 统计软件进行分析。正态分布均采用表示。两组之间比较采用t检验;多组之间比较采用方差分析。计数资料采用卡方检验。P<0.05 表示差异具有统计学意义。
2 结果
2.1 TRIM21(Ro52)表达和纯化
2.1.1 TRIM21表达质粒鉴定TRIM21,总共1 440 bp,大约50 kD,当连接在pHisA 载体上时,总共大约66 kD。pThioHISA-TRIM21 质粒经EcoR Ⅰ和Sac Ⅰ双酶切后可见大小约1 440 bp 的目的条带,与理论的条带位置大小相同。经PCR 鉴定及合成的TRIM21基因(由公司合成Puc57-TRIM21)作为对照,显示目的基因片段已经正确插入表达载体中,可进行目的蛋白的表达纯化工作(图1)。
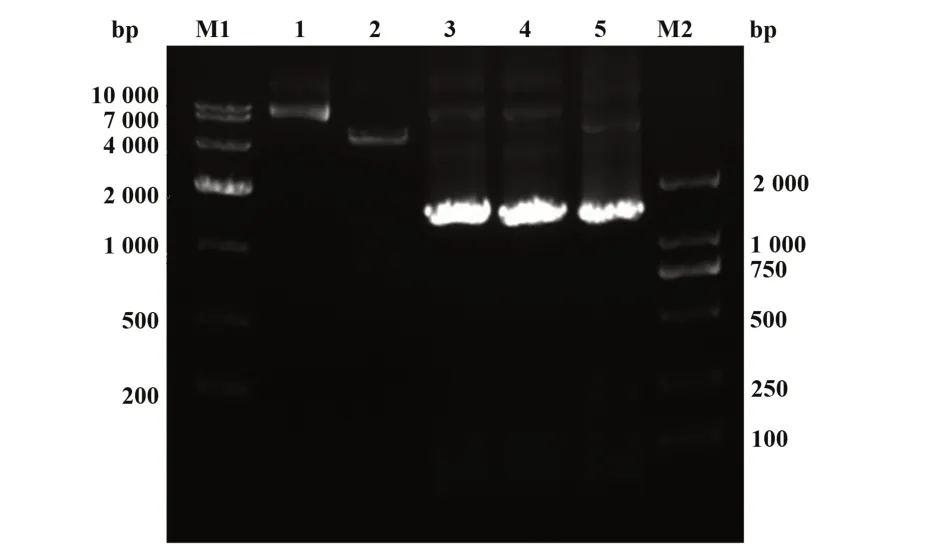
图1 重组pThioHISA-TRIM21质粒的构建和鉴定Fig.1 Construction and identification of recombinant pThioHISA-TRIM21 plasmid
2.1.2 TRIM21 表达与鉴定 选取鉴定正确的TRIM21 表达质粒进行转化ER2566 菌株及BL21 菌株,并挑选阳性克隆进行诱导表达,表达结果如图2所示。所挑选的克隆在66 kD 大小位置,相较于BL21及ER2566菌体蛋白均有明显的目的蛋白的表达,与理论分子量相当。
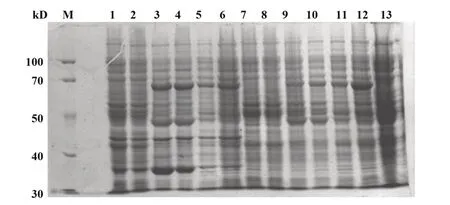
图2 TRIM21表达与鉴定Fig.2 Expression and identification of TRIM21
2.1.3 TRIM21 蛋白纯化与鉴定 对蛋白大量表达时发现,在30℃及18℃两个温度下诱导表达,蛋白均是以包涵体形式存在。纯化采用不同浓度的尿素吹溶后进行梯度透析复性,即可去除大量菌体自身的蛋白。本研究采用Western blot进行验证,结果如图3、4所示。
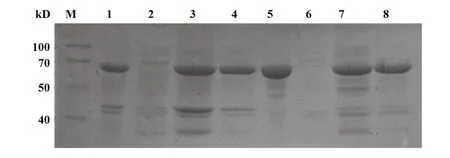
图3 蛋白纯化Fig.3 Purification of protein
2.1.4 TRIM21 蛋白复性及鉴定 对不同浓度尿素吹溶初步纯化并鉴定好的蛋白做梯度透析复性,并对其进行Western blot 验证,结果如图5 所示。目的条带显色明显且具有明显的特异性,为接下来的间接ELISA 实验做好了必需的特异性TRIM21抗原。

图4 蛋白纯化与鉴定Fig.4 Purification and identification of protein

图5 蛋白复性与鉴定Fig.5 Renaturation and identification of protein
2.2 抗Ro52抗体亚型的ELISA检测
2.2.1 110份血清样本中(包括SLE 50份、SS 30份、IIM 30 份),抗Ro52 抗体亚型IgG 的水平明显高于IgM(P<0.000 1)和IgA(P<0.000 1)的水平;且IgM的水平也明显高于IgA的水平(P<0.000 1)。见表1。
2.2.2 ①在50 份SLE 血清中,抗Ro52 抗体亚型IgG 水平高于IgM(P<0.000 1)和IgA(P<0.000 1);而IgM 与IgA 之间差异无统计学意义(P=0.140 0)。②在30 份SS 血清中,抗Ro52 抗体亚型IgG 水平高于IgM(P<0.000 1)和IgA(P<0.000 1);而IgM与IgA之间差异无统计学意义(P=0.551 3)。③在30 份IIM 血清中,抗Ro52 抗体亚型IgA 水平低于IgG(P=0.000 2)和IgM(P<0.000 1);而IgG 与IgM 之间差异无统计学意义(P=0.061 0)。见表1。
表1 ELISA测定中各组分IgG/ IgM/ IgA的OD值()Tab.1 OD value of IgG/ IgM/ IgA of each component was determined by ELISA()
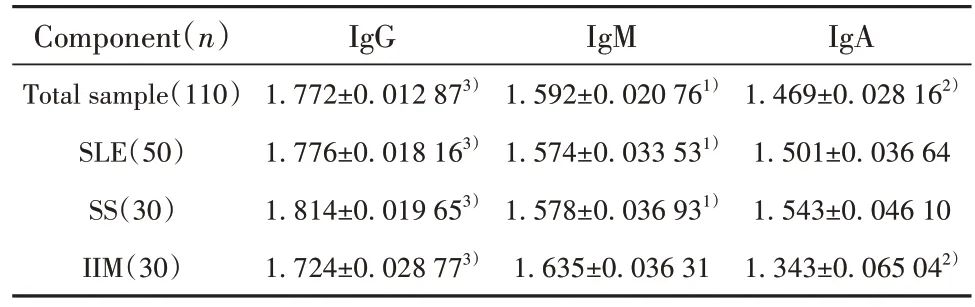
表1 ELISA测定中各组分IgG/ IgM/ IgA的OD值()Tab.1 OD value of IgG/ IgM/ IgA of each component was determined by ELISA()
2.3 病例统计结果
2.3.1 ①在50 份被检测的抗Ro52 抗体阳性的SLE患者中抗Ro52抗体阳性患者的狼疮活动度评分(systemic lupus erythematosus activity indexes,SLEDAI)在IgG型与非IgG型(即IgM和IgA)中无明显差异(采用t检验,P=0.337 6)。狼疮性肾炎(lupus nepphritis,LN)(P=0.560 2)、血小板(platelet,PLT)降低(P=0.252 0)、皮疹的发生率(P=0.568 3)在IgG型与非IgG型之间差异无统计学意义;而IgG型患者关节炎的发生率低于非IgG 型(P=0.045 1)(采用χ2检验)。②50 份抗Ro52 抗体阳性与50 份抗Ro52 抗体阴性的SLE 患者中SLEDAI 评分差异无统计学意义(采用t检验,P=0.219 7)。LN(P=0.836 9)、PLT降低(P=0.689 3)、皮疹的发生率(P>0.999 9)无明显差异,而抗Ro52抗体阳性关节炎的发生率高于阴性患者(P=0.001 8)(采用χ2检验)。见表2。
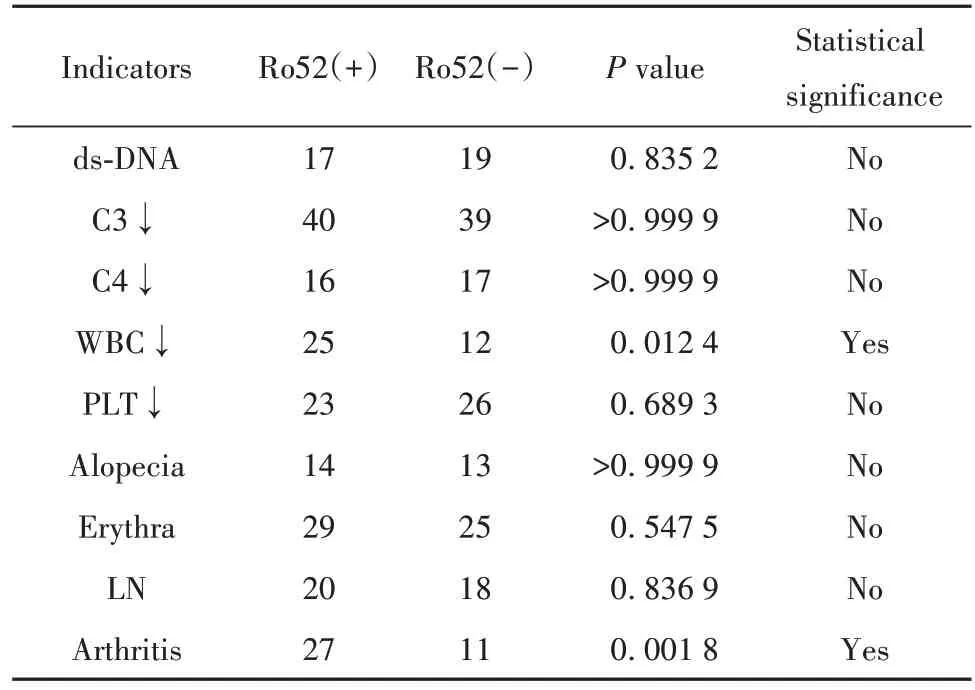
表2 anti-Ro52(+)/(-)SLE(各50份)相关指标的差异Tab.2 Differences in related indicators of anti-RO52(+)/(-)SLE(50 copies each)
2.3.2 在30 份被检测的抗Ro52 抗体阳性的SS 患者中干燥综合征疾病活动度评分(EULAR primary Sjögren's syndrome disease activity indexes,ESSDAI)在IgG 型与非IgG 型抗Ro52抗体阳性患者之间差异无统计学意义(采用t检验,P=0.144 7)。IgG 升高(P=0.418 9)、肺间质病变(interstitial lung disease,ILD)(P=0.670 7)的发生率在IgG型与非IgG型患者之间无明显差异(采用χ2检验)。
2.3.3 ①在30 份被检测的抗Ro52 抗体阳性的IIM患者中肌炎活动度(myositis activity indexes,MDI)(P=0.170 3)、肌炎皮损严重指数(cutaneous dermatomyositis disease area and severity index,CDASI)(活动性)(P=0.667 8)、CDASI(损伤性)(P=0.446 4)在IgG 型与非IgG 型抗Ro52 抗体患者中无明显差异(采用t检验);而IgG 型患者ILD 的发生率较高(采用χ2检验,P=0.026 1)。②在30 份抗Ro52 抗体阳性与30 份抗Ro52 抗体阴性IIM 患者中抗Ro52 抗体阳性患者MDI 高于阴性患者(P=0.007 7),CDASI(活动性)(P=0.055 1)、CDASI(损伤性)(P=0.540 8)在二者之间差异无统计学意义(采用t检验);而抗Ro52 抗体阳性患者ILD 的发生率高于阴性患者(采用χ2检验,P=0.022 1)。
3 讨论
本研究通过纳入110 例抗Ro52 抗体阳性患者血清样本(包括SLE 50 份、SS 30 份、IIM 30 份)及190 份病历资料(包括SLE Ro52+/-各50 份、SS Ro52+30 份、IIM Ro52+/-各30 份)。旨在研究不同临床表现与抗Ro52 抗体的表达及该抗体亚型之间的相关性。在110 份总样本中,抗Ro52 抗体亚型IgG的水平明显高于IgM和IgA的水平(P<0.000 1);而且在50 份SLE 样本中,亚型IgG 水平高于IgM(P<0.000 1)、IgA(P<0.000 1);30 份SS 中,亚型IgG 水平高于IgM(P<0.000 1)和IgA(P<0.000 1);30 份IIM 中,亚型IgA 水平低于IgG(P=0.000 2)和IgM(P<0.000 1);而IgG 与IgM 之间差异无统计学意义(P=0.061 0)。结果表明不管在总样本中还是不同病种中,抗Ro52 抗体亚型都是以IgG 为主。研究表明母亲抗Ro52 抗体的IgG 型与新生儿狼疮的房室传导阻滞密切相关[9],该抗体IgG 型主要抗Ro52 蛋白的氨基酸序列200~239,而此序列正位于Ro52 蛋白卷曲结构域中[10],也许表明该结构域是Ro52蛋白的主要抗原表位。然而目前研究仅表明此结构域与Ro52蛋白细胞质定位密切相关,所以还需进一步针对该蛋白不同结构域的功能进行研究。
本研究中还有一有趣发现,即在SLE 患者中抗Ro52 抗体阳性关节炎的发生率高于阴性患者(P=0.001 8)(采用χ2检验),且IgG型患者关节炎的发生率低于非IgG 型(P=0.045 1)(采用χ2检验);有研究表明IIM 患者中,关节炎的发生率与抗Ro52 抗体正相关[11]。在IIM 患者中抗Ro52抗体阳性患者ILD的发生率较高(采用χ2检验,P=0.022 1),这与SRIVASTAVA 等[11]研究结果一致。且本研究还发现IgG型患者ILD 的发生率高(采用χ2检验,P=0.026 1)。而在SS 中,ILD 的发生率与抗Ro52 抗体的亚型无关,且CLANCY 等[12]和MIRANDA 等[13]研究表明:SS患者中,ILD 与抗Ro52 抗体不相关;再者,本研究中SS 患者中的抗Ro52 抗体亚型主要是以IgG 型为主。另外,本研究中抗Ro52抗体阳性SLE 患者的白细胞减少发生率较阴性者高(与MENOR[14]和BROUWER等[15]研究结果一致);抗Ro52 抗体阳性IIM 患者的MDI评分较阴性者高;但都与该抗体亚型没有关联。所以这些结果似乎表明抗Ro52 抗体在不同疾病中具有不同的致病性,即使同一亚型(如IgG 型)在不同的疾病内环境下也能导致不同临床表现;如前所述该抗体IgG 型靶抗原表位主要是位于Ro52 蛋白卷曲结构域中,所以不同疾病自身炎症环境和基因背景可能是导致不同临床表现的关键因素。但是至今为止,对即使在同一疾病中抗Ro52抗体的致病机制都知之甚少。其是否是通过作用于靶蛋白Ro52 而介导致病?目前为止只有体外研究显示抗Ro52 抗体能够结合Ro52 的RING 结构域从而抑制Ro52介导的泛素化而积极地参与自身免疫疾病[16];还是直接致病?有研究表明抗Ro52 抗体能直接结合心肌细胞,导致胎儿房室结传导时间的延长,导致患儿先天性心脏传导阻滞[17];还是通过IC 形式参与致病?IC 能被浆细胞样树突状细胞吞噬转位到核内体并刺激TLR7 或TLR9 活化,导致IFN-α 的大量释放;还是与其相关多重机制共同介导?如本实验研究结果表明,相关临床表现不仅与抗Ro52抗体相关,还与该抗体的亚型有关。所以也许抗Ro52抗体不同亚型所针对不同Ro52 蛋白结构域在不同疾病中所导致的致病机制也不尽相同。但由于本实验样本量有限未能统计出更多的临床表现与抗Ro52抗体亚型的相关性,故在后续研究中加大样本量至关重要,这样才能继续深入研究该抗体的亚型与更多的临床表现及实验室指标之间的相关性,使其亚型成为临床预测的重要指标,从而为该抗体致病性的基础研究做好铺垫。

