不同顶空进样技术结合多同位素内标法对香气物质定量分析的选择性差异
马丽鑫,郑 旭,黄旭辉,孙浩媛,徐献兵,董秀萍,秦 磊
(大连工业大学食品学院,国家海洋食品工程技术研究中心,辽宁 大连 116034)
香气是评价食品品质的重要指标之一[1]。食品香气的形成建立在复杂的物质基础之上[2],如何获取准确的食品香气信息一直是研究热点。目前,食品香气物质的定量萃取方式主要分为溶剂萃取和顶空萃取。其中,溶剂萃取方式主要有液液微萃[3]、同时蒸馏萃取[4]、溶剂辅助蒸馏萃取[5]等。虽然溶剂萃取能够获得更多的挥发性化合物,但是易产生溶剂效应引入新的杂质。同时,溶剂萃取通常需要对食品结构破坏,而这些物理化学破坏同样会导致香气分析与食品原有状态的香气发生偏差[6]。顶空萃取方式虽然局限于萃取头或者收集方式的能力导致获得的香气物质信息相对液体萃取方式较少,但其萃取过程中无需对食品的结构进行破坏,更好地体现了食品正常状态下散发出的香气信息。顶空进样技术在不同产地红茶香气品质对比[7]、不同品种芒果香气差异比较[8]以及食用菌体不同部位挥发性成分分析[9]等方面均有应用。因此,分析不同顶空萃取方式的差异,综合不同顶空进样方式对香气物质定性定量的能力,对食品中香气物质的分析具有重要意义。
顶空进样方式主要分为静态顶空萃取和动态顶空萃取。静态顶空是分析半挥发性和挥发性样品常见的一种进样方式,是将样品置于密闭容器中,经过一定温度和时间后达到气液平衡,取气相部分进样,又称一次气相进样,主要包括直接静态顶空进样和顶空固相微萃取(solid phase microextraction,SPME)。动态顶空为经过连续气相萃取或多次萃取将样品中的挥发性物质全部萃取出来,通过吸附装置浓缩样品后进样解吸,主要包括吹扫捕集(purge and trap,P&T)和微阱捕集(in-tube extraction,ITEX)。
静态顶空采样主要受容器温度和平衡时间等因素的影响,样品制备简便,采集组分无干扰,但由于不同的香气组分挥发性不同,其存在于容器顶空中的含量会不同,且该方法必须进行大体积的气体进样,会影响色谱的分离效果,仅适合高度挥发性或高含量组分的检测。程凡等[10]用静态顶空的方法测定酒醅中乙醇含量,芦丽等[11]测定保健酒中的高级醇类和酯类,发现静态顶空进样适用于醇类及酯类等。SPME方法克服了传统萃取技术进样量大的缺点,集采样、萃取、进样、浓缩于一体,大大加快了分析检测的效率,但却过于依赖吸附涂层,不同萃取涂层所能萃取的物质不同,且效果差异较大[12]。
动态顶空是提取挥发性香气物质常用的方法之一,具有方法简便、快捷、无需溶剂的特点,而且提取的香气成分逼真,最接近人体嗅觉所能感觉到的气味。P&T有富集效率高、受基体干扰小、容易实现在线检测等优点,但是此系统在提取低挥发性组分时效率较低[13]。利用P&T方法对香瓜和西瓜中的挥发性物质进行鉴定,共检测到61种挥发性物质[14]。ITEX系统样品量较少,且不易受污染、操作简单、灵活,是一种用于自动进样器的全自动微萃取技术[15]。采用ITEX-气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)技术研究了啤酒麦汁主发酵过程中挥发性风味物质的组成,由此通过高级醇、酯类、有机酸和醛类建立了不同产品等级的划分方法[16]。然而,由于不同顶空萃取方法的特点及萃取效率不同,通过单一顶空萃取方式获得的食品香气信息并不全面。从珊等[17]比较了不同富集方法对植物油风味物质的影响,发现单一的富集方法对风味物质提取不全。目前单一的萃取技术均存在一定局限性,对比不同顶空萃取方式的差异,将不同顶空萃取方式进行融合,实现优势互补,可以更加完整地获取食品中的香气物质信息。
本研究拟以不同基质体系下57种极性、沸点、保留指数(retention index,RI)跨度大的食品中常见的不同类型香气物质作为研究对象,对比顶空SPME、ITEX、P&T、静态顶空4种顶空进样方式的萃取效率和能力,为GC-MS检测食品中挥发性香气物质的方法开发和应用提供实验依据。
1 材料与方法
1.1 材料与试剂
2-甲基-1-丁醇(纯度98%)、二甲基二硫醚(纯度98%)、丁酸乙酯(纯度99.5%)、正丁酸(纯度99.5%)、乙酸丁酯(纯度99.7%)、糠醛(纯度99.5%)、2-甲基丁酸(纯度98%)、异戊酸(纯度99.5%)、正己醇(纯度99.5%)、苯乙烯(纯度98%)、3-(甲硫基)丙醛(纯度98%)、γ-丁内酯(纯度98%)、2,5-二甲基吡嗪(纯度98%)、己酸甲酯(纯度99.5%)、苯甲醛(纯度99.5%)、二甲基三硫(纯度98%)、3-巯基-3-甲基-1-丁醇(纯度98%)、苯酚(纯度99.5%)、苯甲腈(纯度99.5%)、甲基庚烯酮(纯度98%)、月桂烯(纯度90%)、己酸乙酯(纯度99%)、双戊烯(纯度95%)、苯甲醇(纯度99.9%)、苯乙醛(纯度95%)、2,5-二甲基-4-甲氧基-3(2H)-呋喃酮(纯度97%)、(E)-2-辛烯醛(纯度95%)、苯乙酮(纯度98%)、正辛醇(纯度99.5%)、正庚酸(纯度98%)、苯甲酸甲酯(纯度98%)、壬醛(纯度96%)、2-苯乙醇(纯度99.5%)、1,2,4,5-四甲苯(纯度99.8%)、乙酸糠硫醇酯(纯度99%)、乙酸苄酯(纯度99.7%)、L-薄荷醇(纯度99.5%)、4’-甲基苯乙酮(纯度98%)、苯甲醛二甲基缩醛(纯度98%)、L-香芹醇(纯度97%)、香茅醇(纯度99%)、苯并噻唑(纯度96%)、香叶醇(纯度99%)、柠檬醛(纯度97%)、麝香草酚(纯度99.9%)、邻氨基苯甲酸甲酯(纯度99%)、椰子醛(纯度98%)、香草醛(纯度99%)、1,3-二甲基萘(纯度95%)、异丁香酚(纯度97%)、4-(2,6,6-三甲基-1-环己烯基)-3-丁烯-2-酮(纯度97%)、香草酸甲酯(纯度99%)、月桂酸(纯度99.5%)、十七烷(纯度99.5%)、十八烷(纯度99.5%)、(+)-诺卡酮(纯度97%)、十八醇(纯度99.5%)标准品 上海阿拉丁生化科技有限公司;氘代壬烷(DLM-2438-1,纯度98%)、氘代十二烷(DLM-338-1,纯度98%)、氘代十三烷(DLM-1354-0.1,纯度98%)、氘代十六烷(DLM-203-0.1,纯度98%)、氘代十九烷(DLM-1346-0.1,纯度98%) 美国CIL公司;乙酸乙酯(色谱级)美国Sigma-Aldrich公司。
1.2 仪器与设备
7890B/7010B GC-MS联用仪 美国安捷伦科技有限公司;Atomx全自动吹扫捕集浓缩仪 美国Tekmar公司;三位一体自动进样器(SPME、静态顶空、ITEX) 瑞士CTC Analytics公司;50/30 μm二乙烯基苯/碳分子筛/聚二甲基硅氧烷(divinylbenzene/carboxen/polydimethylsiloxane,DVB/CAR/PDMS)萃取头、PDMS/DVB萃取头、聚丙烯酸酯(polyacrylate,PA)萃取头、CAR/PDMS萃取头 美国Supelco公司。
1.3 方法
1.3.1 香气物质的提取
1.3.1.1 顶空SPME
取不同质量浓度梯度的标准品混标溶液990 μL于20 mL顶空进样瓶中,并加入氘代烷烃(氘代壬烷、氘代十二烷、氘代十三烷、氘代十六烷、氘代十九烷)混标(100 μg/mL,10 μL)。其中标准品由水或自制食品基质溶液稀释而成。样品萃取前50 ℃预热40 min。选用不同SPME进样针对样品进行萃取,萃取时间为30 min。萃取后的进样针于进样口260 ℃解吸附5 min进样。SPME萃取头分别为50/30 μm PDMS/DVB、PA、DVB/CAR/PDMS、CAR/PDMS。
1.3.1.2 ITEX
取不同质量浓度梯度的标准品混标溶液990 μL于20 mL顶空进样瓶中,并加入氘代烷烃混标(100 μg/mL,10 μL)。其中标准品由水或自制食品基质溶液稀释而成。样品萃取前50 ℃预热40 min。选用ITEX(Tenax TA 80/100)对样品进行萃取,萃取针往返抽吸进样瓶顶空气体30 次,每次样品体积1 mL,萃取体积0.5 mL,抽吸流速0.5 mL/s。萃取后的样品于200 ℃进样,进样速率为0.1 mL/s。
1.3.1.3 P&T
使用聚四氟乙烯衬垫螺旋盖的40 mL吹扫瓶,取不同质量浓度梯度的标准品混标溶液19.95 mL于P&T进样瓶中,并加入氘代烷烃混标(100 μg/mL,10 μL)。其中标准品由水或自制食品基质溶液稀释而成。P&T萃取(Trap #9捕集阱)过程中采用液体萃取模式,样品进样量为4 mL。吹扫时间40 min,吹扫温度40 ℃,吹扫流量10 mL/min。解吸温度250 ℃,解吸时间2 min。
1.3.1.4 静态顶空
取不同质量浓度梯度的标准品混标溶液990 μL于20 mL顶空进样瓶中,并加入氘代烷烃混标(100 μg/mL,10 μL)。其中标准品由水或自制食品基质溶液稀释而成。样品置于20 mL顶空进样瓶中,50 ℃孵育40 min。样品体积为1 mL,进样速率为0.5 mL/s。
1.3.2 香气物质的定量分析
1.3.2.1 GC-MS检测
采用毛细管色谱柱HP-5MS(30 m×250 μm,0.25 μm)进行分离。进样口温度为260 ℃,采用不分流模式。载气为氦气,载气流速为l mL/min。柱温箱初始温度为45 ℃,维持3 min,以5 ℃/min升温至280 ℃,并维持10 min。电子电离源;离子源温度230 ℃;电子能量70 eV。Scan扫描模式下,质量扫描范围m/z40~400。
1.3.2.2 定量方法
采用多同位素内标校正结合外标法对不同化合物的含量进行定量分析。其中,同位素内标选用较为稳定的氘代烷烃(氘代壬烷、氘代十二烷、氘代十三烷、氘代十六烷、氘代十九烷)。定量方法采用单离子检测扫描模式,选择特征离子以及特征定量离子进行分析。取虾夷扇贝的闭壳肌与0.9%的生理盐水按1∶2(g/mL)进行混合制得简易的食品基质。
1.4 数据处理
使用MassHunter系列分析软件对采集的结果进行分析。利用Office 2016、Origin 2020、TBTools[18]、SPSS 22、SIMCA 14.1、Metaboanalyst 4[19]、XLSTAT等对数据进行统计分析及绘图。
2 结果与分析
2.1 香气物质的选择
物质的挥发性与分子之间的相互作用力以及自身的分子质量大小等性质相关。食品基质中的香气物质主要可分为醛类、酮类、醇类、酯类、醚类、芳香族类以及碳氢化合物。不同类型的化合物性质差异较大。对于大部分食品的香气,成分涵盖广而复杂,从而导致了香气物质难以萃取完全,定性定量误差较大等。因此,本研究选取57种来源于不同食品的挥发性物质,进行不同萃取方式定性定量分析差异的比较。特征香气化合物种类包含烃类、酯类、醛类、醇类、酮类、酸类等主要类型化合物。其保留指数(retention index,RI)分布在700~2 000之间,涵盖较广,能够一定程度上反映出食品中不同类型的特征香气化合物色谱分离情况。同时,所选化合物的lgP值也均匀分布,分布范围在-0.6~9.3之间,能够体现出不同极性化合物的定量情况,从而进一步分析不同萃取方法萃取效率间的差异。对所选取的化合物进行色谱分离与质谱检测,各香气物质标准品性质如表1所示。
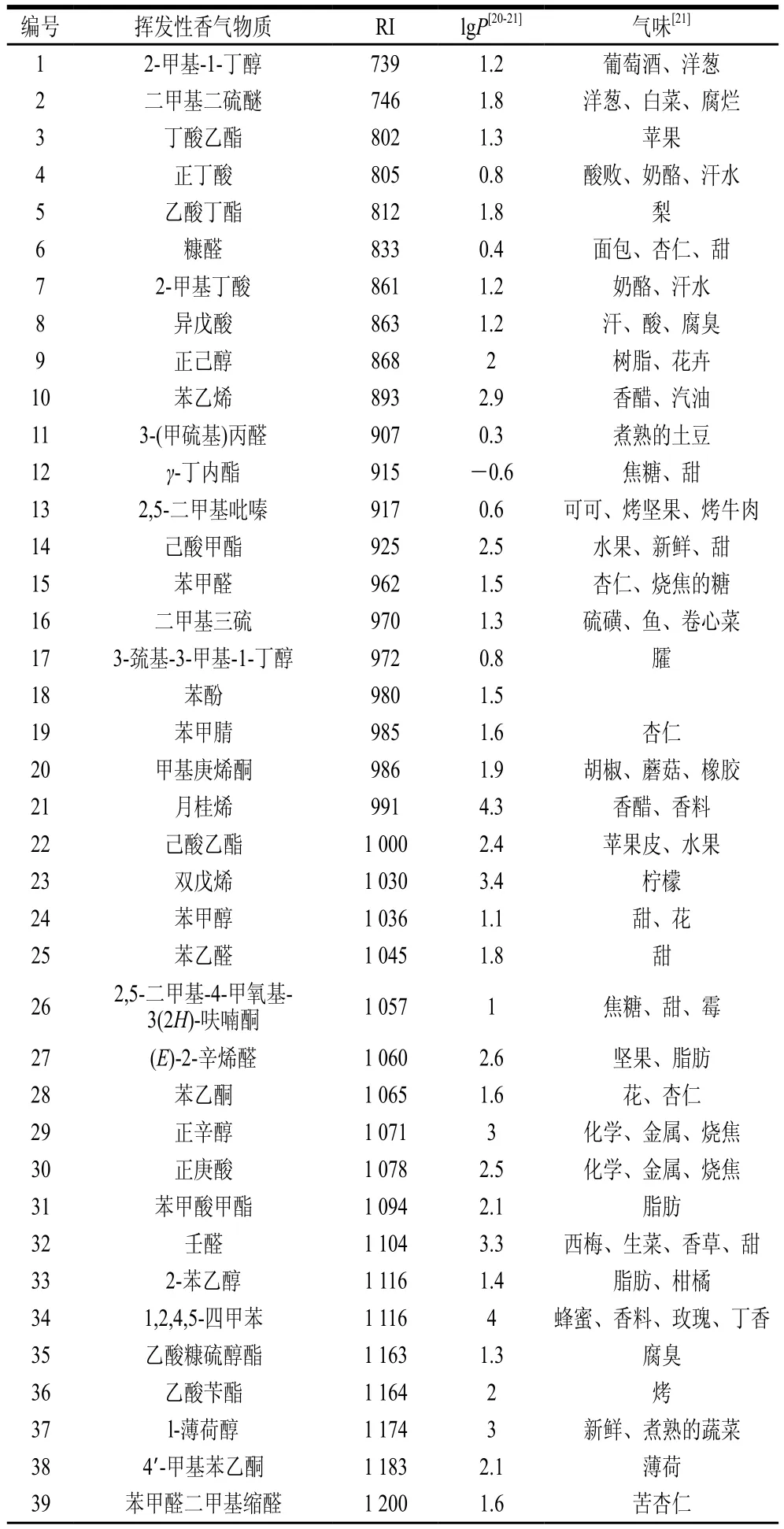
表1 不同挥发性香气物质的性质Table 1 Properties of 57 volatile aroma compounds tested in this study

续表1
2.2 不同顶空进样方法的差异分析
以GC-MS信号峰信噪比大于3作为可定性的衡量指标,通过对比相同浓度下不同顶空萃取方式,对重组香气物质混合样品萃取后质谱检测所能鉴别出的化合物数量及相对强度判断其萃取能力。为了进一步分析不同萃取方式萃取能力及与萃取物质之间的相关性,对结果进行统计学分析,如图1所示。有20种挥发性风味化合物是所有方法均可测得的,不同萃取方法富集到的挥发性风味化合物存在明显差异,这是由于富集材料的差异导致对不同分子质量、极性的挥发性化合物的吸附能力不同。虽然所选的4种不同类型SPME萃取头的萃取能力在本实验中没有明显差异,但由图1B可以一定程度上判断出PDMS/DVB萃取头萃取效果最好,其在57种挥发性风味物质中可萃取到45种化合物,对醇类、酯类物质富集效果较好。ITEX动态顶空受溶剂影响较小,对RI较低的挥发性化合物的萃取能力较好,对芳香类化合物富集效果较理想。P&T对中高沸点的挥发性化合物富集效果较差,保留时间在16 min后的化合物只富集到1,3-二甲基萘和乙位紫罗兰酮。除此之外,静态顶空和P&T均不适合酸类物质的萃取。

图1 不同萃取方法萃取能力对比Fig.1 Comparison of extraction efficiencies of different extraction methods
结合图1A与表2可知,P&T有11种风味化合物无法萃取获得,分别为4’-甲基苯乙酮、L-香芹醇、香茅醇、苯并噻唑、香叶醇、柠檬醛、麝香草酚、邻氨基苯甲酸甲酯、十七烷、十八烷、(+)-诺卡酮,大部分属于高沸点,高RI的化合物。静态顶空SPME和动态顶空ITEX之间的萃取能力差异性相对较小,而与动态顶空P&T之间差异性较大,2种顶空方式之间也差异显著,产生这种差异性可能与萃取材料的不同有关,可见相比较萃取形式,萃取头的涂层材料对挥发性化合物的萃取能力影响更大。ITEX检出的化合物中有2种SPME无法萃取得到,分别为二甲基二硫醚和2,5-二甲基吡嗪;而仅SPME方法能检出ITEX无法检出的化合物,分别为乙酸丁酯、异戊酸、正己醇、苯甲醇、2-苯乙醇等。说明在香气物质分析时,可以将SPME与ITEX结合使用,从而获得更全面的香气化合物信息[22]。
对比溶剂萃取和顶空萃取之间的挥发性化合物差异,可以发现10种化合物在所有顶空萃取方法中均无法检出(2-甲基-1-丁醇、二甲基二硫醚、正丁酸、2-甲基丁酸、γ-丁内酯、3-巯基-3-甲基-1-丁醇、苯酚、2,5-二甲基-4-甲氧基-3(2H)-呋喃酮、苯甲醛二甲基缩醛、十八醇)。说明这些挥发性化合物在进行指纹图谱分析时,需结合其他顶空或溶剂萃取方式进行检测。有文献报道[23],液液萃取和固相微萃取分离得到香气物质的种类和相对含量有一定的差异,对某些特征风味成分的分离效果也存在差异,液液萃取能较好提取出酸类,SPME能较好地提取出酯类和醇类。樊艳[24]采用SPME方法对不同腐乳中挥发性物质进行提取,利用GC-MS的方法对其中的香气物质进行定性分析,共鉴定出74种风味物质,其中醇类和酯类为主要的风味物质,表明SPME对酯类、醇类更为敏感,与本实验研究结果一致。
2.3 顶空进样方法对香气物质定量的影响
所选同位素内标涵盖了不同分子质量和RI的烷烃,对比不同萃取方式对不同同位素内标的萃取效果可以发现,SPME萃取头PDMS/DVB更适合萃取中高RI的物质,而静态顶空则适合中低RI的物质。从图1B可以看出,不同萃取方法下同位素内标的响应值有明显的差别。SPME萃取头DVB/CAR/PDMS、CAR/PDMS与ITEX方法均对中等RI的化合物萃取效果较好。SPME萃取头PA对氘代十六烷的萃取峰值明显高于其他4种氘代烷烃,萃取效果较好,而对于氘代壬烷的萃取较差,ITEX方法中氘代壬烷的峰值高于其他几种萃取方法。由于PA涂层的极性性质差异,通过实验结果发现该类型SPME萃取头更适合萃取中高质量数的极性半挥发性化合物,而ITEX相较于该类型SPME方法更适合萃取中低质量数化合物。因此,在萃取过程中针对不同萃取方式的特性进行结合,能够有效互补各萃取方式的不足,从而获得更全面的挥发性化合物信息。
SPME-PDMS/DVB、SPME-PA、静态顶空和P&T对氘代壬烷萃取效果较差,因此氘代壬烷不适合作为SPME-PDMS/DVB、SPME-PA、静态顶空和P&T萃取物低保留时间区域的定量内标。在对比的几种萃取方式中,SPME-PDMS/DVB萃取头对于氘代十二烷、氘代十三烷、氘代十六烷、氘代十九烷内标的响应值最高。对于氘代壬烷,ITEX的萃取效果最好。根据图1B中P&T方法得到的5种氘代烷烃峰高显著低于其他萃取方式,其余萃取方法均能富集到全部5种同位素内标,结合表2可以看出P&T萃取RI较大的化合物存在不足。据文献报道[25],多种同位素标记的内标用于通过补偿可能影响顶空平衡和化合物可提取性的基质效应改善分析物的定量,基于SPME-GC-MS的优化同位素稀释分析方法可以快速鉴定和量化液体烟中的挥发性化合物。Antignac等[26]研究表明用一般的内标进行定量分析时,相对标准偏差为32.6%,选用同位素内标进行定量分析时,相对标准偏差为5.7%。通过多同位素内标,可以一定程度补偿可能影响顶空平衡和化合物可提取性的基质效应改善分析物的定量[27]。
对不同顶空萃取方法富集得到的香气化合物进行质谱检测,通过梯度稀释法得到不同顶空萃取方法下不同化合物的检出限和定量限,结果如表2所示。可以看出SPME萃取头PDMS/DVB、DVB/CAR/PDMS以及ITEX富集痕量挥发性风味化合物效果较为理想,SPME对于醇类、酯类化合物更敏感(定量限均为20 ng/mL)。PDMS/DVB和DVB/CAR/PDMS萃取头对痕量检测醇类、酯类和烃类挥发性化合物效果较好。而ITEX更适合富集醛类、烃类挥发性化合物(醛类定量限为20 ng/mL,烃类定量限为10 ng/mL),检测到的化合物最低回收率为84.30%,R2大于0.95。而静态顶空与P&T痕量检测效果相对较差,检测到的醛类烃类数量少。对比不同方法的定量限可以发现SPME-PDMS/DVB对所选混合香气样品中绝大部分香气化合物的定量限均较低。但是同样存在部分化合物无法检测到,以及部分化合物定量限相比其他顶空方法较高,例如苯甲醇、二甲基二硫醚、糠醛、2,5-二甲基吡嗪。

表2 不同顶空萃取方法检出限和定量限对比Table 2 Comparison of detection and quantitation limits of different headspace sampling methods
从化合物类型看,由于不同化合物与萃取吸附涂层极性之间的差异导致化合物吸附效率不同,其中芳香族化合物和烃类化合物的检出限较低,而酸类化合物的检出限相对较高,与刘盛田等[28]利用静态顶空条件和动态顶空分析水中苯系物的结果一致。静态和动态顶空均能较好地分离与检测芳香族化合物,这与秦丹等[29]检测青稞酒中挥发性香气物质的结果一致。
2.4 溶液基质成分对香气物质定量的影响
在挥发性化合物检测过程中,复杂的食品基质会影响挥发性物质的萃取,基质越复杂,挥发性物质检测过程中的基质效应就越明显。虽然在检测过程中可以通过溶剂进行萃取,但在实际样品挥发性物质分析过程中,更多的是要获取食品原有状态下的气味轮廓。因此保持食品原有状态进行挥发性化合物信息获取更符合实际情况。
从图2可以看出,整体而言,顶空方法获得的食品香气信息受食品基质的影响均较小,但不同顶空方法之间也存在差异。SPME进样方式的DVB/CAR/PDMS、PDMS/DVB萃取头在基质影响下萃取到的挥发性风味化合物个数变化小,CAR/PDMS、PA萃取头与静态顶空提取到的挥发性化合物个数变化相对较大,说明受基质影响较大。食品的复杂基质会影响食品中特征香气物质的扩散,而对于顶空萃取而言,其主要是收集食品顶空的香气物质,在温度、压力等条件的影响下,香气物质会达到一定的气液平衡,因此相对溶剂萃取而言,其获得的气味轮廓信息变化随食品基质变化较小。

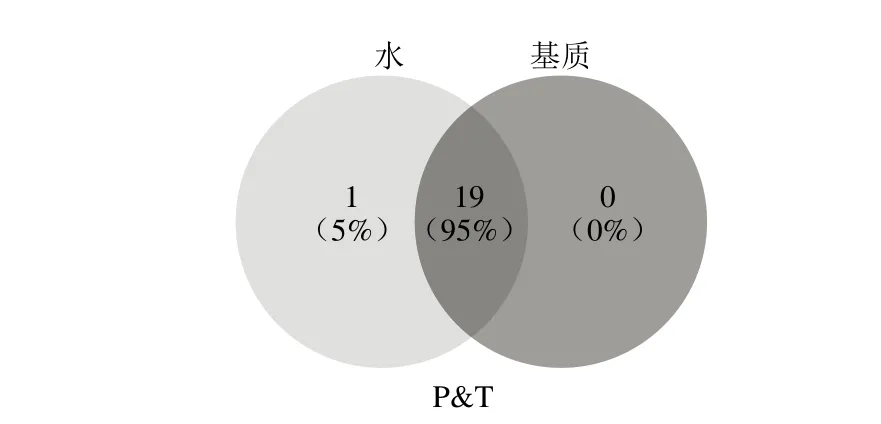
图2 基质对不同顶空萃取方法检出效果的影响Fig.2 Influence of matrix effect on the extraction efficiencies of different extraction methods
通过偏最小二乘回归法对不同顶空萃取方式特征香气物质定量情况及物质本身物理化学性质之间的关系进行综合分析,进一步判断不同顶空萃取方式的特点及所适合萃取的化合物类型。从图3可以看出,基质效应对静态顶空方式的萃取效率影响较大,而动态顶空萃取方式受到影响相对较小。这可能是由于静态顶空萃取主要是依靠顶空瓶中的香气物质脱离基体会散到顶空瓶上空达到气液平衡。而当基体从水转化成富含蛋白质、脂质、多糖等食品基质时,香气物质挥散到顶空时受到的阻碍作用增加,从而受到影响较大。而当使用动态顶空萃取时,由于整个萃取过程存在外在气体吹扫、抽吸等力的作用,会减少食品基质对香气物质的阻碍作用。对比化合物性质与不同顶空萃取方式之间的关系可以发现,P&T、ITEX和静态顶空方式的定量能力受化合物lgP、RI和分子质量的影响较大。P&T、ITEX和静态顶空方式可能对中高极性的化合物的萃取趋势更大。除此之外,可以看出顶空萃取方式更倾向于获取中等RI挥发性化合物的定量信息。在实际检测分析时,可以根据不同萃取方法特性进行结合,获得更全面的香气信息。因此,在有食品基质下检测挥发性化合物可以优先结合SPMEPDMS/DVB萃取头和ITEX萃取方法。

图3 基质下不同萃取方法萃取能力与化合物性质关系偏最小二乘回归分析Fig.3 Partial least squares regression analysis of the relationship between the extraction efficiencies of different extraction methods and the properties of compounds as influence by matrix effect
3 结 论
不同萃取方式对食品中香气物质的富集存在明显差异。香气物质的顶空萃取方式由于吸附涂层的差别,会导致香气物质的萃取量、萃取效率、萃取稳定性等发生变化。对于SPME方式而言,PDMS/DVB萃取头更适合于水基质中特征香气物质的富集;ITEX动态顶空方式结合了吸附填料、动态吹扫和微管浓缩等优势,定量限为10 ng/mL,不仅能有效减少食品基质的影响,同时也提高了香气化合物的萃取效率;P&T和静态顶空更适合于低沸点化合物的定量。利用多种同位素内标在GC-MS检测中RI的广度分布结合不同顶空萃取方式,并通过不同保留时间进行合适的定量校正内标筛选,能够有效提高食品中特征香气物质的定量结果精度。通过对比不同顶空萃取方式的萃取能力,在优势互补下将SPME与ITEX结合能够有效提高获得的食品香气指纹信息的完整性与准确性。

