一种5 重real-time PCR筛查转基因水稻方法的建立
董立明,杨 帆,邢珍娟,李葱葱,闫 伟,龙丽坤,李飞武
(吉林省农业科学院农业质量标准与检测技术研究所,吉林 长春 130033)
随着转基因技术在农业领域的广泛应用,转基因作物的研发和产业化迅猛发展[1]。根据国际农业生物技术应用服务组织发布的统计数据,2018年全球26 个国家种植转基因作物,种植面积达1.917亿 公顷[2]。虽然转基因作物在品种抗性、营养改良等方面表现优良,但其安全性问题引起了公众的广泛关注[3-4]。为此世界上许多国家和地区相继建立了转基因产品标识制度,对其进行监管,转基因检测技术作为监管的手段已成为研究的重点[5]。
目前,转基因产品检测技术主要基于聚合酶链式反应(polymerase chain reaction,PCR)技术开展[6]。如普通PCR法[7]、多重PCR法[8-9]、实时聚合酶链式反应(realtime polymerase chain reaction,real-time PCR)法[10-11]、数字PCR法[12-14]等,同时也有一些等温扩增技术用于转基因的检测,如环介导等温扩增反应、重组酶聚合酶扩增[15-16]等。随着商品化种植的转基因作物品系逐年增多,传统的单重PCR方法越来越难以满足实际检测的需要,研制精准、快速、高通量的检测方法已成为转基因检测技术的发展趋势[17]。多重real-time PCR是将多对引物和不同荧光标记的TaqMan探针放入一个反应体系中,一次性检测多个靶标的方法,不仅能节省样品和试剂,同时也能大大缩短检测时间,实现一管多检的高效率。此方法在微生物和病毒的检测中已广泛应用[18-21],在转基因检测方面,也有一些报道,Wang Fengjun等[22]建立了能同时检测Rbcl、CaMV35S启动子、NOS终止子、NPTII四个基因的4 重real-time PCR方法;Niu Chenqi等[23]利用多重real-time PCR结合数字PCR建立了同时检测CaMV35S启动子、NOS终止子、NPTII、PAT及Adh1的5 重real-time PCR检测方法;Cottenet等[24]开发了同时检测6种外源基因和6种转化事件的2 个多重real-time PCR检测方法;Dong Liming等[25]建立了同时检测内源基因Lectin和7种转基因大豆的2 个多重real-time PCR方法。
根据国内外相关数据库的统计信息,目前已知的转基因作物中70%以上使用了CaMV35S启动子,60%以上使用了NOS终止子,至少含有两者之一的转基因作物种类占全部转基因作物的85%以上[26]。此外,通过对已知转基因水稻转化体的序列分析发现,Cry1Ab/Ac基因、HPT基因是转基因水稻中应用最广泛的目的基因。因此,选择这4种基因元件作为转基因成分筛选检测的靶标对象,具有很好的代表性。本研究以转基因水稻KF6号为材料,建立水稻中的CaMV35S启动子、NOS终止子、Cry1Ab/Ac基因、HPT基因及SPS基因的5 重real-time PCR方法。该方法将5 个靶标进行不同的荧光标记,根据不同荧光通道的扩增曲线,准确识别测试样品中的转基因成分。
1 材料与方法
1.1 材料与试剂
实验所用材料见表1,以转基因水稻KF6号为阳性对照,非转基因水稻为阴性对照,其他转基因玉米、大豆、水稻、棉花、油菜等材料用于特异性、适用性测试,以上样品均由本实验室收集保存。

表1 用于测试的转基因样品汇总Table 1 Genetically modified crop samples tested in this study
植物基因组提取试剂盒 德国Qiagen公司;HR qPCR Master Mix 上海辉睿生物科技有限公司;检测引物和探针由生工生物工程(上海)股份有限公司合成和纯化。
1.2 仪器与设备
ND8000紫外-可见光分光光度计 美国Thermo Fisher公司;CFX96实时荧光定量PCR仪 美国Bio-Rad公司;5424高速离心机 德国Eppendorf公司。
1.3 方法
1.3.1 样品基因组DNA提取
将所有样品研磨成粉末,按照Qiagen试剂盒使用说明书,提取全部实验样品的基因组DNA,用分光光度计测量DNA的质量和浓度,用1×TE溶液将样品DNA稀释至25 ng/μL,4 ℃冷藏保存备用。
1.3.2 引物筛选
通过查询网络数据库、国内外专利、科技论文等方式,获得已报道的CaMV35S启动子、NOS终止子、Cry1Ab/Ac、HPT及SPS基因real-time PCR检测方法的引物序列,经引物配对筛选,确定本研究所需的引物和探针信息(表2)。用灭菌超纯水将引物和探针干粉溶解至20 μmol/L,-20 ℃保存备用。

表2 5重real-time PCR体系引物/探针信息Table 2 Information about primers used for pentaplex real-time PCR system
1.3.3 5重real-time PCR体系反应条件优化
针对5 重real-time PCR体系的引物/探针终浓度、退火温度、反应循环数等重要影响因素,优化实验设计如表3所示。第1步,采用real-time PCR国标方法中通用的退火温度和反应循环数,对反应体系中各靶标的引物/探针终浓度进行优化,每个靶标的正反引物用量相等,探针用量为引物的一半。第2步,使用筛选出的引物/探针终浓度,采用正交试验的方式,对退火温度和反应循环数进行优化。最终筛选出5 重real-time PCR的最佳反应条件。

表3 5重real-time PCR条件优化Table 3 Optimization of reaction conditions for pentaplex real-time PCR system
1.3.4 5重real-time PCR和单一real-time PCR扩增体系及程序
5 重real-time PCR体系:HR qPCR Master Mix 12.5 μL,引物和探针预混液5.625 μL,DNA模板2.0 μL,加超纯水至25 μL。
单一real-time PCR体系:HR qPCR Master Mix 12.5 μL,正反引物各0.5 μL,探针0.25 μL,DNA模板2.0 μL,加超纯水至25 μL。
5 重real-time PCR和单一real-time PCR的扩增程序:第1阶段95 ℃变性5 min;第2阶段95 ℃变性15 s,60 ℃退火延伸60 s,共进行45 个循环;在第2阶段的退火延伸(60 ℃)时段收集荧光信号。
1.3.5 5重real-time PCR体系特异性验证
以7种常见转基因水稻和非转基因水稻的基因组DNA为模板,进行5 重real-time PCR体系的扩增,每个样品3 个平行,验证5 重real-time PCR检测体系的特异性。
1.3.6 5重real-time PCR体系灵敏度测试
用0.1×TE稀释阳性对照样品的DNA,制备一系列浓度梯度的灵敏度测试样品,进行5 重real-time PCR扩增,每个样品3 个平行,确定5 重real-time PCR体系的灵敏度。
2 结果与分析
2.1 5 重real-time PCR条件的优化
为实现在同一管中同时检测5 个靶标,调整反应体系和反应程序是关键。以10 ng的转基因水稻KF6号基因组DNA为模板,分别对5 重real-time PCR体系中的引物/探针终浓度、退火温度及循环数的设置处理(表3)进行测试。结果显示:在引物/探针终浓度测试中,当5 重real-time PCR体系中SPS基因、CaMV35S启动子、NOS终止子、Cry1Ab/Ac基因、HPT基因的引物终浓度为0.4、0.3、0.4、0.3、0.4 μmol/L时,5 个靶标均能获得典型扩增曲线,且曲线的荧光值最接近和Ct值差异最小;在退火温度与扩增循环数的正交试验中,当退火温度为60 ℃,扩增45 个循环时,各靶标均能获得最佳的扩增结果(图1)。依据以上测试结果,确定了1.3.4节5 重real-time PCR检测方法的反应体系和反应程序。

图1 5重real-time PCR检测体系的扩增曲线Fig.1 Amplification curves of pentaplex real-time PCR system
2.2 5 重real-time PCR体系的特异性验证结果
为实现水稻中转基因成分的筛查,选择转基因水稻KF6号、KF2号、TT51-1、M12、KMD、TIC-19、T2A-1以及非转基因水稻等样品,测试5 重real-time PCR体系的特异性。如表4所示,非转基因水稻样品仅获得SPS基因的典型扩增曲线,无其他靶标扩增;其他转基因水稻样品不但扩增到SPS基因,还获得了各自包含相应靶标的扩增曲线。所有测试样品的扩增结果与材料本身所包含的筛选元件和目的基因一致[32],无假阴性结果和非特异性扩增的情况出现,表明建立的5 重real-time PCR体系可特异性用于包含以上5种元件的转基因水稻的检测,可对目前已知的转基因水稻进行高效筛查。

表4 5重real-time PCR特异性验证Table 4 Specificity validation of pentaplex real-time PCR system
2.3 5 重real-time PCR体系的灵敏度测试结果
将KF6号的DNA进行一系列梯度稀释,获得每种靶标质量分数分别为100%、20%、4%、0.8%、0.16%、0.032%、0.016%、0.008%的8 个DNA样品,开展灵敏度测试。如图2所示,当靶标质量分数为100%~0.032%时,所有5 个靶标均能扩增到典型扩增曲线(Ct值在23.82~37.93之间),且依据以上稀释浓度建立的标准曲线具有很好的线性关系(斜率范围-3.162~-3.356,相关系数R2范围0.997~0.999,扩增效率范围98.3%~106.1%);当靶标质量分数在0.016%及以下时,虽CaMV35S启动子、NOS终止子、Cry1Ab/Ac、HPT四个靶标能够稳定扩增,但SPS基因扩增不稳定,经常存在平行实验不能稳定扩增的情况。表明本方法的检测灵敏度可达到0.032%。

图2 5重real-time PCR检测体系的灵敏度测试Fig.2 Sensitivity testing of pentaplex real-time PCR system
2.4 5 重real-time PCR与单一real-time PCR的检测能力比较
用单一real-time PCR扩增上述浓度梯度的稀释样品,验证5 重real-time PCR体系的检测灵敏度水平。结果见图3,CaMV35S启动子在单一real-time PCR与5 重realtime PCR中的扩增效率分别为105.1%和103.6%,R2均为0.999(图3A);NOS终止子的扩增效率分别为98.4%和100.7%,相关系数分别为0.998和0.999(图3B);Cry1Ab/Ac的扩增效率分别为106.1%和105.2%,相关系数分别为0.998和0.999(图3C);HPT的扩增效率分别为101.9%和98.3%,相关系数分别为0.999和0.997(图3D),SPS的扩增效率分别为102.8%和106.5%,相关系数分别为0.996和0.999(图3E),说明从扩增效率和R2等方面比较,在100%~0.032%的靶标质量分数范围内,单一real-time PCR与5 重real-time PCR无明显差别,两种方法具有同等的稳定性和检测能力。表明本研究建立的5 重real-time PCR方法灵敏度高、稳定性好,适用于水稻中转基因成分的高灵敏度检测。
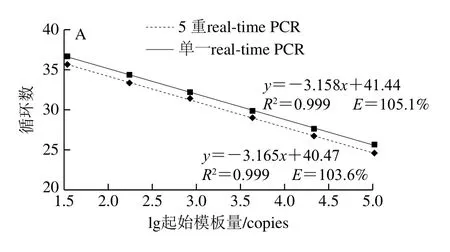

图3 5重real-time PCR与单一real-time PCR的检测能力比较Fig.3 Comparison of detection performance between pentaplex real-time PCR and single real-time PCR
2.5 5 重real-time PCR体系在其他转基因作物筛查中的应用
在5 个筛选靶标中,SPS作为内源基因仅存在于水稻样品中,其他4 个靶标CaMV35S启动子、NOS终止子、Cry1Ab/Ac、HPT被广泛应用于玉米、大豆、棉花、油菜等转基因作物中。因此本研究选择30种常见的转基因原材料,验证5 重real-time PCR体系在其他转基因作物筛查中的适用性。如表5所示,测试样品的扩增结果与预期基本吻合,仅在MON810、Bt176玉米中未检测出预期的Cry1Ab基因,这可能是因为本研究所采用的Cry1Ab/Ac基因引物序列与上述2 个样品的Cry1Ab基因相应序列存在多个碱基不匹配。总体而言,利用本研究建立的5 重real-time PCR体系,可从30种测试转基因材料中检测出相应的转基因成分,表明此方法不仅适用于水稻中转基因成分的检测,也可对其他转基因作物进行筛查。

表5 5重real-time PCR适用性测试Table 5 Applicability of pentaplex real-time PCR system
3 讨论与结论
CaMV35S启动子、NOS终止子、Cry1Ab/Ac基因、HPT基因是当前商业化应用的转基因作物中最常见的外源基因,也是转基因产品分子检测最常用的筛查元件。在日常检测工作中,一般采用先筛查常见外源元件,然后再鉴定转化事件的方式,确定待检样品是否为转基因产品及含有的转基因身份。为了提高检测通量和效率,国内外学者采用多重PCR策略,以实现在同一管中一次检测多个靶标。其中,多重real-time PCR以操作简单、耗时时间短、可有效避免气溶胶污染等优点被广泛应用。在实际应用中,不同靶标的引物/探针浓度配比、退火温度、扩增循环数都会对多重real-time PCR扩增效果产生影响。针对上述影响因素,本实验均设置多个处理,进行大量的筛选,最终建立了5 重real-time PCR方法。
与前期已发表的转基因水稻多重real-time PCR检测方法相比,本研究的优点在于,通过分析国内外已批准的转基因水稻中的外源基因元件,选择其中最常见的4种及水稻内源基因,建立了5 重real-time PCR体系,实现了对常见基因水稻的全覆盖筛选检测。Gu Shaobin等[33]建立的转基因水稻多重real-time PCR方法以CaMV35S启动子和水稻内标基因SPS为标靶,对样品中的转基因成分进行定量检测。张明哲等[1]建立的复合PCR荧光检测方法是经复合PCR扩增和毛细管电泳荧光检测,实现对4种转基因水稻品系的检测。而本研究建立的方法是为了快速测定样品中是否含有转基因成分,实现的目标不同。在转基因检测的实际工作中,将本研究的筛选方法与转化体特异性检测方法结合使用,则即可实现筛选检测,又能实现身份鉴定。
本研究建立的5 重real-time PCR特异性好,灵敏度可达单一real-time PCR水平,并且具有很好的适用性,能对国内外已批准的常见转基因水稻进行初步筛查检测,还可对常见转基因玉米、大豆、棉花和油菜进行筛查。此方法的研发,为转基因水稻监管和筛查提供了一种高效的技术手段。

