医用钛系高熵合金的设计与进展
刘吉奎,张香云,2,袁子洲
(1.兰州理工大学材料科学与工程学院,甘肃兰州 730050;2.兰州理工大学温州泵阀工程研究院,浙江温州 325105)
1 引 言
钛及其合金由于具有高比强度、高耐蚀性及“亲生物”性等优势,作为生物医用材料广泛应用在临床上。然而,钛合金(Ti6Al4V)长期植入后,容易在体液作用下释放出有毒副作用的金属离子,对人体产生危害[1]。此外,钛合金的弹性模量远高于人骨的弹性模量,易因“应力屏蔽”作用抑制新骨生长。尽管近年来科研工作者研发的第三代低弹性模量的医用β钛合金(体心立方晶格,BCC)的弹性模量更接近于人骨,但强度却有所下降[2]。为了解决传统医用合金在临床中的不足,强烈需要开发综合性能良好的新一代金属材料,以满足未来医学需求。2004年,叶均蔚等[3]提出了高熵合金(HEAs)的全新概念。HEAs一般含5~13 种主元,每种主元的原子占比在5%~35%之间,高构型熵使其微观结构易于形成简单固溶体相。其中,BCC 相的合金具有更低的弹性模量及优异的耐蚀性[4]。设计由无毒元素合金化而成的β钛系HEAs,有望突破传统医用合金在临床应用中的不足[5]。因此,钛系HEAs在未来医学行业具有很大的应用潜力。
2 医用钛系高熵合金的设计
2.1 合金元素的筛选
作为医用金属材料,优选已被公认的具有生物相容性的无毒或低毒元素是先决条件。结合纯金属对小鼠成纤维细胞(L929)的毒性顺序、合金植入后的生物相容性[6]以及元素含量对骨稳态的影响[7]等研究可知,Fe、Mo、316L 不锈钢和Co-Cr合金等具有某种程度的生物相容性,Zr、Nb、Sn、Ta等则具有优异的生物相容性,而Al、V、Cu、Ni、Co、Cr等有毒。
此外,钛系HEAs中能降低α/β转变温度,使β相区增大,且在β相中比α相(密排六方晶格,HCP)有更大的溶解度的元素称为β稳定元素。若β稳定元素的含量足够高,快淬时无马氏体生成而β相全保留下来,可将该类合金称为β钛系HEAs。因此,通过添加一定量的β稳定元素能使钛系HEAs中的β相保持稳定,如添加同晶型元素V、Ta、Nb、Mo等易与β-Ti合金形成无限固溶体;可形成有限固溶体的共析型元素有Si、Cr、Mn、Fe、Co、Ni和Cu等[9];中性元素Zr和Sn也是β-Ti合金常用的添加元素。该类合金具有低弹性模量和高耐蚀性等优点[8],通常被用作生物医用植入材料。
综合考虑细胞毒性、元素对骨稳态的影响和β稳定元素,Fe、Zr、Nb、Mo、Sn、Ta等元素与β-Ti可用于制备无毒、生物相容性良好的HEAs[10-11]。
2.2 合金相的选择
由于HEAs中各原子随机占据晶体点阵位置,被认为易形成典型固溶体结构[12]。为了预判其固溶度,ZHANG 等[13]对Hume—Rothery[14]提出的二元合金的相形成经验规则进行修正,将影响HEAs相形成的因素归结为原子半径、混合焓和混合熵的变化,并得出了HEAs固溶度与一系列热力学参数之间的关系。表1为医用钛系HEAs各组成元素的物理化学参数。
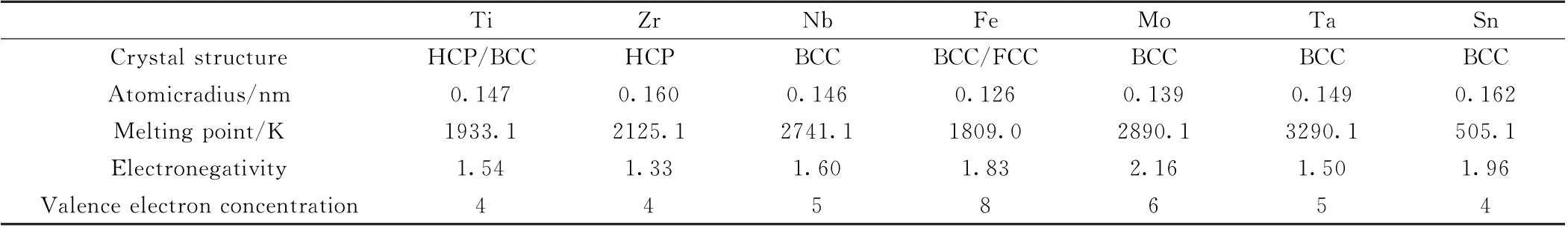
表1 HEAs各组成元素的物理化学参数Table 1 Physical and chemical parameters of alloy elements
原子半径均方差δ:

式中:T为绝对温度,ΔHmix为混合焓,R为摩尔气体常数。ΔGmix值越低HEAs的固溶体相越稳定。结合ΔHmix、ΔGmix对多主元固溶体稳定性的影响,Zhang[15]提出新的参数Ω:

考虑到组元原子的电子结构不同,采用组成元素的电负性差Δx来预测HEAs中的中间相的形成。

式中:x i为组元i的电负性,为各元素的平均电负性。HEAs的Δx<0.117时,无中间相存在;当Δx>0.133时,中间相可以稳定存在。
用参数价电子浓度VEC来预测相形成规律:

当VEC>8.6 时,HEAs 的FCC 相稳定存在;当VEC≤6.87时,HEAs的BCC相趋于稳定;当6.87<VEC<8.6时,BCC相与FCC相共存。
虽然β钛系HEAs具有更加良好的生物相容性,但随研究的不断深入,发现大多数HEAs包含各种中间相。因此,钛系HEAs的发展不应局限于简单的固溶体相。
3 生物相容性原则
生物相容性作为评价医用材料性能的指标之一,被ISO 定义为生命体组织对非活性材料产生反应的一种性能,即材料与宿主之间的相容性,包括生物安全性原则和生物功能性原则[17]。
3.1 材料弹性模量对生物相容性的影响
生物医用合金对弹性模量非常敏感,若其相对骨骼的弹性模量(10~40 GPa)过高,则造成“应力屏蔽”,接触面间易产生松动导致合金植入失败;若其过低,则较大的应力下难以起到固定和支撑的作用。因此,医用合金的理想弹性模量要尽可能接近或略高于人骨的弹性模量[18]。
图1为合金弹性模量与人骨弹性模量的比较[19]。可以看出,应用最为广泛的传统医用合金中,Ti6Al4V合金的弹性模量最低,β钛系HEAs弹性模量更接近人骨弹性模量。因此,对于β系钛HEAs的研发倍受关注,有望解决传统医用合金在弹性模量上与人体骨骼不匹配的难题。

图1 传统合金CoCr Mo、316LSS及Ti6Al4V 和β系钛高熵合金TiZr Ta Hf Nb及Ti1.5 Zr Ta0.5 Hf0.5 Nb0.5与顶骨、枕骨弹性模量的比较[19]Fig.1 Comparison of elastic modulus between CoCr Mo,316LSS and Ti6Al4V traditional Alloy,TiZr Ta Hf Nb and Ti1.5 Zr Ta0.5 Hf0.5 Nb0.5 beta titanium based high entropy alloys with parietal,occipital bone[19]
3.2 耐蚀性对生物相容性的影响
医用金属在临床应用中遇到的挑战在于腐蚀过程中释放的金属离子刺激不必要的免疫反应,并使材料植入后自身性能降低。材料的微观组织和表面状态与腐蚀密切相关,设计和制备医用合金时应重视合理的相预判、调控微观组织及改善材料的表观质量[20]。
耐生理腐蚀性是植入材料成败的关键因素之一。传统的生物医用合金如316L、CoCr Mo和Ti6Al4V 分别在Ag/AgCl腐蚀液中出现点蚀行为,引发人们的大量关注。然而,TiZr Ta Hf Nb 和Ti1.5Zr Ta0.5Hf0.5Nb0.5HEAs在腐蚀过程中出现连续的钝化平台且无点蚀,钝化电位高达1800 m VAg/AgCl,成为一种很有实际应用价值的生物植入候选材料[19]。
3.3 耐磨性对生物相容性的影响
钛合金的耐磨性较差,长期使用在人体髋关节等部位易出现骨质溶解等问题,导致生物相容性降低。但由于HEAs的“晶格畸变效应”,使合金表面具有较高的晶格畸变能,耐磨性优于传统医用合金。例如AMIR M 等[19]和 BRAIC 等[21]分别制备的TiZr Ta Hf Nb、Ti1.5Zr Ta0.5Hf0.5Nb0.5HEAs 和(TiZr Nb Hf Ta)N 及(TiZr Nb Hf Ta)C HEAs涂层的平均硬度均高于316LSS、CoCr Mo和Ti6Al4V 等传统医用合金,使HEAs耐磨性得到显著提高,为耐磨合金的设计提供了重要思路。
3.4 体外细胞相容性的评价
虽然钛系医用HEAs具有良好的生物相容性,但目前HEAs尚未应用于临床。人们通过体外模拟培养成骨细胞来评价其生物相容性。将成骨细胞分别定量培养在SUS 316L 和TiNb TaZr Mo HEAs上,由于退火后HEAs中组成元素晶粒粗化和/或重新分布导致该HEAs上的成骨细胞数明显多于其他合金,促进了细胞增值[22]。根据钛、锆可支持造骨细胞的增殖生长和骨质接合的报道[23],TAKO HORI等[11]调整原子含量设计了非等原子Ti-Nb-Ta-Zr-Mo HEAs,HEAs标本上成骨细胞纤维粘附量高于SUS 316L,且Ti1.4Zr1.4Nb0.6Ta0.6Mo0.6纤维黏附结构明显延长,表现出良好的生物相容性和生物活性。
钛系HEAs体外实验表明,合金的表面形貌对所培养的细胞的生物活性有很大的影响,这些HEAs具有促进成骨细胞分化与增值能力,细胞未显示出过敏性,这为加快其在临床中的应用提供了理论指导。
4 结 论
HEAs作为一个全新的概念,在材料领域的研究具有非凡的价值和潜力,与复合材料、大块非晶并称为未来几十年最具有发展潜力三大热点。虽然HEAs探索刚刚起步,要植入到生物体内还很长的路要走,但利用微调成分适当的合金化,从生物安全性、良好的生物相容性等优势设计医用HEAs,很有可能改善传统合金在医用时产生的不良反应而成为替代材料,在临床实践方面具有广阔的应用前景。尽管目前关于医用钛系HEAs已经做了很多研究工作并取得了一些开创性的研究成果,但目前还存在如下问题有待解决:
1.当前有关HEAs的凝固原理、腐蚀机理研究较少,热稳定性研究也不系统,需要进一步完善材料设计的各种理论依据。
2.对HEAs性能的研究还不全面,植入性试验的研究较少,需不断调整参数,致力于开发出生物相容性更优异的医用钛系HEAs。

